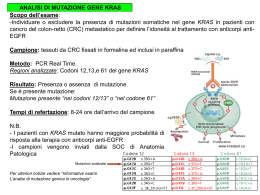
Carcinosi peritoneale sincrona da carcinoma colorettale: citoriduzione, HIPEC e chemio-terapia sistemica tra entusiasmi e scetticismi Quale chemioterapia sistemica? Dott. Giuseppe Colosini U.O. Oncologia Ospedale Manerbio Az. Ospedaliera Desenzano D/G L’innovazione nell’organizzazione e nell’assistenza in Chirurgia3° Convegno congiunto della società lombarda triveneta di chiururgia Desenzano, 11 maggio 2012 • La carcinosi peritoneale viene definita come la diffusione e l’impianto di cellule neoplastiche nella cavità peritoneale risultante in accumuli di tessuto tumorale che coinvolgono il peritoneo parietale, pelvico e diaframmatico e la superficie di rivestimento degli organi contenuti nella cavità addominale. La carcinosi peritoneale: malattia metastatica? • • • • - 10%- 30% sincrona a tumori gastrointestinali - 25%- 35% metacrona (recidiva intraperitoneale) - Sopravvivenza mediana 6 mesi - Chemioterapia: 50%di risposte obiettive con sopravvivenza globale di 15-18 mesi • - 50% di tossicità di grado III-IV! • Peritoneal carcinomatosis from colorectal cancer.Jayn et al. Br. J Surg 2002. CARCINOSI PERITONEALE DA CA COLORETTALE • La carcinosi peritoneale rappresenta una modalità di disseminazione del Ca colon-rettale • Può essere presente senza coinvolgimento linfatico o metastasi a distanza • Può essere presente associata a «early» stage o a neoplasia con scarsa aggressività biologica. • Peritoneum as the first-line of defence in carcinomatosis. • Paul H.Sugarbaker. Editorial Jornal of surgical oncology 2007 CARCINOSI PERITONEALE DA CA COLORETTALE • Carcinosi peritoneale sincrona da ca colon-retto: 1. - Diagnosi pre-operatoria 2. - Riscontro intra-operatorio (in urgenza!) 3. - Carcinosi peritoneale sincrona con metastasi epatica (unica o multiple)-stadio IV Quali scenari diagnostici? • Il riscontro pre-operatorio di carcinosi peritoneale obbliga a una valutazione della possibilità di affrontare una chirurgia con intento radicale. • La peritonectomia è concettualmente molto lontana dal debulking: rimane essenzialmente un intervento di citoriduzione, ma con l’obiettivo reale di asportare la malattia fino ad Ro. • La valutazione diagnostica richiede la valutazione del PCI (Peritoneal Cancer Index), medinate TAC e PET total body ed eventuale VLS Carcinosi peritoneale, sincrona (diagnosi pre-operatoria strumentale). • La valutazione del PCI non può prescindere da: • Identificazione del tipo istologico della neoplasia • Ca mucinoso • Grading, • Espressione di EGFR con ricerca delle mutazioni dei codoni 12 e 13 del K-ras + B-RAF per il cod. 61, elevazione del CEA, Ca 19-9 e Ca 125, Ca 15-3) • • • • Performans status Età ( ≤ 70 ≥ 70 anni) Presenza di patologie associate o pregresse L’esistenza di esiti di precedenti interventi chirurgici Parametri necessari per decisione terapeutica ottimale medica e chirurgica Parametri clinici determinanti per la scelta terapeutica Età Resecabilità PS Sintomi PAZIENTE TUMORE Estensione Comorbid. Clinica TERAPIA Efficacia tossicità costi • In assenza di metastasi intra-epatiche o di metastasi polmonari, l’assenza di comorbilità gravi (ECOG ≤ 2) , l’assenza di ascite, istologia nota con immunofenotipo e PCI favorevole (≤ 19) si può procedere per una citoriduzione chirurgica in prima istanza o dopo CT di induzione con 3 cicli (scelta individualizzata) • Per citoriduzione si intende l’asportazione chirurgica di tutto il peritoneo colpito da carcinosi e degli organi da essa coinvolti. • A seguire chemioterapia adiuvante La Chirurgia citoriduttiva è la prima istanza terapeutica per Carcinosi sincrona limitata Carcinosi peritoneale Citoriduzione limitata, sincrona chirurgica PCI ≤ 19 Non malattia extraperitoneale Individualizzata scelta di far seguire HIPEC O citoriduzione con sCT x 3 o 4 cicli e poi se non PD si procede con Peritonectomia Non ascite ECOG ≤ 2 A seguire CT adiuvante FOLFOX IV Età ≤ 70 anno Residui neoplastici fino a 5 mm e cellule neoplastiche disperse in peritoneo durante la procedura chirurgica si possono bonificare con chemioterapia ipertermica intraoperatoria con Cisplatino e Mitomicina (Sugarbacker) Carcinosi peritoneale sincrona limitata • Il riscontro di carcinosi peritoneale durante l’intervento chirurgico, obbliga a considerare la possibilità di affrontare la scelta di una chirurgia citoriduttiva completa (Ro) con le stesse considerazioni già segnalate. • Se l’intervento avviene con procedura VLS diventa un momento diagnostico iniziale con possibilità di differire la scelta di chirurgia laparotomica, effettuato l’adeguato staging precedentemente indicato. • Si può considerare la scelta di una terapia neoadiuvante per 3 o 4 cicli prima dell’intervento Carcinosi peritoneale sincrona ( riscontro intra-operatorio). • Situazione di carcinosi sincrona avanzata, non operabile per il rischio di solo debulking senza vera citoriduzione completa (PCI ≥ 19), presenza di ascite • Presenza di metastasi epatiche al momento non resecabili. • Stato di decadimento delle condizioni generali (PS > 2) con rischio di complicanze maggiori post-operatorie. • Un terapia chemio-antiblastica sistemica può migliorare le condizioni generali del paziente e rendere possibile una chirurgia per patologie a istotipo particolarmente chemiosensibile (in genere K-ras Wilde tipe), ottenuta una evidente regressione della patologia in soggetti giovani Quando una chemioterapia primaria? • Risulta efficace nel prolungare la sopravvivenza di pazienti con tumore avanzato o metastatico. • La somministrazione del trattamento alla diagnosi presenta dei vantaggi rispetto alla somministrazione al momento della comparsa dei sintomi sia in termini di sopravvivenza che di qualità della vita • (Livello di evidenza I). • Non si osservano differenze di risposte in relazione all’età del paziente. Terapia medica (chemioterapia e farmaci biologici)-quale ruolo?) • "Molecular and genetic profiling of colorectal cancers," they add, "may establish a gene signature that is predictive of a propensity for peritoneal carcinomatosis colorectal cancer and may lead to selection of alternative adjuvant or advanced disease management strategies" for these patients. • (J Clin Oncol 2011. Maurie Markman, MD; Chief Editor: Bruce Buehler, MD ) Clinical Implications of the Genetic Mutations • Approximately 30% to 50% of colorectal tumors are known to have a mutated (abnormal) KRAS, indicating that up to 50% of patients with CRC might respond to anti-EGFR antibody therapy. • However, 40% to 60% of patients with wild-type KRAS tumors do not respond.[3] • Data from retrospective studies suggest that mutated BRAF, which is present in 5% to 10% of tumors, can also affect response to these agents, especially in patients with wild-type KRAS.[4, 5] • KRAS mutation status is determined via PCR analysis of formalinfixed, paraffin-embedded block, unstained slides, or fresh snap frozen biopsy tissue for the presence of a mutation in codons 12, 13, or 61 of the KRAS gene on chromosome 12. • BRAF V600E mutation status is also determined via PCR analysis of formalin-fixed, paraffin-embedded tissue. Colorectal Cancer and KRAS/BRAF Fattori prognostici-predditivi Predictive of efficacy • EGFR • Immunohistochemistry (IHC) detection • Fluorescence in situ hybridization (FISH) detection • Gene mutations • Gene expression levels/ profiling • Gene polymorphisms • EGFR ligands Predictive of resistance • KRAS gene mutations • BRAF gene mutations • PIK3CA mutations • Loss of PTEN Cetuximab vs BSC - Overall Survival Phase 3 Jonker-Karapetis, NEJM 2008 mutated KRAS median 4.8 mos wild type KRAS median 9.5 mos HR for death = 0.55 Cetuximab associated with improved overall survival among patients with wild-type KRAS tumors but not among those with mutated KRAS tumors. The difference in treatment effect according to mutation status was significant (test for interaction, P = 0.01). NCIC CTG C0.17 trial; Karapetis C et al, NEJM 2008 KRAS data in first line treatment of mCRC CRYSTAL study (KRAS wild-type) cetuximab + chemotherapy Chemotherapy alone CRYSTAL KRAS wt OPUS KRAS wt estimate PFSPFS 1.0 HR=0.68 0.6 0.4 0.2 70 cetuximab + FOLFIRI FOLFIRI 0.0 60 0 61 59 2 50 40 43 37 30 20 10 8 10 12 Time (months) 14 16 18 43% risk reduction for progression HR=0.57 0.6 0.4 cetuximab + FOLFOX FOLFOX 0 FOLFOX cetuximab (n=73) + FOLFOX (n=61) 6 0.8 0.2 FOLFIRI cetuximab (n=176) + FOLFIRI (n=172) 4 OPUS study (KRAS wild-type) 1.0 estimate PFSPFS Response rate (%) 32% risk reduction for progression 0.8 0.0 0 2 4 6 8 10 12 Time (months) 14 16 18 • Selection of oxaliplatin or irinotecan as part of cytotoxic backbone upfront in metastatic disease is based primarily on toxicity profile • Progression-free survival (PFS) and overall survival (OS) in randomized clinical trials using both FOLFOX and FOLFIRI cytotoxic backbones has been improved only in those patients with KRAS wild-type tumors • Anti-EGFR antibody therapy should be given only to patients with KRAS wild-type tumors • Addition of bevacizumab to irinotecan, fluorouracil, and leucovorin (IFL) significantly improved the response rate, overall survival, and progression-free survival Quale combinazione terapeutica? Progression-Free Survival, % IFL + Bevacizumab Increases Progression-Free Survival by 4.4 Months Hazard Ratio = 0.54, P < 0.001 Median PFS: 10.6 vs 6.2 mos PFS at 6 mos: 73% vs 53% PFS at 1 yr: 40% vs 21% 100 80 60 40 Treatment Group 20 IFL + Placebo IFL + Bevacizumab 0 0 10 20 Progression-Free Survival, mos Hurwitz et al. N Engl J Med. 2004; 350:2335. 30 IFL + Bevacizumab Increases Overall Survival by 4.7 Months Hazard Ratio = 0.66, P < 0.001 Median Survival: 20.3 vs 15.6 mos Survival at 1 yr: 78% vs 63% Survival at 2 yrs: 42% vs 29% 100 Survival, % 80 60 40 Treatment Group 20 IFL + Placebo IFL + Bevacizumab 0 0 10 20 Survival, mos 30 40 Hurwitz et al. N Engl J Med. 2004; 350:2335. Bevacizumab (Avastin): efficacia indipendentemente dallo status di KRAS 1.0 1.0 HR=0.69 HR=0.58 (95% CI: 0.37–1.3) 0.8 p=0.25 0.6 0.4 0.2 (95% CI: 0.34–0.99) Proportion surviving Proportion surviving KRAS wild-type (n=152, 67/85) IFL + Avastin IFL + placebo KRAS mutant (n=78, 34/44) 0.8 p=0.04 0.6 0.4 0.2 0 13.6 0 5 10 15 20 Months 19.9 25 Ince et al. JNCI 2005; Roche data on file 17.6 0 0 5 10 15 20 Months >27.7 25 30 Overall Survival for First-line Combination Regimens 5-FU/LV (Saltz) 5-FU/LV (Douillard) 5-FU/LV (de Gramont) IFL (Goldberg) IFL (Saltz) FOLFIRI (Douillard) FOLFOX (de Gramont) FOLFOX (Goldberg) IFL+ Bevacizumab ? FOLFOX/FOLFIRI + MoAbs 0 5 10 15 Median OS (months) 20 25 Carcinoma Colorettale Metastatico Evoluzione della Terapia Medica Mesi 24 >20 Sopravvivenza (OS) 20 20 Sopravvivenza senza progressione (PFS) 16 8 4 12,1 11,5 12 14,5 9,5 8,7 6 5 2,5 6,2 6 3,4 0 Solo supporto FU bolus FU-FA bolus FU-FA ic FU-FA bolus FU-FA con & ic Irinotecan o Oxaliplatin dal 1993 al 2008 (~15 anni) CT e un anticorpo VOLUME 25 ! NUMBER 13 ! MAY 1 2007 JOURNAL OF CLINICAL ONCOLOGY -O R I G I N A L R E P O R T Phase III Trial of Infusional Fluorouracil, Leucovorin, Oxaliplatin, and Irinotecan (FOLFOXIRI) Compared With Infusional Fluorouracil, Leucovorin, and Irinotecan (FOLFIRI) As First-Line Treatment for Metastatic Colorectal Cancer: The Gruppo Oncologico Nord Ovest Alfredo Falcone, Sergio Ricci, Isa Brunetti, Elisabetta Pfanner, Giacomo Allegrini, Cecilia Barbara, Lucio Crino`, Giovanni Benedetti, Walter Evangelista, Laura Fanchini, Enrico Cortesi, Vincenzo Picone, Stefano Vitello, Silvana Chiara, Cristina Granetto, Gianfranco Porcile, Luisa Fioretto, Cinzia Orlandini, Michele Andreuccetti, and Gianluca Masi 10th World Congress on Gastrointestinal Cancer Barcelona, Spain June 25 – 28, 2008 FIRST-LINE TREATMENT OF METASTATIC COLORECTAL CANCER (MCRC) WITH FOLFOXIRI (IRINOTECAN, OXALIPLATIN AND INFUSIONAL 5FU/LV) IN COMBINATION WITH BEVACIZUMAB (BV): A PHASE II STUDY BY THE G.O.N.O. GROUP. Gianluca Masi 1, Fotios Loupakis 1, Giacomo Giulio Baldi 1, Lorenzo Fornaro 1,Irene Stasi 1, Enrico Vasile 1, Andrea Ciarlo 2, Donata Cavaciocchi 2, Angelo Di Leo 2, Martina Puglisi 3, Marika Ciprotti 3, Domenico Amoroso 4, Elena Fea 5, Samanta Di Donato 6, Alfredo Falcone 1,7 1. 2. 3. 4. 5. 6. 7. Azienda USL-6, Division Of Medical Oncology, Livorno Misericordia e Dolce Hospital, Division Of Medical Oncology, Prato Dipartimento Di Medicina Sperimentale e Patologia, Oncologia Medica, Università La Sapienza, Roma Versilia Hospital, Division Of Medical Oncology, Lido Di Camaiore S. Croce e Carle Hospital, Division Of Medical Oncology, Cuneo S. Chiara Hospital, Division Of Medical Oncology, Pisa Department Of Oncology University Of Pisa Abstract n. 211.00 Quali scelte abbiamo oggi? 1. Doublet chemotherapy (FOLFIRI, FOLFOX) 2. FOLFIRI + bevacizumab 3. FOLFIRI+ cetuximab 4. FOLFOX + bevacizumab 5. FOLFOX + cetuximab 6. Single agent (capecitabine or 5-FU) 7. Triplet chemotherapy (FOLFOXIRI) 8. FOLFOXIRI +bevacizumab 9. FOLFOXIRI + Cetuximab • L’uso della moderna Chemioterapia a due o tre farmaci, si associa ad una significativa risposta del tumore primario e alla riduzione delle sue complicanze (Poultsides 2009). • Possibilità di giungere a una chirurgia resettiva di metastasi epatiche ed i citoruduzione completa. • Valutare i rischi di complicanze da farmaci monoclonali (ipertensione e tromboembolismo o perforazione da antiangiogenetici, diarrea e dermatite da anti-EGFR, ecc) • Durata prevista della terapia (induzione pre-operatoria? Terapia con intento palliativo?) • Costi dei farmaci e beneficio ottenibile. Quali criteri per la scelta di una chemioterapia sistemica? • Una terapia antiblastica con scopo citoriduttivo iniziale, può migliorare lo stato generale del paziente. • Per la nostra limitata esperienza, preferiamo lo schema a maggior vantaggio in termini di rapida risposta, con tre farmaci (FOLFOXIRI o XELOXIRI) schema Falconi anche modificato adattando il dosaggio inziale alla situazione clinica del paziente, per ridurre effetti collaterali maggiori (diarrea e disidratazione), con progressivo incremento della dose. • Evitiamo Bevacizumab per il maggior rischio di complicanza e le difficoltà per eventuale chirurgia d’urgenza. • Potremmo introdurre l’anti-EGFR se documentato Kras e BRAF Wild tipe, informando il paziente dei possibili effetti collaterali. Conclusioni personali: • . Tramonto padano Tramonto padano Grazie per l’attenzione
Scarica