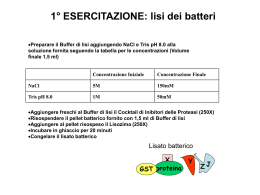
CHIM/08 - METODOLOGIE ANALITICHE NELLO STUDIO DELL’INTERAZIONE FARMACO- PROTEINA BERSAGLIO 16 ore di lezioni e 12 ore di esercitazioni al 1° ciclo, 3CFU Docente: Carlo Bertucci Obiettivo: Il corso è centrato sul ruolo dell’analisi farmaceutica moderna nella progettazione e sviluppo di nuovi farmaci. In particolare il corso prevede di fornire agli studenti informazioni sull’uso di metodologie analitiche utili nello studio di fenomeni di riconoscimento molecolare. Programma Fenomeni di riconoscimento molecolare: cromatografia di affinità. Immobilizzazione della proteina o recettore: caratterizzazione di nuovi composti per il legame alla proteina bersaglio e determinazione dei parametri di distribuzione. Fenomeni di riconoscimento molecolare: spettroscopia in luce polarizzata (ECD). Studio del legame farmaco proteina e dell’interazione proteina/proteina. Determinazione della struttura secondaria della proteina e della conformazione del farmaco legato. Fenomeni di riconoscimento molecolare: biosensori ottici. Screening di nuovi composti per la loro attività e determinazione dei parametri ADME. Studio della cinetica del processo di riconoscimento molecolare: interazioni farmaco/proteina bersaglio e proteina/proteina. Very little happens in any biological systems unless two or more molecules come together to form a stable complex W.David Wilson, Science 2002, 295:2103 BIORECOGNITION PROCESS BIOCHEMICAL MECHANISM ELUCIDATION NEW POTENTIAL TARGETS LEAD IDENTIFICATION DRUG DEVELOPMENT STRATEGIES ADME(T) STUDIES Key activities in modern drug discovery • Identification of small molecule modulators of protein function • Early determination of ADMET parameters BIORECOGNITION PROCESS IN NEW DRUG DISCOVERY AND DEVELOPMENT determination of ligand affinity at target proteins (receptors, transport proteins) activity vs mechanism of action (KD, ka, kd, selectivity) ADME parameters (absorption, distribution, metabolism, excretion) Flow through systems Methodologies Immobilised target protein HPALC Drug affinity RU Abs (uAU) drug/protein binding, binding parameters, sites, enantioselectivity Organic molecule Drug time (min) k = (K A1 n1 + · · · K An nn)mL/VM k = (tR-t0)/t0 Optical Biosensor drug bound fraction binding parameters kinetics of ligand binding 70 Drug binding kinetics 60 50 ka2= 33.1 M-1s-1 150.0 mM 40 kd1= 1.875 s-1 30 75.0 mM 20 3 -1 -1 37.5 mM kd2= 45.3x10-3 s-1 10 ka1= 5.9x10 M s 18.7 mM 0 9.4 mM -10 -20 -20 0 20 40 60 80 time (sec) Static systems Methodologies Circular dichroism: enantioselectivity phenomena; sterochemistry of bound drugs; secondary structure of peptides and proteins; peptide and protein conformational transitions; modulation of protein conformation. CD (mdeg) 50 40 30 20 10 0 -10 -20 -30 -40 350 400 450 wavelength (nm) 500 Organic molecule Drug CHIM/08 - METODOLOGIE ANALITICHE NELLO STUDIO DELL’INTERAZIONE FARMACO- PROTEINA BERSAGLIO 16 ore di lezioni e 12 ore di esercitazioni al 1° ciclo, 3CFU Docente: Carlo Bertucci Obiettivo: Il corso è centrato sul ruolo dell’analisi farmaceutica moderna nella progettazione e sviluppo di nuovi farmaci. In particolare il corso prevede di fornire agli studenti informazioni sull’uso di metodologie analitiche utili nello studio di fenomeni di riconoscimento molecolare. Programma Fenomeni di riconoscimento molecolare: cromatografia di affinità. Immobilizzazione della proteina o recettore: caratterizzazione di nuovi composti per il legame alla proteina bersaglio e determinazione dei parametri di distribuzione. Fenomeni di riconoscimento molecolare: spettroscopia in luce polarizzata (ECD). Studio del legame farmaco proteina e dell’interazione proteina/proteina. Determinazione della struttura secondaria della proteina e della conformazione del farmaco legato. Fenomeni di riconoscimento molecolare: biosensori ottici. Screening di nuovi composti per la loro attività e determinazione dei parametri ADME. Studio della cinetica del processo di riconoscimento molecolare: interazioni farmaco/proteina bersaglio e proteina/proteina.
Scaricare