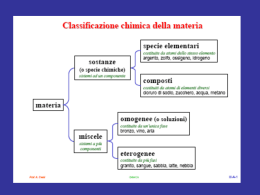
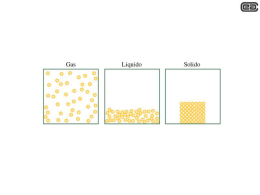
Proprietà della materia • Stato gassoso: Volume e forma in funzione del recipiente. Forze di interazione tra molecole deboli • Stato liquido: Volume proprio e forma in funzione del recipiente. Forze di interazione tra molecole medie. • Stato solido: Volume e forma propri. Forze di interazione tra molecole forti Proprietà dei gas • I gas sono miscibili tra loro in tutte le proporzioni. • Galileo dimostrò che i gas hanno una massa. • Legge generale dei gas: PV = nRT. • Teoria cinetica dei gas. Pressione • Forza che agisce sulla unità di superficie. Es. libro di 2 Kg di dimensioni 20 cm x 25 cm x 5cm a) lato 20 cm x 25 cm : P = 2000 g / 500 cm2 = 4 g/cm2 b) lato 20 cm x 5 cm : P = 2000 g / 100 cm2 = 20 g/cm2 c) lato 25 cm x 5 cm : P = 2000 g / 125 cm2 = 16 g/cm2 Alcune unità di misura: Kg/cm2, Atmosfera, mm Hg, mm H2O, Pascal, PSI, ... Vuoto barometrico Pressione Pressione atmosferica h = altezza della colonna di mercurio 760 mm Hg (1,033 kg/cm2 ) 32 Altitudine (Km) 28 24 stratosfera 20 16 12 troposfera 8 4 100 200 300 400 500 Pressione (mm Hg) 600 700 800 Diverse metodologie di misura della pressione Pressione atmosferica Vuoto h = 250 mm Hg GAS GAS h = 150 mm Hg P = 250 mm Hg Pgas + PHg = Patm Pgas = Patm - PHg Pgas = 760 mmHg - 150 mm Hg = 610 mm Hg Diverse unità di misura della pressione Unità di misura ufficiale MPa (megaPascal, 106 x Pascal, 106 x N/m2 ) Alcune unità di misura alternative in uso: Bar = 0,1 MPa Atm (Atmosfere ) = 0,101325 MPa . mm Hg = 0,00013332 MPa kg/cm2 = 0,0980663 MPa . PSI (libre/pollice2) = 0,0068947 MPa . Legge di Boyle P = 760 mm Hg P = 760 mm Hg P = 760 mm Hg h = 3 x 760 mm h = 760 mm Pa = Patm Va Pb = 2 Pa Pc = 4 Pa Vb = Va /2 Vc = Va /4 Legge di Boyle CO a 100°C 30 Gas ideale a 100°C P · V (l · atm) Il volume di una data quantità di un gas a temperatura costante è inversamente proporzionale alla pressione a cui sottoposto Gas ideale a 0°C 20 CO a 0°C Gas ideale a -150°C 10 CO a -150°C V = k1/P aria 1 atm o PV = k1 aria 1 atm 0 10 aria 1 atm 20 30 P (atm) 40 50 Legge di Boyle Pressione (atm) 12 10 P = 1 atm V=5l P = 2 atm V = 2,5 l P = 3 atm V = 1,66 l 8 T = costante 6 4 2 0 0 5 10 Volume (l) 15 Legge di Charles B T = 0°C V = V1 1.4 1.2 1.0 1.4 1.2 1.0 1.4 1.2 1.0 T = 50°C V = 1.2 V1 T = 100°C V = 1.4 V1 Relazione lineare tra temperatura, misurata in gradi e volume dei gas Volume (l) 24 A 12 -273 -200 0 73 -100 173 0 100 Temperatura °C 200 300 273 373 Temperatura °K 473 573 Temperatura assoluta T (K) = t (°C) + 273,15 V=kT V =k T t (°C) = T (K) - 273,15 Pressione atmosferica Pressione atmosferica GAS 0 °C GAS 273 °C Relazione lineare tra temperatura, misurata in gradi e pressione dei gas P=kT P =k T B 2 Pressione (atm) h = 760 mm Hg Legge di Gay-Lussac A 1 -273 -200 0 73 -100 173 0 100 Temperatura °C 200 300 273 373 Temperatura °K 473 573 Temperatura assoluta T (K) = t (°C) + 273,15 t (°C) = T (K) - 273,15 Legge generale dei gas: legge di Avogadro Combinando gli esperimenti precedenti si ottiene la formula generica: P V = kn T Volumi uguali di gas diversi nelle stesse condizioni di pressione e temperatura contengono un uguale numero di molecole PV= nRT H2 + Cl2 = 2 HCl Volumi uguali di gas diversi nelle stesse condizioni di pressione e temperatura contengono un uguale numero di moli Teoria cinetica dei gas Numero di molecole Moto Browniano T1 La pressione è la conseguenza degli urti delle molecole sulle pareti del recipiente, maggiore è il numero o maggiore è la forza degli urti e maggiore è la pressione T2 Ec = 1 mV2 2 Velocità Ad ogni temperatura l’energia cinetica media delle molecole è la stessa per ogni tipo di gas e per qualsiasi pressione Pressioni parziali e volumi parziali in miscele di gas diversi Pt Pa Pb Pc Pd ...Pn Vt Va Vb Vc Vd ...Vn P a na Xa P t nt Va na Xa Vt n t Xa (frazione molare) P a na RT V P t nt na Pa Pt Pt Xa nt RT V Va na RT P Vt nt na Va Vt Vt Xa nt RT P Liquidi Equilibrio liquido-vapore Tensione di vapore h = 750 mm h = 732 mm h = 659 mm Pvap. = 750-732 = 18 mm Mercurio Acqua Pvap. = 750-659 = 91 mm Tetraclorometano Variazione della tensione di vapore in funzione della temperatura acqua Etere etilico Mercurio 0 33 8 185 2x10-4 20 91 18 442 12x10-4 40 216 55 920 61x10-4 100 1457 760 4865 2729x10-4 Temperature di ebollizione 76.5°C 100°C 34.5°C 356°C Punto di ebollizione : la tensione vapore eguaglia la pressione sovrastante 6000 tetracloro carbonio Tensione di vapore (mm Hg) tetracloro metano °C Liquido 4000 etere etilico 2000 acqua Vapore 0 0 Punto di rugiada: la pressione parziale supera la tensione di vapore es. condensa di umidità 50 100 Temperatura (°C) 150 Grammi per metro cubo di vapore acqueo saturo 50 Sat 45 40 80% 35 30 g/m3 60% 25 20 40% 15 20% 10 5 0 -30 -20 -10 0 10 °C 20 30 40 Solidi .. Strutture cristalline e amorfe .. . .S .. S S .. .. .. .. .. S .. .. S .. Esempi di strutture cristalline comuni Esagonale Cubica Cubica a corpo centrato Grafite Diamante Quarzo (biossido di silicio, SiO2) Na Cloruro di Sodio, NaCl Cl Silicio Ossigeno S S .. .. .. S . . Molecola di zolfo Solidi Equilibrio solido-liquido Pressione (atm) 1 6 solido 4 2 0 -30 vapore -25 -20 -15 -10 Temperatura (°C) -5 solido 0 0 Temperatura (°C) 1,0 liquido 0,2 solido vapore 0,006 Punto triplo 0 liquido 0,006 Diagramma di stato dell’acqua Pressione (atm) Tensione di vapore (mm Hg) Equilibrio solido-vapore 0.01 100 Temperatura (°C) 0,01 Curva di riscaldamento di una mole di acqua da -20°C Riscaldamento del vapore Temperatura (°C) 100 Liquido-vapore 41 kj 80 60 40 20 Solido liquido 6 kj Riscaldamento del liquido 7,5 kj 0 -20 Riscaldamento del solido 10 20 30 Calore (kj) 40 50 60 Calore molare di evaporazione Calore molare di fusione Le Soluzioni Solvente : liquido presente in una soluzione in eccesso rispetto agli altri componenti che vengono da questo disciolti Soluto: sostanza che viene sciolta dal solvente e che costituisce uno dei componenti presenti in minor quantità nella soluzione CONCENTRAZIONE percentuale in peso, % percentuale in volume, %v/v percentuale peso / volume, %w/v molarità, moli/litro, M molalità, moli/kg solvente, m frazione molare, X CONCENTRAZIONE Percentuale in peso, % Percentuale in volume, %v/v es. l’acido cloridrico concentrato es. l’alcol etilico al 95% HCl al 36% la soluzione contiene 950ml di1 la soluzione contiene 36g di HCl alcol per ogni litro di soluzione. per ogni 100g di soluzione. Molarità, M (numero di moli di soluto per litro di soluzione) Molalità, m (numero di moli di soluto per 1000 g di solvente) es. 2 M cloruro di sodio, NaCl 1 mole = 58,5g 2 · 58,5 g =117 g in un volume finale di un litro d’acqua es. 2 m cloruro di sodio, NaCl 1 mole = 58,5g 2 · 58,5 g =117 g da aggiungere a 1000 g d’acqua Solubilità La solubilità di un certo soluto in un certo solvente dipende dalla natura sia del soluto sia del solvente e di solito, ma non sempre, aumenta all'aumentare della temperatura. Solubilità (g soluto/100 g solvente) CaCl2 NaI KNO3 100 90 80 70 60 KCl 50 40 NaCl 30 20 10 Ce2(SO4)3 10 20 30 50 60 40 Temperatura (°C) 70 80 90 100 Solubilità di un gas La solubilità di un gas in un liquido è direttamente proporzionale alla pressione parziale del gas sul liquido ed inversamente proporzionale alla temperatura A 37°C e ad 1 atm 0,012 ml N2 / ml H2O ==> 0.012 x 0,80 = 0,0096 ml N2 /ml H2O 0,024 ml O2 / ml H2O ==> 0,024 x 0,20 = 0,0048 ml O2 / H2O a 40 m di profondità: la solubilità aumenta di 5 volte in quanto la pressione raggiunge le 5 atm (1 dell’aria sovrastante e altre quattro dovute alla colonna d’acqua) Solubilizzazione di un sale H O H H H O H O H H O H Na La solubilità è influenzata dal solvente: Cl Il simile scioglie il suo simile. Sostanze polari solubili in solventi polari Sostanze apolari solubili in solventi apolari Solubilità e polarità Alcol metanolo etanolo 1-propanolo 1-butanolo 1-pentanolo 1-esanolo 1-eptanolo 1-ottanolo formula CH3-OH CH3CH2-OH CH3 CH2CH2-OH CH3 CH2 CH2CH2-OH CH3 CH2 CH2 CH2CH2-OH CH3 CH2 CH2 CH2 CH2CH2-OH CH3 CH2 CH2 CH2 CH2 CH2CH2-OH CH3 CH2 CH2 CH2 CH2 CH2 CH2CH2-OH La solubilità è influenzata dal solvente: Il simile scioglie il suo simile. Sostanze apolari solubili in solventi apolari solubilità g per 100 g di acqua miscibile miscibile miscibile 7,9 2,3 0,6 0,2 0,05 Solubilità e polarità H 1-esanolo O H H O H H O H H O H etanolo H O H H O H Il simile scioglie il suo simile. Proprietà colligative delle soluzioni 1) Tensione di vapore 2) Innalzamento ebullioscopio 3) Abbassamento crioscopico 4) Pressione osmotica Tutte dipendono dal numero di particelle in soluzione,tenendo conto dell’eventuale dissociazione in ioni. Tensione di vapore delle soluzioni Psol = Pa · Xa + Pb · Xb Se il soluto non è volatile P sol =Pa · Xa DP = Pa - Psol DP Xb = ---Pa Abbassamento della tensione di vapore Innalzamento ebullioscopio Abbassamento crioscopico Pressione (atm) Diagramma di stato dell’acqua 1,0 liquido 0,2 solido vapore 0,006 0 0.01 100 Temperatura (°C) Dtf = kf · m Dteb = keb · m Per l’acqua kf = -1,86 Per l’acqua keb = 0,52 Osmosi Pressione Osmotica P P =cRT P V=nRT Soluzione salina fisiologica NaCl 0,15 M P =cRT = 2 · 0,15 · 0.0821 · (273 + 37) = 7,64 H2O Soluzione di saccarosio Membrana semipermeabile La pressione osmotica dipende dal numero di particelle in soluzione quindi bisogna tenere conto della dissociazione dei composti
Scaricare