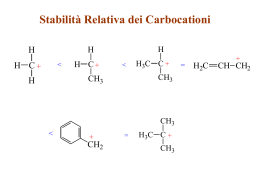
CHIMICA ORGANICA PON C1 di SCIENZE Esperto prof. C. Formica Immagini e testi tratti dai website di: genome.wellcome.ac.uk, dnaftb.org, unipv.it, unimi.it, wikipedia.it, unibs.it, unisi.it, unina.it, uniroma2.it, nih.gov, zanichelli.it, sciencemag.org, ncbi.gov Atomo di carbonio Z=6; configurazione: 1s 2 2s2 2p2 Nuclidi: 12C, 13C, 14C, 15C, 16C. 12C è il più abbondante 14C è il più “famoso”: si usa per la radiodatazione fossili di migliaia di anni (t1/2 = 5730 anni) 2 Legame sigma 3 IBRIDAZIONE ORBITALI Configurazione del carbonio 2s2 2p2 Stato fondamentale 1s2 2s22p2 di questi solo 2s22s2 , cioè i 4 elettroni di valenza, sono indispensabili per comprendere i legami del C 2s2 2p2 Stato eccitato Dallo stato fondamentale (a sinistra), per eccitazione energetica (promozione) , uno degli elettroni 2s trasloca verso uno degli orbitali 2p . In questo modo si passa allo stato eccitato (destra), con i 4 elettroni distribuiti uno per ogni orbitale 2s, 2px, 2py, 2pz. Il risultato è la formazione di orbitali IBRIDI, (funzioni algebriche degli orbitali di partenza 2s e 2p che hanno energie abbastanza simili) con disposizione spaziale differente dagli orbitali iniziali. 4 Orbitali ibridi Le ibridazioni possibili tra s e p sono 3: sp3: 3 orbitali 2p + 1 orbitale 2s (somma esponenti 1+3= 4). Questa ibridazione produce la formazione di 4 legami σ , es. negli ALCANI sp2: 2 orbitali 2p + 1 orb. 2s (2+1=3) mentre il 4° orb. 2p non è ibridato. Questa ibridazione produce la formazione di 3 legami σ e 1 π, quindi si forma 1 doppio legame, come negli ALCHENI e nell’O2 sp: 1 orbitale 2p + un 2s (1+1=2). Non ibridati 2 orbitali 2p. Questa ibridazione produce la formazione di 2 legami σ e 2π, con formazione di un TRIPLO legame, come negli ALCHINI e nell’N2 5 nuovi legami derivanti dall’ibridazione: σ: elettroni distribuiti simmetricamente lungo l’asse di legame π: elettroni distribuiti da parti opposte rispetto all’asse di legame, perpendicolare al piano dell’asse σ - 1/4 caratteri del 2s, ¾ del 2p a)CH4, CH3-CH3 ecc. i 4 sp3 del C si combinano con 1s dell’H b)CH2 = CH2 : 2 sp2 del C con 1s di H, 1 sp2 di C-C (+ 1 legame π) c) CH ≡CH: 1 sp di C con 1s di H, 1 sp di C con sp dell’altro C (+ 2 legami π ) CO2 : sp di C con 2p di O (+ 2 legami π) 6 IBRIDAZIONE ORBITALI - schema riassuntivo Legami 4σ s p3 l’orbitale s si ibrida con tutti i 3 orbitali p s p2 l’orbitale s si 3σ + 1π ibrida con 2 orbitali p s p l’orbitale s si 2σ + 2π ibrida con 1 solo orbitale p Geometria Angoli di dei legami legame* Esempi Tetraedrica 109,5° CH4 CH3-CH3 Triangolare 120° planare CH2=CH2 Lineare CH≡CH 180° *Per confronto si rammentano gli altri angoli di legame: H2O=104° NH3 = 107,3° 7 IBRIDAZIONE ORBITALI – altri esempi ibridazione s p3 s p2 sp molecola Nome IUPAC (nome tradizionale) NH3 NH4+ H2O BF3 BH3 SO3 Triidruro di azoto (ammoniaca) Catione ammonio Acqua Trifluoruro di boro Triidruro di boro Triossido di zolfo (anidride solforica) CO2 BeF2 Diossido di carbonio (anidride carbonica) Difluoruro di berillio 8 Modelli molecolari di H2O e CH4 Tratto da: Darnell 12/21/2015 9 Il tetraedro del metano - CH4 Tratto da: Darnell 12/21/2015 10 Carbonio asimmetrico CH3 H C2H5 d Cl c C a b L’atomo di Carbonio (stereocentro) è ibridato sp3 ed è legato a quattro sostituenti diversi ISOMERI Atomi di C e H legati in modo diverso ISOMERI DI STRUTTURA o di CATENA Sono presenti altri atomi, oltre a C e H ISOMERI DI POSIZIONE legami simili Esempi 2-metil propano e N-butano; N-pentano, 2-dimetilpropano, 2-metilbutano Propanolo e isopropanolo; ISOMERI GEOMETRICI Sono presenti doppi legami STEREOISOMERI diversa orientazione spaziale degli atomi CONVERTIBILI per rotazione intorno a un legame: ROTAMERI (NON CONVERTIBILI per rotazione: doppi legami nella molecola. CONFIGURAZIONALI Es. isomeri CIS e TRANS (es.dicloruro di etilene) 12 Enantiomeri o antipodi ottici: due molecole l’una l’immagine speculare dell’altra. Gli stessi atomi sono legati all’atomo centrale in maniera speculare d d C C c a b c a b L’atomo di C può essere: Primario CH3 –CH3 Secondario CH3-CH2–CH2-CH3 Terziario CH2-CH -(CH3)CH2-CH3 Quaternario (CH3)3–C-CH2CH3 legato a un solo carbonio legato a 2 carboni legato a 3 carboni legato a 4 carboni In parentesi i carboni delle catene laterali Proprietà fisiche e geometriche degli idrocarburi SATURI: ALCANI INSATURI: ALCHENI, DIENI, ALCHINI Meno idrogeno contengono, più sono insaturi Il punto di ebollizione aumenta all’aumentare della massa molecolare. Le catene lineari hanno punti di ebollizione superiori a quelli delle catene ramificate (le forze di London sono più deboli), ma hanno punti di fusione inferiori alle ramificate. Alcani CnH2n+2 e cicloalcani CnH2n sono apolari e fungono da solventi per le sostanze apolari, come per esempio i grassi e sono insolubili in acqua, non formando legami a idrogeno. Gli alcheni CnH2n sono idrocarburi che presentano almeno un doppio legame nella molecola, ibridazione sp2, geometria planare e angoli di legame di 120°. Gli alchini CnH2n-2 sono idrocarburi con almeno un triplo legame nella molecola, ibridazione sp, geometria lineare e angoli di legame di 180°. Alcheni e alchini danno reazioni di addizione elettrofila al doppio e triplo legame, poiché accettano doppietti elettronici. Le reazioni in cui c’è un donatore di doppietti sono dette nucleofile. Punto di ebollizione idrocarburi Cicloalcano Radicali alchilici degli idrocarburi Si formano quando l’idrocarburo cede un idrogeno per sostituirlo con: -OH, -Cl, .F, COOH ecc. Radicali degli alcani: Metano CH4 metile -CH3 Etano CH3 CH3 etile –CH2-CH3 Propano CH3 CH2 CH3 Butano CH3 (CH2)2 CH3 propile –CH2-CH2 -CH3 butile –CH2 (CH2)2 CH3 Radicali degli alcheni: Dall’etene CH2=CH2 vinile CH2=CH- Dal propene CH2=CH-CH3 allile CH2=CH-CH2- Scheletro carbonioso CnH2n+2 Butano angolo di legame 109,5° Le moioecole possono assumere varie conformazioni inrorno al legame sigma ciclopropano ciclobutano CnH2n sono apolari e fungono da solventi per le sostanze apolari, come per esempio i grassi e sono insolubili in acqua, non formando legami a idrogeno. Gli alcheni CnH2n sono idrocarburi che presentano almeno un doppio legame nella molecola, ibridazione sp2, geometria planare e angoli di legame di 120°. Gli alchini CnH2n-2 sono idrocarburi con almeno un triplo legame nella molecola, ibridazione sp, geometria lineare e angoli di legame di 180°. . Dieni: ibridazione sp del carbonio Idrocarburi insaturi con 2 doppi legami. Il primo termine di questa serie è l'1,3-butadiene CH2=CH- CH=CH2 ed è il diene più importante (è usato per fabbricare la gomma sintetica). Il carbonio centrale ha un’ibridazione sp 12/21/2015 21 Composti aromatici risonanza del benzene C6H6 Il fenomeno dello spostamento dei doppi legami si chiama DELOCALIZZAZIONE. Il risultato finale viene rappresentato con un cerchio al centro. A causa della delocalizzazione degli elettroni del benzene, una nuvola elettronica si estende sopra e sotto il piano degli atomi di carbonio 12/21/2015 22 Benzene: strutture di Kekulè 12/21/2015 23 Composti aromatici OH Il benzene può avere dei gruppi sostituenti laterali . FENOLI: OH ACIDI: COOH AMMINE: NH2 ALOGENURI: Cl, F, Br, I NH2 FENILAMMINA (Anilina) mostra proprietà debolmente basiche . FENOLO mostra proprietà debolmente acide Cl COOH ACIDO BENZOICO BENZOCLORURO : si ottiene mediante ALCHILAZIONE (reazione di sostituzione) 12/21/2015 24 La nomenclatura degli idrocarburi alifatici C3 desinenza formula bruta o molecolare propano -ano C3H8 CH3-CH=CH2 propene .ene C3H6 CH3-C≡CH propino .ino C3H4 ciclopropano .ano C3H6 Classe di composti Formula di struttura ALCANI CH3-CH2-CH3 ALCHENI ALCHINI CICLOALCANI formula ciclica CH2-CH2-CH2 nome IUPAC ∆ C3: composti organici con 3 atomi di carbonio prof. Ciro Formica 25 La nomenclatura degli idrocarburi C6 Classe di composti Formula di struttura nome IUPAC desinenza formula bruta o molecolare ALCANI CH3-(CH2)4- CH3 esano -ano C6H14 ALCHENI CH3-CH=CH-CH2-CH2-CH3 esene -ene C6H12 ALCHINI CH3-C≡C-CH2-CH2-CH3 esino -ino C6H10 CH2-CH2-CH2-CH2-CH2-CH2 cicloesano -ano C6H12 benzene -ene C6H6 CICLOALCANI Formula ciclica IDROCARBURI CH=CH-CH=CH-CH=CH AROMATICI C6: composti organici con 6 atomi di carbonio prof. Ciro Formica 26 La nomenclatura dei composti organici C3 dotati di gruppi funzionali Classe di composti formula (esempio composti a 3 atomi di carbonio) nome IUPAC nome tradizionale gruppo funzionale desinenza formula bruta (molecolare ALCOLI CH3-CH2-CH2-OH propanolo alcol propilico -OH ossidrile -olo C3H8O ACIDI CARBOSSILI CI CH3-CH2-COOH acido propanoico acido propionico -COOH carbossile .oico C3H6O2 ALDEIDI CH3-CH2-CHO propanale aldeide propionica -CHO carbonile .ale C3H6O CHETONI CH3-CO-CH3 propanone dimetilcheto ne (acetone) -COcarbonile .one C3H6O AMMINE CH3-CH2-CH2-NH2 propanammina Amminopro pano/propila mmina -NH2 amminico -ammina C3H9N prof. Ciro Formica 27 COMPOSTI DOTATI DI GRUPPI FUNZIONALI ALCOLI ACIDI ORGANICI AMMINE ALIFATICHE ALDEIDI Gruppo Formula e funzionale nomenclatura -OH CH3CH2OH -COOH CH37COOH -NH2 CH3-NH2 -CHO CH3CHO CHETONI -C=O CH3-CO-CH3 ESTERI -COO- CH3-COO-CH3 AMMIDI ETERI -CO- NH2 CH3-CO-NH3 -O- CH3-O-CH3 Nome IUPAC e tradizionale Etanolo (alcol etilico) Ac. Etanoico (ac. acetico) Metal-ammina Formula generale Propr. chimiche R-OH neutro R-COOH Acido debole R-NH2 Base debole Etanale (acetaldeide) Propanone (acetone) Etanoato di etile Etammide (acetammide) dimetiletere R-CHO - R-C=O - R-COO-R - R-CO-NH3 - R-O-R’ Gli alcoli possono essere: - primari, secondari e terziari a seconda del carbonio cui è legato l’OH -monovalenti, bivalenti e trivalenti se posseggono rispettivamente 1, 2 o 3 OH Le ammine possono essere: primarie, secondarie e terziarie a seconda del carbonio cui è legato l’OH 28 Proprietà fisiche dei composti dotati di gruppi funzionali A parità di massa molecolare, gli alcoli e i fenoli hanno punti di ebollizione più alti rispetto agli idrocarburi e agli eteri. La solubilità degli alcoli decresce all’aumentare del numero di atomi di carbonio perché: -prevale il carattere idrofobico della catena rispetto al carattere idrofilo dell’ossidrile, Si formano legami a idrogeno che rendono abbastanza solubili metanolo, etanolo e propanolo in acqua Le ammine primarie e secondarie formano legami a idrogeno intermolecolari, pertanto i loro punti di ebollizione sono più alti di quelli degli alcani a uguale massa molecolare. I punti di ebollizione delle aldeidi e dei chetoni sono più alti di quelli degli idrocarburi a uguale massa molecolare, ma minori a quelli degli alcoli corrispondenti. Proprietà chimiche dei composti dotati di gruppi funzionali Gli alcoli : -sono acidi molto deboli -si disidratano in presenza di acidi molto forti -danno reazioni con rottura del legame C—O, -danno reazioni di ossidazione: •alcoli primari: si ossidano ad aldeidi e poi ad acidi carbossilici •secondari: si ossidano a chetoni I fenoli sono circa un milione di volte di più acidi degli alcoli Le ammine sono basi deboli ACIDI ORGANICI (CARBOSSILICI) HCOOH CH3COOH ACIDI ORGANICI 1 carbossile COOH CH3CH2COOH Esempi ACIDO METANOICO (formico) AC. ETANOICO (acetico) AC. PROPANOICO (propionico) ecc. metil propano ACIDO OSSALICO COOH-COOH AC. MALICO 2 o più carbossili COOH COOH –CH-OH-CH2COOH COOH -CH3CH-COOH-COOH AC. CITRICO(ciclo di Krebs) ecc. 31 ac. formico ac. acetico ac. benzoico Gli acidi carbossilici sono polari, liberano H+ e hanno punti di ebollizione elevati Scala del pH 12/21/2015 33 Reazioni tipiche degli acidi carbossilici Esempi Base forte Acido+ Acido alifatico+ alcol Acido aromatico + alcol ammin Acido + a CH3-COO-Na Sale CH3-COOH + NaOH Estere alifatico CH3-COOH + CH3CH2-OH CH3-COO-CH2CH3 Estere aromatico C6H5-COOH + CH3CH2-OH C6H5-COO-CH2CH3 CH3-CO-NH2 + CH3OH Ammide CH3-COOH + CH3NH2 Prodotto finale Acetato di sodio Acetato di etile Benzoato di etile etanammide Viene eliminata una molecola d’acqua H2O come nelle condensazioni 34 Gli acidi grassi L’acido palmitico (sinistra) è un acido grasso saturo, l’acido oleico è insatuto e il doppio legame creala conformazione ripiegata Tratto da: After L. Stryer, 1994, Biochemistry, 4th ed., W. H. Freeman and Company, p. 265 12/21/2015 35 ACIDI GRASSI SATURI Formula e nomenclatura CH3(CH2)10COOH Laurico CH3(CH2)12COOH Miristico CH3(CH2)14COOH Palmitico CH3(CH2)16COOH Stearico CH3(CH2)18COOH Arachidico CH3(CH2)22COOH Lignocerico Atomi C n-Dodecanoico 12 n-Tetradecanoico 14 n-Esadecanoico 16 n-Ottadecanoico 18 n-Eicosanoico 20 n-Tetracosanoico 24 ACIDI GRASSI INSATURI Formula e nomenclatura Atomi C CH3(CH2)5CH=CH(CH2)7COOH Palmitoleico 16 CH3(CH2)7CH=CH(CH2)7COOH Oleico 18 CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH Linoleico 18 CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH Linolenico 18 CH3(CH2)4(CH=CHCH2)3CH=CH(CH2)3COOH 20 12/21/2015 Arachidonico 36 I grassi (solidi e saturi) e gli oli (liquidi e insaturi) sono esteri del glicerolo (trigliceridi) con acidi carbossilici a lunga catena sia saturi sia insaturi. 12/21/2015 37
Scarica