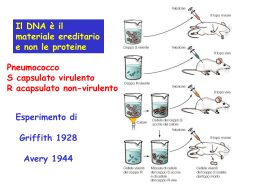
Il progetto genoma umano e gli altri progetti genoma: importanza degli organismi-modello Perché sequenziare il genoma umano? • La disponibilità della sequenza rende più semplice l’identificazione dei geni responsabili delle malattie mendeliane • Sequenza completa di tutti i geni • Possibilità di determinare la struttura esoni-introni • Mappare i geni e le altre sequenze • Rivelare le regioni di controllo non codificanti • Identificare polimorfismi • Scoprire l’inatteso Il progetto originale (1984): fasi 1. Ottenere una mappa genetica a bassa risoluzione (1987, mappa con marcatori RFLP) 2. Ottenere una mappa genetica ad alta risoluzione (1994, mappa con microsatelliti altamente polimorfici, risoluzione 1 cM) Ricadute immediate: marcatori per il positional cloning e per l’investigazione forense. Il progetto originale (1984): fasi 3. Ottenere una mappa fisica a diversi livelli di risoluzione 4. Ottenere una sequenza con 99,99 % di accuratezza DNA Genomico Subclonaggio in vettori YAC, BAC, P1 o PAC e assemblaggio di contigs con minimo di ridondanza Subclonaggio in vettori da sequenziamento Sequenziamento Il progetto originale era fortemente condizionato dalla difficoltà di sequenziare il DNA, e quindi dalla necessità di ridurre al minimo il quantitativo di sequenze da effettuare. Lo sviluppo di sequenziatori automatici capaci di produrre 400000 basi/giorno ha largamente superato qesto ostacolo. Craig Venter Francis Collins Prima obiezione di Venter: perché sequenziare tutto subito se la maggior parte di ciò che interessa sono le sequenze codificanti? Sequenziamento delle sole regioni esoniche (Expressed Sequence Tags) Picking singoli cloni 5’ Primer Preparazione DNA 3’ Sequenziamento automatico Deposito in banca dati (300-700 bp) In questo modo Venter cominciò ad avere in mano un quantitativo di sequenze geniche superiore a chiunque altro prima di lui. Quando tentò di brevettarle, il governo americano decise che non si può brevettare una sequenza, ma solo la conoscenza che si ha su di essa. Differenza tra scoperta e invenzione. Quindi per brevettare un gene è importante conoscerne la funzione o almeno la potenziale rilevanza. Sulla scia di Venter, anche il consorzio pubblico cominciò a produrre valanghe di sequenze EST e ad adottare massicciamente i nuovi sequenziatori automatici. Seconda obiezione di Venter: è possibile una strategia alternativa per ottenere la sequenza completa? Approccio whole genome shotgun DNA Genomico Frammenti casuali lunghi (5-20 kb) e corti (0.4-1.2 kb) derivanti da rottura meccanica del DNA clonati in vettori da sequenziamento Sequenziamento automatico bidirezionale Ricostruzione computerizzata della sequenza genomica Sequenziamento del genoma di Hemophilus Influenzae (1.8 Mb) • 20000 frammenti di 1,6-2 kb • 30000 saggi di sequenziamento • 11,6 Mb di sequenza totale • 30 ore per assemblare la sequenza su un calcolatore con 512 Mb di RAM Inizialmente si stimava che la sequenza sarebbe stata completa nel 2005, poi nel 2003. La combinazione dell’approccio del consorzio pubblico con quello di Venter hanno portato alla pubblicazione di due seqeunze (più o meno indipendenti) nel 2000 Siccome le sequenze finali sono state ottenute sovrapponendo la sequenza di individui diversi, è stato possibile individuare un numero (milioni) molto alto di polimorfismi di singoli nucleotidi (SNPs). ---ATGTTGAAGTTCAAGAATGGTGTGCGGAAC-----ATGTTGAAGTTCAAGTATGGTGTGCGGAAC-----ATGTTGAAGTTCAAGCATGGTGTGCGGAAC-----ATGTTGAAGTTCAAGGATGGTGTGCGGAAC--- Marcatori ad altissima densità (1/1000 basi), che saranno fondamentali per dissezionare i tratti complessi. Non si può capire come è fatto il genoma umano e come funzionano i nostri geni se non li confrontiamo quelli dei principali organismi modello: Gli altri progetti genoma E. Coli S. Cerevisiae Drosophila Melanogaster Caenorhabditis Elgans Fugu Danio Rerio (zebrafish) Mus musculus Rattus Norvegicus Primati non umani I meccanismi che controllano la riparazione del DNA, importantissimi per comprendere la biologia del cancro, sono conservati fino ai batteri. I meccanismi che controllano la duplicazione del DNA e le transizioni che accompagnano il ciclo cellulare sono ben conservati fino ai lieviti. I meccanismi che determinano l’impostazione del piano di sviluppo corporeo sono sorprendentemente simili negli insetti e nei mammiferi. Conservazione evolutiva di intere vie biochimiche EGF EGF-R Grb2 Solo il confronto con gli organismi modello (genomica comparativa) ci permetterà di conoscere cosa ci accomuna alle altre specie e le ragioni delle nostre peculiarità. Hs 1 2 3 4 5 6 7 ATCTACGACTTCCAAGTCATCTGTAGTCCA CTCTGCGACTTCCACGTCATCTGACGTGGA AACTATGAATTCCAAGTCATCTGAAATGCT ATGTACCACTTCCAAGTCATCTGAAGAGCA TTCATCGCCTTCCAAGTCATCTGCAGTACA AGCTAAGACTTCCATGTCATCTGACGTGTA ATATACCAGTTCCAAGTCATCTGAATTGCG ATCCACGGCTTCCAAGTCATCTGAAGCGCA Inoltre i modelli sperimentali geneticamente trattabili sono fondamentali per lo studio della funzione genica in condizioni normali e patologiche Altre ricadute dei progetti genoma: genomica funzionale (analisi del trascrittoma) Altre ricadute dei progetti genoma: La comparazione delle sequenze genomiche dei microorganismi rappresenta uno strumento fondamentale per lo sviluppo razionale di nuovi antibiotici Analisi del proteoma mediante spetrometria di massa
Scaricare