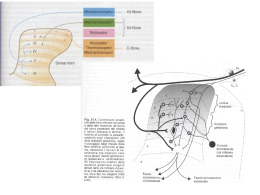
Dolore • L’informazione nocicettiva nasce in periferia in seguito a diversi stimoli ed è convogliata al midollo spinale (corno posteriore) da fibre afferenti amieliniche di tipo C a conduzione lenta (dolore sordo, non localizzato) e da piccole fibre mieliniche (A, tipo delta, dolore acuto). • Le fibre afferenti entrano nel ms attraverso le radici dorsali e terminano nelle corna posteriori (sostanza grigia). • Dal midollo spinale, l’informazione nocicettiva arriva ai centri corticali (talamo) ad opera di neuroni di trasmissione. • Il dolore vero e proprio è la presa di coscienza delle informazioni nocicettive trasmesse dal talamo ed integrate a livello corticale e limbico. Le strutture coinvolte sono la corteccia (anteriore cingolata, somatico-sensoriale, prefrontale), l’ipotalamo, il talamo, la sostanza grigia periacqueduttale, il cervelletto ed i gangli della base. s Eventi che portano alla attivazione e sensibilizzazione dei terminali nocicettivi afferenti • A. Attivazione diretta dovuta ad una pressione intensa e conseguente al danno cellulare. Il danno cellulare induce una riduzione del pH e determina un aumento del K+ nello spazio pericellulare. Aumenta inoltre la sintesi di prostanoidi (prostacicline e prostaglandine, PGs) e bradichinine (BK). Le PGs sensibilizzano le terminazioni dolorose. • B. Attivazione secondaria. Gli impulsi generati nei terminali si propagano non soltanto nel midollo spinale, ma anche con riflessi assonici locali ad altre branche degli stessi terminali, determinando il rilascio di sostanza P (SP). La SP causa vasodilatazione e edema neurogenico. La SP causa anche rilascio di istamina e serotonina rispettivamente da mastociti e piastrine. Anestetici locali • Bloccano o riducono la generazione e la propagazione del potenziale d'azione lungo la membrana eccitabile neuronale. Ciò si ottiene per stabilizzazione del canale del sodio in una conformazione chiusa; il blocco selettivo dei canali del sodio è voltaggio-dipendente ed è tanto più efficace quanto più elevata è la frequenza di stimolazione della fibra nervosa (blocco usodipendente). Struttura del canale del sodio • Come in tutti i canali voltaggio-dipendenti, si può identificare una struttura voltaggiosensibile e una struttura operante la inattivazione del canale Anestetici locali • Il blocco si ottiene sia sulle fibre sensitive che su quelle motorie, ma le fibre amieliniche (sensitive dolorifiche) sono le più sensibili (seguono quelle del freddo, caldo, tattili, pressorie ed infine motorie). Anestetici locali • Il blocco della generazione e della conduzione del potenziale d’azione si ottiene per stabilizzazione del canale del sodio in una conformazione chiusa; il blocco selettivo dei canali del sodio è voltaggio-dipendente ed è tanto più efficace quanto più elevata è la frequenza di stimolazione della fibra nervosa (blocco uso-dipendente). Local anaesthetics reduce firing frequency in small dorsal root ganglia neurones • . (A) Trains of tetrodotoxin (TTX)-resistant action potentials elicited by a 750 ms 400 pA current stimulus are reduced in firing frequency by increasing concentrations of lidocaine. (B) Similar effects as in (A) seen with bupivacaine in another neurone. Extracellular solution in bath containing TTX 200 nM; high KI in pipette; 22–23°C. Scholz, Br J Anaesthesia, 2002, 89, 52-61 Anestetici locali • Esteri: Cocaina, procaina, benzocaina; • Amidici: Lidocaina, bupivacaina Anestetici locali • Gli esteri sono metabolizzati da esterasi plasmatiche (psuedocolinoesterasi), • le amidi a livello epatico. • Il metabolismo (e quindi la scomparsa dell’effetto anestetico) e la tossicità sono influenzate dalla rapidità con la quale l’anestetico raggiunge il circolo sistemico. Anestetici locali • In associazione con -agonisti (adrenalina, fenilefrina) Effetti collaterali: • Centrali: brividi, tremori, fino a convulsioni e spasmi della glottide; • Periferici: (cuore) effetto inotropo negativo, riduzione della velocità di conduzione con blocco atrio-ventricolare; • Periferici: (circolazione) ipotensione e collasso cardiocircolatorio. Controllo della sensibilità dolorosa “Gate control” • Per la complessa rete neuronale esistente nel midollo spinale, la stimolazione ripetuta delle terminazioni dolorifiche “apre” il cancello (autofacilitazione) ed aumenta l’attivazione delle vie ascendenti spinotalamiche. Stimoli sensoriali non nocicettivi e informazioni discendenti “chiudono” il cancello e diminuiscono la sensibilità dolorosa. Controllo inibitorio della sensibilità dolorosa • Midollo spinale (interneuroni inibitori la cui attivazione inibisce la trasmissione dalle fibre afferenti ai neuroni di trasmissione). • Sistema inibitore discendente (meccanismo di feed-back negativo attivato a livello corticale) Vie inibitorie discendenti per il controllo della sensibilità dolorifica • I neuroni della zona periacqueduttale (PAG) ricevono impulsi di controllo dalla corteccia cerebrale, dal talamo e dall’ipotalamo. Dal PAG, alcune terminazioni nervose proiettano nel midollo spinale, nel nucleo del rafe magno (NRF) e nel nucleo reticolare magnocellulare (NRMC). Da qui, vie discendenti di controllo entrano nel midollo spinale (sostanza gelatinosa) e modulano l’attività dei neuroni nocicettivi, inibenboli. Farmaci per la terapia del dolore Analgesici Non Oppioidi • Farmaci Antinfiammatori Non Steroidei Analgesici Oppioidi • Agonisti forti (morfina, meperidina, metadone, fentanil e derivati) • Agonisti deboli (codeina, destropropossifene, tramadolo) • Agonisti / antagonisti (buprenorfina) • Agonisti parziali (pentazocina) Farmaci Adiuvanti • Antidepressivi triciclici • Antiepilettici • Farmaci serotoninergici (SSRI, trazodone) • Farmaci noradrenergici (clonidina, terazosina) • Miorilassanti • Corticosteroidi • Anestetici locali • Altri (capsaicina, somatostatina) • Ansiolitici Analgesici periferici antiinfiammatori • Antiinfiammatori non steroidei (FANS), compreso il paracetamolo che non ha effetto come antinfiammatorio, ma esercita una azione antidolorifica centrale. Analgesici “centrali” oppioidi • Antidolorifici potenti, i farmaci del malato di cancro, ma anche farmaci da usare in una serie di situazioni non così drammatiche e finali come il dolore del malato terminale Uso dei farmaci analgesici (WHO “ladder”) Libertà dal dolore Oppioidi forti +/- Non oppioidi +/- Adiuvanti Dolore persistente o aumentato Oppioidi deboli +/- Non oppioidi +/- Adiuvanti Dolore persistente o aumentato Analgesici non oppioidi +/- Adiuvanti Consumo di morfina per milione di abitanti (1986-91) Zenz et al, 1993 Figura 1 - Consumo dei farmaci oppiacei in Europa (% sul totale spesa farmaceutica) Fonte: Ministero Salute, Repubblica italiana (anni 2000-2002) Tabella IV - I principi attivi maggiormente consumati (DDD/1000 ab die)* • • • • • • • • PRINCIPIO ATTIVO Codeina Diidrocodeina Fentanyl Morfina Metadone Buprenorfina Totale 2000 0,544 0,299 0,017 0,110 0,053 0,028 1,052 2001 0,556 0,259 0,096 0,120 0,057 0,023 1,11 2002 0,586 0,258 0,158 0,111 0,074 0,020 1,206 Fonte: Ministero Salute, Repubblica italiana (anni 2000-2002) http://www.ministerosalute.it/dettaglio/pdHomeArea.jsp?lan g=italiano&id=525&area=medicinali-terapiaDolore Terapia del dolore • L’Italia, secondo recenti analisi sul consumo dei farmaci oppiacei, è risultata un paese che ancora non risponde ai reali bisogni dei pazienti affetti da dolore severo in corso di patologie neoplastiche o degenerative negando loro il giusto sollievo in particolare nella fase terminale. Norme legislative molto restrittive hanno reso difficile in passato l’accesso a tali farmaci ed hanno anche ridotto la possibilità da parte degli operatori sanitari di sviluppare ulteriori conoscenze sulla terapia. Sulla base di queste premesse il Ministero della salute ha recentemente adottato nuove iniziative per promuovere la terapia del dolore e per facilitare la prescrizione e l’impiego dei farmaci analgesici oppiacei, in particolare attraverso le semplificazioni apportate dalla Legge 8 febbraio 2001 n.12 e dal successivo D.M. 4 aprile 2003 . Opioid prescription in Italy: new law, no effect • Sir—It is estimated that millions of patients with cancer worldwide experience moderate to severe cancer pain. Unrelieved cancer pain continues to be a major publichealth concern, despite available treatment. The use of opioids is the cornerstone of cancer-pain management. Misguided national health policies, non-availability of drugs, and inadequate education of physicians and the public are the main barriers to the prescription of opioids. The trend of increasing medical use of opioids to treat pain does not seem to be contributing to increases in the health consequences of opioid analgesic abuse. • Mercadante S., Pain Relief and Palliative Care Unit, La Maddalena Cancer Center, Via S Lorenzo 312, 90146, Palermo, Italy, (Correspondence, The Lancet, 360, 1254-1255 , 2002) Opioid prescription in Italy: new law, no effect • Table 1. Opioid use in mg per person in general population sold before and after change in opioid prescription law Mercadante S., The Lancet, 360, 1254-1255 , 2002 Opioids in Italy: is marketing more powerful than the law? Chinellato et al., The Lancet, 362, 78, 2003 Analgesici oppioidi • Morfina e derivati dell'oppio • Molecole di sintesi morfino-mimetiche: levorfano, pentazocina, buprenorfina • Succedanei della morfina: petidina, metadone Oppio, oppiacei ed oppiodi Leu-encefalina Papaver somniferum Morfina Recettori per gli oppiodi K+ NH2 II G G bg GDP cAMP COOH GTP Adenilato ciclasi Proteina Gi 2+ Ca Effetti degli oppioidi • Siti e meccanismi di azione • Inibizione diretta del sistema nocicettivo ascendente (k, µ) • Attivazione del sistema di controllo del dolore discendente (k, µ) • Inibizione della trasmissione algica a livello talamico (µ) • Inibizione periferica della liberazione di mediatori infiammatori dalle cellule immunitarie (µ) Meccanismo di azione • La morfina mima gli effetti delle endorfine (oppioidi endogeni). L'effetto analgesico si ottiene per modulazione della neurotrasmissione dei messaggi nocicettivi a livello • a) spinale (midollo) per attivazione degli interneuroni inibitori. • b) sopraspinale (bulbo, ponte, mesencefalo) per facilitazione delle vie discendenti inibitorie. • A questi effetti post- (diminuzione del firing neuronale) e pre-sinaptici (per diminuita produzione o liberazione di altri neurotrasmettitori) si aggiungono effetti sulla componente emozionale (sistema limbico) ed il dolore è meno intenso e più sopportabile. Effetti clinici degli oppioidi • Analgesia • Effetto di sollievo sia sul dolore acuto che su quello cronico, con notevole attenuazione o scomparsa completa e sensazione di sollievo psichico. Efficacia minore sul dolore neuropatico. Affinità farmaci per i recettori oppioidi Farmaco m Morfina +++ Metadone +++ Fentanil +++ Sufentanil +++ Meperidina ++ Codeina + Tramadolo +Buprenorfina +++AP Pentazocina - Recettore d + k ++ + + + + + -AP + Oppioidi • La morfina è il punto di riferimento di ogni farmaco analgesico. Possiede tutti gli effetti tipici dei farmaci oppioidi: analgesia, depressione respiratoria, nausea, vomito, modulazione endocrina, antitosse, rallentamento del transito intestinale, effetti sul sistema immunitario. La durata di azione della morfina è di circa 4 ore; sono anche disponibili formulazioni a lento rilascio che ne portano la durata di azione a 8 ore. Oppioidi • La codeina, è circa dieci volte meno potente della morfina, ma ne condivide tutti gli effetti. Rispetto alla morfina, la codeina ha il vantaggio di essere bene assorbita per via orale. Oppioidi • Il tramadolo (derivato della codeina) è un debole agonista del recettore oppiaceo µ, ma ha anche la capacità di bloccare la ricaptazione di serotonina e noradrenalina come i classici antidepressivi triciclici. L’effetto analgesico del tramadolo è comparabile a quello della codeina, ma accompagnato da effetti riconducibili a quelli degli antidepressivi triciclici, con il potenziamento delle vie serotoninergica e noradrenergica. Questo particolare meccanismo di azione potrebbe essere alla base di alcune sue caratteristiche, come la minore tendenza alla depressione respiratoria, la stimolazione del sistema immunitario e la scarsa tendenza alla tolleranza. Oppioidi • La buprenorfina ha una potenza analgesica simile a quella della morfina ed è bene assorbita per via orale. Induce fenomeni allucinatori e vomito che impediscono di utilizzare appieno le sue qualità analgesiche. Oppioidi • La meperidina (o petidina) è un oppioide sintetico che non induce la contrazione dello sfintere di Oddi. Oppioidi • Il fentanyl (derivato della meperidina) è un farmaco dotato di una notevole potenza analgesica, ma una breve durata di azione (circa 20 minuti). Può essere usato in formulazioni transdermiche a lento rilascio. • Il remifentanil ha una durata di azione di circa un minuto ed è usato in infusione negli interventi chirurgici. Alla sospensione dell’infusione postoperatorio, non si osserva depressione respiratoria. La rapidità di azione del remifentanil è dovuta al fatto che è metabolizzato dalle esterasi ematiche. Oppioidi • Il metadone ha una durata di azione di 8 ore circa ed ha una ottima biodisponibilità orale. Il metadone è 6/7 volte più potente della morfina. Il metadone si lega alle proteine plasmatiche, e la quota legata alle proteine plasmatiche si comporta come una riserva, una specie di deposito a lento rilascio. Attualmente, il metadone sta trovando un impiego sempre più comune nella terapia del dolore cronico anche a domicilio e nel dolore post-operatorio. Oppioidi • Il destropropossifene è un analgesico molto più debole del metadone, di potenza paragonabile a quella della codeina, caratterizzato però dalla stessa lunga durata di azione del metadone; è generalmente usato in associazione ai FANS. Effetti collaterali degli oppioidi • Miosi (segno prognostico della intossicazione acuta grave da oppioidi); • Nausea, vomito; • Costipazione con aumento del tono muscolare del duodeno, della porzione antrale e dello sfintere pilorico dello sfintere anale; • Spasmo dello sfintere di Oddi (controndicazione nel trattamento dello coliche biliari); • Iperglicemia con un abbassamento del metabolismo basale per riduzione della temperatura corporea; • Vasodilatazione periferica per liberazione diretta di istamina, diminuzione del precarico, effetto inotropo e cronotropo negativo; • Depressione respiratoria per inibizione diretta dei centri respiratori bulboponti e depressione dei chemiorecettori; La morte per sovradosaggio è dovuta all’effetto inibitorio sui centro respiratorio e quindi alla depressione respiratoria!!! Tolleranza e farmacodipendenza da oppioidi • Per tolleranza si intende una diminuzione degli effetti farmacologici (analgesia, effetto euforizzante, ma anche effetti collaterali, in particolare depressione respiratoria). La tolleranza è crociata (cioè è estesa a tutti i farmaci analgesici-narcotici di tipo oppiaceo) e si ottiene dopo due-tre settimane alle normali dosi terapeutiche (per la morfina HCl o H2SO4 10-20 mg i.m.) • Il meccanismo non è metabolico (diminuito assorbimento, aumentata degradazione o eliminazione del farmaco) ma si ipotizza dovuta a up-regolazione di sistemi di trasduzione intracellulari (cAMP) che antagonizzano gli effetti della attivazione dei recettori oppioidi. • Per dipendenza (fisica) si intende lo stato di ipereccitabilità che si sviluppa nelle cellule del snc in conseguenza della somministrazione di una sostanza. La dipendenza psichica è invece quello stato di ansia o depressione che nel paziente si ha all'idea di "interrompere" l'uso di una sostanza. • Nel caso della morfina e degli altri analgesici-narcotici la dipendenza è fisica oltre che psichica e l'interruzione del farmaco provoca una vera e propria crisi di astinenza, spiegabile con le modificazione tipiche della tolleranza. Cannabinoidi • Analoghi della anandamide • Derivati cannabinioidi inducono nell’uomo sensazione di benessere, aumento dell’appetito, bradicardia, vasodilatazione, bronco-dilatazione e controlla la nausea indotta dai chemioterapici antineoplastici. • Utilizzati nelle sindromi spastiche e nella sclerosi multipla. • Gli antagonisti inducono iperalgesia e la presenza dei recettori nei tessuti tende a dimostrare che gli endocannabinoidi potrebbero contribuire al controllo della sensibilità dolorosa. Cannabis e cannabinoidi Anandamide Cannabis sativa D9-THC Recettori per i cannabinoidi K+ NH2 II G G bg GDP cAMP COOH GTP Adenilato ciclasi Proteina Gi + Na Effetti antidolorifici dei cannabinoidi Effetto antinocicettivo centrale. Innalzamento della soglia dolorifica sia a livello centrale (potenziamento del GABA e inibizione del glutammato) che a livello spinale (promuovono il rilascio di oppiodi nel sistema discendente di controllo del dolore). Efficaci sul dolore neuropatico. Effetto antinocicettivo periferico di tipo antinfiammatorio, mediato dall'inibizione del rilascio di sostanze algogene proinfiammatorie da parte delle cellule del sistema immunitario. Antidepressivi triciclici Inducono una modulazione del dolore probabilmente perché interferiscono con la ricaptazione di serotonina e di noradrenalina, due sistemi trasmettitoriali importante per la modulazione inibitoria del dolore. Antidepressivi triciclici • Gli antidepressivi triciclici sono usati nel dolore di origine neuropatica. Possono anche essere utilizzati per potenziare l’effetto analgesico della morfina, ma questo impiego va attentamente valutato alla luce dei loro effetti collaterali che vengono ad aggiungersi a quelli dell’oppiaceo. Potranno ad esempio essere associati quando nel dolore da cancro si riconosca una componente neuropatica per compressione o lesione di tessuto nervoso. Anticonvulsivanti • Diversi anticonvulsivanti sono attivi nella modulazione del dolore. La carbamazepina è attiva nel dolore neuropatico e soprattutto nel dolore trigeminale. Bloccanti degli Amminoacidi eccitatori • Ketamina: Questo farmaco, utilizzato soprattutto in anestesia, è tuttavia noto per i suoi effetti disforici che ne limitano l’impiego a casi molto particolari ed in ambito specialistico ha anche effetti antinocicettivi. WHO • If pain occurs, there should be prompt oral administration of drugs in the following order: nonopioids (aspirin and paracetamol); then, as necessary, mild opioids (codeine); then strong opioids such as morphine, until the patient is free of pain. To calm fears and anxiety, additional drugs – “adjuvants” – should be used. To maintain freedom from pain, drugs should be given “by the clock”, that is every 3-6 hours, rather than “on demand”. This three-step approach of administering the right drug in the right dose at the right time is inexpensive and 80-90% effective. Surgical intervention on appropriate nerves may provide further pain relief if drugs are not wholly effective. (Last update: May 3, 2002)
Scaricare