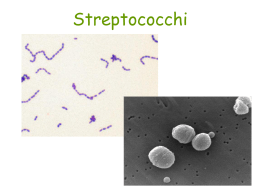
LE INFEZIONE RESPIRATORIE Ospedale Ca’Foncello – Treviso Unità Operativa Complessa di Pneumologia A cura di : Dott. Giorgio Santelli Dott. Giuseppe Zanardi G. Santelli 1 PRINCIPALI LOCALIZZAZIONI DELLE INFEZIONI RESPIRATORIE Seno frontale Seno mascellare Sinusite Faringite Polmonite Bronchite 2 G. Santelli INFEZIONI RESPIRATORIE TRATTATE 1.Riniti 2.Sinusiti 3.Faringiti 4.Bronchiti 5.Polmoniti 3 G. Santelli EPIDEMIOLOGIA DELLE MALATTIE RESPIRATORIE 4 5 6 Leading Causes of Death COPD 1990 2020 Ischemic heart disease Cerebrovascular disease 1 2 1 2 COPD 6 3 Lower respiratory infection Lung cancer Road traffic accidents Tuberculosis Stomach cancer 3 10 9 7 14 4 5 6 7 8 WHO Global Burden of Disease study G. Santelli 7 AUMENTO, CON L’ETA’, DELL’INCIDENZA DELLE INFEZIONI DEL TRATTO RESPIRATORIO INFERIORE CONTRATTE IN COMUNITA’ Età (anni) 16–19 20–29 30–39 40–49 50–59 60–69 70–79 0 20 40 60 80 100 120 140 Casi per 1000 soggetti/anno Mac Farlane et al. Lancet 1993; 341:511–14. 8 G. Santelli INFEZIONI DELLE VIE RESPIRATORIE: UNA DELLE PRINCIPALI CAUSE DI MORTALITA’ Dati relativi alle morti per infezioni delle vie respiratorie verificatesi, nel 1990, nei Paesi più avanzati. Età (anni) 0–4 5–14 15–29 30–44 45–59 60–69 70+ 0 50 100 150 200 250 300 Stime (x 103) Murray & Lopez. Bull World Health Organ 1994; 72:447–80. 9 G. Santelli BETTERIOLOGIA DELLE INFEZIONI RESPIRATORIE Gli agenti più comunemente in causa sono: - Streptococcus pneumoniae - Haemophilus influenzae - Moraxella catarrhalis - Streptococcus pyogenes - Staphylococcus aureus - Legionella pneumophila - Mycoplasma pneumoniae - Clamydia pneumoniae G. Santelli 10 Streptococcus pneumoniae • Cocco gram-positivo presente in coppia o a catena • Principale patogeno respiratorio causa di : – polmonite contratta in comunità (50% dei casi) – sinusite acuta (>30% dei casi) – AECB (20% dei casi) © Jim Sullivan • Presenta una crescente resistenza agli antibiotici blattamici ed ai macrolidi G. Santelli Aumento dello S. pneumoniae penicillino-resistente negli USA 1996–97 1994–95 1992–93 1990–91 1988–89 1987 1986 1985 1984 1983 1982 1981 1980 1979 Penicillino-resistente (MIC 2,0 mg / L) Penicillino-intermedio (MIC 0,12–1,0 mg / L) 0 10 20 30 % penicillino-intermedio o resistente Doern. Am J Med 1995;99(Suppl. 6):3–7S; Thornsberry et al Diagn Microbiol Infect Dis 1997;29:249–57 40 12 G. Santelli Diffusione mondiale dello S. pneumoniae penicillino-resistente <10% 10–20% 20–30% 30–40% >40% N.p. MIC 0.12 mg / L Baquero et al. Clin Microb Infect 1998;4 (Suppl. 2):19–26 (1993–1997) 13 G. Santelli Diffusione dello S. pneumoniae penicillino-resistente nelle Americhe (1993–1997) <10% 10–20% 20–30% 30–40% >40% MIC 0.12 mg / L Baquero et al. Clin Microb Infect 1998;4 (Suppl. 2):19–26 14 G. Santelli Diffusione dello S. pneumoniae penicillinoresistente in Europa (1993–1997) <10% 10–20% 20–30% 30–40% >40% N.p. MIC 0.12 mg / L Baquero et al. Clin Microb Infect 1998;4(Suppl. 2):19–26 15 G. Santelli 3% 7% 11% Resistenza alla penicillina (%) nel Streptococcus pneumoniae 16 G. Santelli PROTEKT: diffusione mondiale della resistenza di S. pneumoniae alla penicillina (1999–2000) Penicillino-intermedio (MIC 0,12–1,0 mg / L) Penicillino-resistente (MIC 2,0 mg / L) % isolati 80 70 n=501 60 50 n=114 n=630 n=450 n=145 n=977 n=2817 40 30 20 10 0 Australasia PROTEKT, March 2001 N. America Europa or. A liv. mondiale Europa occ. Asia America latina 17 G. Santelli Resistenza ai macrolidi • Modifiche a livello della sede bersaglio (resistenza MLSB): – la metilazione dell’ rRNA inibisce il legame al farmaco – la metilasi viene codificata da geni erm trasportati dai plasmidi – conferiscono resistenza a tutti i macrolidi, alle streptogramine ed alle lincosamidi – inducibili o costitutive • Efflusso (M-resistenza): – conferisce resistenza ad altri macrolidi ma non agli altri membri del gruppo MLS Weisblum. Antimicrob Agents Chemother 1995;39:577–85 Tait-Kamradt et al. Antimicrob Agents Chemother 1997;41:2251–5 18 G. Santelli Diffusione dello S. pneumoniae macrolidoresistente a livello mondiale (1993–1997) <10% 10–20% 20–30% 30–40% >40% N. p. Baquero et al. Clin Microb Infect 1998;4(Suppl. 2):19–26 come eritromicino-resistente a Definito 19 G. Santelli PROTEKT: diffusione mondiale della resistenza di S. pneumoniae ai macrolidi (1999–2000) % isolati n=501 Macrolido-resistente (Eritromicina MIC 1,0 mg/L) 80 70 60 50 n=114 n=630 n=450 n=145 n=977 n=2817 40 30 20 10 0 Australasia PROTEKT, March 2001 N. America Europa or. A liv. mondiale Europa occ. Asia America latina 20 G. Santelli 23.9% 36.6% Resistenza alla eritromicina (%) nel Streptococcus pneumoniae 25.0% 21 G. Santelli S. pneumoniae fluorochinolone-resistente in Europa (1994–1995) UK Ciprofloxacino-resistente (MIC >1 mg/L) Irlanda Paesi bassi Sparfloxacino-resistente (MIC >1 mg/L) Germania Slovacchia Ungheria Portogallo Italia Francia Spagna 0 Richard et al. J Antimicrob Chemother 1998;41:207–14 40 20 % isolati resistenti 60 22 G. Santelli Haemophilus influenzae • Bacillo gram-negativo • Importante patogeno del tratto respiratorio – principale patogeno dell’AECB e della sinusite – presente in 15% dei casi di polmonite contratta in comunità • Causa anche di meningite, epiglottite e cellulite • Presenta una sempre maggiore resistenza agli antibiotici b-lattamici G. Santelli Diffusione dell’H. influenzae b-lattamasi-positivo in Europa <10% 10–20% 20–30% 30–40% >40% N.p. Baquero et al. Clin Microbiol Infect 1998;4(Suppl. 2):19–26 24 G. Santelli Moraxella catarrhalis • Cocco diploide gram-negativo • Sempre più frequentemente riconosciuto come patogeno delle vie respiratorie • Causa di 17% dei casi di AECB 0–8% dei casi di sinusite acuta 1% dei casi di polmonite contratta in comunità • >90% dei ceppi produce blattamasi • Presenta una sempre maggiore resistenza ai macrolidi G. Santelli 1998 84.5% 1999 87.0% Produzione di ß-lattamasi nella Moraxella catarrhalis 26 G. Santelli Streptococcus pyogenes • Cocco gram-positivo di forma sferica/ovoidale, presente in coppia o a catena • Principale patogeno causale della faringite • Anche causa delle seguenti infezioni cutanee – pioderma da streptococco – erisipela © Jim Sullivan • Produce tossine extracellulari – esotossina pirogena scarlattina G. Santelli PROTEKT: diffusione mondiale della resistenza di S. pyogenes ai macrolidi (1999–2000) % isolati 30 Macrolido-resistente (Eritromicina MIC 1,0 mg/L) n=199 20 n=29 n=355 n=234 n=66 n=316 n=1199 10 0Australasia PROTEKT, March 2001 N. America Europa or. A liv. mondiale Europa occ. Asia America latina 28 G. Santelli Patogeni atipici: Legionella pneumophila • Bacillo gram-negativo • Maggiormente presente nei fumatori anziani, nei pazienti affetti da patologie renali e nei trapiantati • I principali sintomi delle patologie da Legionella sono: febbre alta, senso di malessere, mialgia, brividi, tosse secca • Le epidemie sono sporadiche e, in genere, limitate alle comunità ed ai mesi estivi G. Santelli Patogeni atipici: Mycoplasma pneumoniae • Patogeno gram-negativo, obbligato • Comune causa di polmonite fra i pazienti in età scolare e nei giovani (5–35 anni di età) • Elevati tassi di incidenza nelle comunità “chiuse” (studenti universitari, reclute militari, detenuti) • La maggior parte dei casi sono auto-limitanti • Cicli ogni 4 anni G. Santelli Patogeni atipici: Chlamydia pneumoniae • Patogeno intracellulare gram-negativo, obbligato • Sempre più frequente causa di CAP (responsabile per ~10% di tutti i casi di polmonite) • Può agire come cofattore nelle infezioni respiratorie • Uno dei più diffusi agenti infettivi a livello mondiale (~50% degli adulti presentano sieropositività) Kauppinen & Saikku. Clin Infect Dis 1995;21(Suppl. 3):244– 52 G. Santelli Staphylococcus aureus • Cocco gram-positivo • La sua incidenza può aumentare in seguito ad epidemie influenzali • Causa del 2–10% dei casi acuti di polmonite contratta in comunità • La maggior parte dei ceppi produce b-lattamasi • Ben il 20% dei ceppi può arrivare a presentare resistenza ai macrolidi G. Santelli Haemophilus parainfluenzae • Bacillo gram-negativo • Presente nella gola del 10–25% dei bambini • Sintomi clinici, in genere, simili a quelli da H. influenzae • La maggior parte dei ceppi risulta sensibile all’ampicillina, nonostante la produzione di b-lattamasi sia in continuo aumento 33 G. Santelli Klebsiella pneumoniae • Bacillo gram-negativo • Colpisce, di solito, i pazienti anziani più deboli o i pazienti con compromissione del sistema immunitario • Presenta una sempre maggiore resistenza multipla ai farmaci 34 G. Santelli FARINGITE 35 FARINGITE G. Santelli FARINGITE: Eziologia Coronavirus (5%) Adenovirus (5%) Rinovirus (20%) Altri batteri/virus (7%) S. pyogenes (15–30%) Ignota (40%) Gwaltney. In: Principles and Practices of Infectious Disease 1990; 43:493–8. 37 G. Santelli Streptococcus pyogenes G. Santelli Linee guida per la terapia antibiotica della faringite (Sanford Guide, 2003) REGIME PRIMARIO: • Penicillina V po x 10 giorni o, in caso di difficile compliance • Benzatin-Penicillina IM in dose singola REGIME a gen. x 10 giorni • Cefalosporina orale di 2 ALTERNATIVO: o • Eritromicina x 10 giorni o •Azitromicina/ Claritromicina 39 G. Santelli OMA 40 G. Santelli 41 G. Santelli Haemophilus influenzae Moraxella catarrhalis Streptococcus pneumoniae 42 G. Santelli 43 G. Santelli Epidemiologia e forme cliniche delle infezioni da H.influenzae FORMA CAPSULATA* FORMA NON CAPSULATA bambini <5 anni portatori nasofaringei: 3-5% bambini e adulti portatori nasofaringei: 50-80% infezioni invasive: infezioni non invasive: Meningite Epiglottite Batteriemia Cellulite Artrite settica Polmonite, Empiema Otite media Congiuntivite Sinusite Bronchite * 6 tipi a-f (tipo B = 95%) G. Santelli 45 G. Santelli 46 G. Santelli 47 G. Santelli A stenotic middle meatus do not allows an adeguate mucous drenage. 48 G. Santelli EZIOLOGIA DELLA SINUSITE ACUTA S. aureus Streptococchi (8%) (6%) Stafilococchi M. catarrhalis (1%) (7%) Batteri anaerobi (7%) S. pneumoniae (34%) Altri batteri (5%) H. influenzae (35%) Percentuali totali superiori al 100% per presenza concomitante di patogeni diversi Willett et al. J. Gen. Intern. Med. 1994; 9:38–45. 49 G. Santelli Haemophilus influenzae Moraxella catarrhalis Streptococcus pneumoniae 50 G. Santelli 51 G. Santelli 52 G. Santelli DEFINIZIONE DI BPCO Linee Guida ATS/ERS “La BPCO è una malattia prevenibile e trattabile caratterizzata da una limitazione al flusso aereo che non è completamente reversibile. La limitazione al flusso aereo è abitualmente progressiva ed è associata ad una abnorme risposta infiammatoria da parte dei polmoni verso particelle nocive o gas, principalmente fumo di sigaretta. Benché la BPCO colpisca i polmoni, essa produce importanti effetti a livello sistemico.” 53 G. Santelli SCOPI DELLA TERAPIA NELLA BPCO 1. Migliorare ed abolire i sintomi 2. Aumentare la resistenza all’esercizio fisico 3. Ridurre il numero e la gravità delle riacutizzazioni 4. Migliorare lo stato di salute generale del paziente 54 G. Santelli LIMITI DELLA TERAPIA NELLA BPCO Nessun farmaco a tutt’oggi si è dimostrato in grado di contrastare il declino della funzionalità ventilatoria polmonare. 55 G. Santelli DEFINIZIONE DI RIACUTIZZAZIONE DI BRONCHITE CRONICA (AECB) • Peggioramento dei sintomi: - Tosse - Dispnea - Variazioni qualitative e quantitative dell’espettorato • Criteri accessori: - Variazione dell’esame obiettivo polmonare - Febbre - Edemi declivi. Gold 2003 56 G. Santelli Definizione di AECB (Acute Exacerbation Chronic Bronchitis) Flusso Tosse Volume esp. Dispnea AECB Viscosità esp. Purulenza esp. Anthonisen NR, et al. Ann Int Med. 1987;106:196-204. 57 G. Santelli Eziologia delle AECB Infezione Allergia Batterica Virale AECB Inquinamento Meteorologia Biossido di zolfo Inverno Stagione piovosa Polveri industriali Ball P. Chest. 1995;108:43S-52S. Gump DW, et al. Am Rev Respir Dis. 1976;113:465-74. 58 G. Santelli Riacutizzazioni di BPCO in soggetti tipo GOLD 2B (n=88) non infettive 29.6 % • Pseudomonas batteriche 38.6 % aeruginosa • Streptococcus pneumoniae • Haemophilus Influenzae • Moraxella catarrhalis • Staphilococcus aureus • VRS virali 31.8 % Visconti M. et al., 2002 • Influenzae B • Influenzae A • Parainf. • Adenovirus 41.2% 17.6% 17.6% 14.7% 8.8% 32.2% 25.0% 21.4% 10.7% 10.7% 59 G. Santelli EZIOLOGIA DELLE ESACERBAZIONI ACUTE DELLA BRONCHITE CRONICA S. pneumoniae (19%) M. catarrhalis (17%) Altri batteri (17%) H. influenzae (47%) Ball. Chest 1995; 108:43S–52S. 60 G. Santelli Eziologia batterica delle AECB • Gram-negativi – Haemophilus influenzae – Moraxella catarrhalis – Haemophilus parainfluenzae – Enterobacteriaceae* – Pseudomonas aeruginosa* • Gram-positivi – Streptococcus pneumoniae – Altri patogeni respiratori Patogeni principali *Di solito solo in pazienti con bronchite cronica avanzata Ball P. Chest. 1995;108:43S-52S. 61 G. Santelli Classificazione di gravità della BPCO Stadio Caratteristiche 0 a rischio Spirometria normale sintomi cronici (tosse, espettorato), esposizione a fattori di rischio I lieve FEV1/FVC < 70%; FEV1> 80% del teorico con o senza sintomi cronici (tosse, espettorato) II moderata FEV1/FVC < 70%; 50% < FEV1 < 80% del teorico con o senza sintomi cronici (tosse, espettorato, dispnea) III grave FEV1/FVC < 70%; 30% < FEV1 < 50% del teorico con o senza sintomi cronici (tosse, espettorato, dispnea) IV molto grave FEV1/FVC < 70%; FEV1 < 30% del teorico Oppure FEV1 < 50% del teorico con insufficienza respiratoria o segni clinici riferiti a scompenso cardiaco dx GOLD 2003 62 G. Santelli AECB : Patogeni in causa nelle diverse classi funzionali FEV1 100% Stadio I Streptococcus pneumoniae Streptococcus species Staphylococcus aureus FEV1 50% Haemophilus influenzae Moraxella catarrhalis Haemophilus parainfluenzae Stadio II FEV1 35% Enterobacteriaceae Pseudomonas aeruginosa Eller J, et al. Chest. 1998;113:1542-8. Stadio III 63 G. Santelli Patogeni respiratori atipici nelle AECB 18 16% 16 Chlamydia pneumoniae 14 Mycoplasma pneumoniae 12 10 8 6% 6% Con altri organismi Con/senza altri organismi 6 4 2 0 Da solo Mogulkoc N, et al. Am J Respir Crit Care Med. 1999;160:349-53. 64 G. Santelli Benefici degli antibiotici più moderni nelle AECB 224 riacutizzazioni in 60 pazienti ambulatoriali Agenti di 1a linea : Amossicillina, TMP/SMX, TCN, eritro Agenti di 2a linea : Cefalosporine Agenti di 3a linea :Amos/clav, azitromicina, ciprofloxacina Fallimenti: 1a linea > 3a linea (19% vs 7%, P < 0.05) Ricoveri ospedalieri: 1a linea > 3a linea (18% vs 5.3%,P < 0.02) Destache CJ et al. J Antimicrob Chemother. 1999;43A:107-113. 65 G. Santelli SCELTA EMPIRICA DELL’ANTIBIOTICO Patogeni probabili Terapia raccomandata Riacutizzazioni non complicate: < 4 riacutiz/anno. Non patologia associata. FEV1 50% del v.p. S. pneumoniae, H. influenzae, M. catarrhalis, H. parainfluenzae, resistenze non comuni Macrolide (azitromicina, claritromicina), cefalosporine di 2ª e 3ª generazione, doxiciclina. Riacutizzazioni complicate: età 65, >4 riacutiz/anno, >FEV1 < 50% del v.p. ma > 35% del v.p. Come sopra più pneumococchi resistenti, H. influenzae e M. catarrhalis che producono b-lattamasi, alcuni Gram-neg. enterici Amoxicillina-clavulanato, fluorochinoloni con aumentata attività pneumococcica (levofloxacina, moxifloxacina, gatifloxacina) Riacutiz complicate con rischio di P.aeruginosa: sepsi bronchiale cronica, necessità di terapia prolungata con CS, residenti in ospizi, > 4 riacutiz/anno, FEV1 35% Come sopra più P. aeruginosa Terapia e.v. se richiesto, fluorochinoloni con aumentata attività pneumococcica (levofloxacina, moxifloxacina, gatifloxacina), penicilline b-lattamasi resistenti con attività anti-pseudomonas, cefalosporine di 3ª e 4ª generazione con attività antipseudomonas (2 antibiotici per sepsi) Snow V l. Ann Intern Med 2001; Niederman MS Respir Infect 2000; Eller J Chest 1998 66 G. Santelli ATS 2004 • BC RIACUTIZZATA NON COMPLICATA: < 4 ACUTIZZAZIONI, NO COMORBILITA’, FEV1 > 50% • BC RIACUTIZZATA COMPLICATA: > 65 ANNI, > 4 ACUTIZZAZIONI O COMORBILITA’, FEV1 50-35% • BC A RISCHIO PER PSEUDOMONAS E GRAM NEGATIVI RESISTENTI: SEPSI, > 4 ACUTIZZAZIONI, BP > 10 ANNI, FEV1 < 35% 67 G. Santelli ATS 2004 • BC RIACUTIZZATA (H. Influenzae, M. Catarralis, S. Pneumoniae, H. parainfluenzae) prima scelta: AZITROMICINA/CLARITROMICINA alternativa: CEFALOSPORINE • BC RIACUTIZZATA COMPLICATA(stessi patogeni + ceppi resistenti) prima scelta: FLUORCHINOLONE o alternativa: AMOXICILLINA + AC. CLAVULANICO • BC RIACUTIZZATA A RISCHIO DI PS. AERUGINOSA Stessi patogeni + ceppi resistenti + P. aer/ K. Pn/ E. coli Terapia: CIPROFLOXACINA 68 G. Santelli FADOI 2004 • BC RIACUTIZZATA NON COMPLICATA (H. Influenzae, M. Catarralis, S. Pneumoniae, H. parainfluenzae) Macrolidi (claritromicina, azitromicina) Cefalosporine orali di 2° generazione Telitromicina • BC RIACUTIZZATA COMPLICATA(stessi patogeni + ceppi resistenti) Levofloxacina; Moxifloxacina Amoxicillina/ac. clavulanico • BC RIACUTIZZATA A RISCHIO DI PS. AERUGINOSA (Stessi patogeni + ceppi resistenti + P. aer/ K. Pn/ E. coli) Ciprofloxacina, Levofloxacina Ceftazidima, Cefepima 69 G. Santelli CAP: Polmoniti Acquisite in Comunità 70 G. Santelli POLMONITE COMUNITARIA CAP – Community Acquired Penumonia Malattia acuta con immagine radiologia di addensamento polmonare segmentario o multiplo, non preesistente, che si manifesta in un paziente non ospedalizzato o ricoverato da meno di 48 – 72 ore o residente in una casa di riposo o simili da più di 14 giorni dall’insorgenza dei sintomi 71 G. Santelli POLMONITE COMUNITARIA Epidemiologia USA: - 4 milioni casi / anno - 6° causa di morte (ca. 87.000 decessi/anno) - 13 % di mortalità - 15 % aumento di mortalità dal 1979 al 1997 EUROPA: - 3 milioni casi / anno ITALIA: - 10 casi anno / 1000 abitanti 72 G. Santelli Epidemiologia delle CAP: dati europei • Incidenza in Europa da 4,7 a 11,6 per 1.000 abitanti (ERS Eur Resp J 1998; 8: 391-426) • Mortalità in Italia 12 per 100.000 abitanti (anni 1989-1991) (Logroscino et al. Monaldi Arch Chest Dis 1999; 541: 11-17) • 50.000 casi di ricovero per polmonite per anno in UK, tasso di mortalità del 16-40% (Wort et al. BMJ 1998) • Incidenza in Italia: 2,18 per 1.000 maschi, età < 64 anni 3,16 per 1.000 (Viegi et al EPI-CAP 99)G. Santelli 73 POLMONITE COMUNITARIA Incidenza per fasce di età Popolazione generale 1 – 11,6 / 1000 ab. Anno 0 – 4 anni 12 – 18 / 1000 ab. Anno 5 – 60 anni 1 - 5 / 1000 ab. Anno 60 – 65 anni > 65 anni > 65 anni 20 / 1000 ab. Anno 25 – 44 / 1000 ab. Anno istituzionalizzati 68 – 144 / 1000 ab. Anno 74 G. Santelli POLMONITE COMUNITARIA Sede di trattamento 80 % trattamento a domicilio 20 % trattamento ospedaliero FATTORI DI RISCHIO PER RICOVERO età gravità abitudini del medico patologie concomitanti soluzione logistico – geografica condizioni socio – economiche 75 G. Santelli PAZIENTE COMPROMESSO Paziente con compromesse capacità di difesa specifica e/o aspecifica secondarie ad altre patologie Boncopneumopatia cronica ostruttiva Diabete mellito Cirrosi epatica Etilismo cronico Neoplasie Scompenso cardiaco Cachessia Insufficienza renale cronica Ictus cerebrale Terapia immunosopressiva, steroidea, citostatica Intervento chirurgico Malattie neuromuscolari 76 G. Santelli Patogeni implicati nelle CAP — Europa 5961 pazienti adulti ricoverati per CAP in 26 studi prospettici da 10 Paesi europei S Pneumoniae C Pneumonae Viral M Pneumoniae Atipici 25% Legionella spp H Influenzae G-neg Enterobacteria 0 5 10 15 20 25 30 % casi Woodhead MA. Chest 1998;113:183S–187S 77 G. Santelli Implicazioni della polmonite atipica • Le caratteristiche cliniche e radiografiche dell’infezione atipica sono simili alle infezioni tipiche • La classificazione in sindromi “atipiche” o “tipiche” non predice accuratamente l’eziologia • I patogeni atipici sono causa frequente di CAP • Il risultato clinico è simile per i patogeni atipici e tipici • La terapia empirica deve includere la copertura di patogeni atipici • La terapia empirica deve includere un agente che penetri intracellularmente e raggiunga elevate concentrazioni intracellulari. Reimann HA. JAMA. 1938;111:2377-82. Liebermann D. Clin Chest Med. 1999;20:489-97. Marrie TJ et al. Am J Med. 1996;101:508-15. 78 G. Santelli Ricovero di pazienti con CAP basato sui patogeni Casi per 100,000 abitanti 120 100 Streptococcus pneumoniae Mycoplasma pneumoniae Legionella species Chlamydia pneumoniae 80 60 40 20 0 18-34 35-49 50-64 65-79 >80 Gruppo di età (anni) Marston BJ et al. Arch Intern Med. 1997;157:1709 - 18 79 G. Santelli DIE (2-3) ICU (1-4) Ospedale Polmonite Con ricovero ospedaliero (20) Polmonite diagnosticata Comunità in comunità (100) RTI di comunità trattate con Antibiotici (2000) Pazienti visitati con sintomi di LRTI (8000) Popolazione con LRTI acuta nella comunità (24.000) Macfarlane J. Semin Respir Infect 1999;14:151-162 80 G. Santelli Pneumonia PORT Prediction Rule per la valutazione del rischio di morte STEP 1 STEP 2 Il paziente ha più di 50 anni? No E’ presente una delle seguenti patologie?: Sì Assegnare punteggio per: Sì Variabili Demografiche Comorbidità Neoplasia; scompenso cardiaco congestizio; patologia cerebrovascolare; patologia renale; epatopatia No E’ presente una delle seguenti anomalie?: Rilievi fisici Sì Stato mentale alterato; F.C: 125/min; frequenza respiratoria 30/min; PAS < 90 mm Hg; temperatura < 35ºC or 40ºC No Dati di laboratorio e radiografici Classe II ( 70 punti) Classe III (71-90 punti) Classe IV (91-130 punti) Classe V (> 130 punti) Classe I Fine MJ, et al. N Engl J Med. 1997;336:243-50. G. Santelli 81 PSS (Point Scoring System) “punteggio Fine” Classi di rischio assegnate secondo studio PORT Classe di rischio Punti Mortalità% Gestione I N/A 0,1-0,4 Ambulatoriale II <70 0,6-0,7 Ambulatoriale III 71-90 0,9-2,8 Ricovero IV 91-130 8,2-9,3 Ricovero V >130 27,0-31,1 Ricovero Fine M.J. et al. New Engl J Med, 1997 82 G. Santelli Assegnazione del punteggio (Fine et al. 1997) Fattori Demografici Età : maschi femmine Residenza Casa di Riposo anni anni -10 +10 Malattie Concomitanti Tumori Epatopatie Scompenso cardiaco Malattie Cerebrovascolari Nefropatia +30 +20 +10 +10 +10 Confusione Mentale Frequenza Respiratoria > 30/m Pressione sistolica <90 Temperatura <35° or > 40°C Polso > 125/m +20 +20 +20 Obiettività Esami di Laboratorio pH < 7.35 Azotemia > 10.7 mMol/L Sodio <130 mEq/L Glucosio >13.9 mMol/L Ht < 30% PaO2<60 mmHg (or sat O2<90%) Versamento pleurico +15 +10 +30 +20 +20 +10 +10 +10 +10 83 G. Santelli Patogeni e gravità Ambulatoriale, nessun fattore di modifica Ambulatoriale e fattori di modifica Ricovero reparto medico Ricovero Terapia Intensiva S pneumoniae M pneumoniae C pneumoniae H influenzae S pneumoniaea M pneumoniae C pneumoniae H influenzae S pneumoniaea M pneumoniae C pneumoniae H influenzae BNG enterici Legionella spp Anaerobi S pneumoniaea M pneumoniae BNG enterici < 5% mortalità < 5% mortalità, 20%ricovero 5-25% mortalità H influenzae BNG enterici Legionella spp S aureus P aeruginosa 50% mortalità BNG, bacilli Gram-negativi. aInclusi pneumococchi farmaco-resistenti. American Thoracic Society. Am J Respir Crit Care Med. 2001;163:1730-54. 84 G. Santelli Ambulatoriali—Opzioni Terapeutiche (1) Penicillina*, aminopenicillina ± inibitore b-lattamasi ERS (specialmente se sospetto H influenzae), macrolide, tetracicline, cefalosporine, chinoloni, streptogramina orale IDSA Macrolide, dossiciclina, fluorochinolone CIDS/CTS Macrolide*, dossiciclina dossiciclina BPCO, non terapia recente Macrolide*, BPCO, recente terapia Fluorochinolone*, amossicillina/clavulanato + macrolide Sospetta macroaspirazione amossicillina/clavulanato ± macrolide*, fluorochinolone + macrolide Nursing home Fluorochinolone,amossicillina/ clavulanato + macrolide *Opzione preferita Huchon G, et al. Eur Resp Rev. 1998;8:391-426. Bartlett JG, et al. Clin Infect Dis. 2000;31:347-82. Mandell LA, et al. Clin Infect Dis. 2000;31:383-421. G. Santelli 85 Indicazioni della CIDS-CTS (Canadian Infection Diseases society- Canadian Thoracic Society 2000) per il trattamento delle polmoniti nel paziente ambulatoriale Tipo di paziente trattamento di prima scelta trattamento di seconda scelta Ambulatoriale senza fattori di Macrolide rischio doxiciclina Ambulatoriale con fattori di rischio -BPCO -BPCO: terapia con antibiotici o steroidi negli ultimi 3 mesi Nuovi macrolidi Fluorchinoloni Doxiciclina Amox/ac clavulanico Ambulatoriale con sospetta aspirazione Amoxacillina/ac clavulanico + macrolide Fluorchinolone + clindamicina o metronidazolo Ambulatoriale residente in casa di riposo Fluorchinolone o amoxacillina/ac clavulanico + macrolide Cefalosporina di 2^ generazione + macroloide Eritromicina, azitromicina, claritromicina Levofloxacina, moxifloxacina , gatifloxacina 86 G. Santelli Indicazioni ATS (American thoracic society 2001) per il trattamento delle polmoniti nel paz. ambulatoriale Tipo di paziente Microrganismi più frequenti Terapia Paz ambulatoriale senza patologie cardiopolmonari associate né altri fattori di rischio Strep pneumoniae Mycoplasma P. Chlamydiae P. Haemophilus influenzae Virus respiratori Legionella spp Mycobacterium tubercolisis Azitromicina o claritromicina doxiciclina Paz ambulatoriale con patologie associate cardiopolmonari e/o altri fattori di rischio Strep. pneumoniae Mycoplasma pneumoniae Chlamydiae pneumoniae Infezioni miste: (batteri+atipici o virus) Haemophilus influenzae Virus respiratori Legionella spp Mycobacterium tubercolisis Beta-lattamici (cefpodixina, cefuroxime orale, amoxacillina oppure ceftriaxone parenterale seguitoda cefpodixina orale + macrolide oppure fluorchinolone da solo 87 Trattamento dei pazienti ospedalizzati con CAP (I) Le ultime linee guida dell’ATS • Pazienti senza fattori modificanti – S. pneumoniae – H. influenzae – M. pneumoniae – C. pneumoniae – Infezione mista – Virus – Legionella • Terapia – Azitromicina EV (se allergia o intolleranza Dossiciclina + Betalattamico) – Un fluorochinolone da solo Adattato da ATS Am J Respir Crit Care Med 2001; 163: 730-1754 88 G. Santelli Trattamento dei pazienti ospedalizzati con CAP (II) Le ultime linee guida dell’ATS • Pazienti con fattori modificanti – S. pneumoniae (DRSP) – H. influenzae – C. pneumoniae – Infezione mista – Enterobatteri Gram negativi – Aspirazione – Virus – Legionella • Terapia – Betalattamico EV Adattato da ATS Am J Respir Crit Care Med 2001; 163: 730-1754 (Cefotaxime/Ceftriaxone/ AmpicillinaSulbactam/Ampicillina HD) PIU’ Macrolide o Dossiciclina – Fluorochinolone da solo 89 G. Santelli Trattamento dei pazienti in UTI con CAP (III) Le ultime linee guida dell’ATS • Pazienti non a rischio • Terapia di P. aeruginosa – Betalattamico EV (Cefotaxime/Ceftriaxone) – S. pneumoniae (anche DRSP) – Legionella spp PIU’ – H. influenzae – Enterobatteri gram Macrolide EV o negativi Fluorochinolone EV – S. aureus – M. pneumoniae – Virus 90 – miscellanea Adattato da ATS, Am J Respir Crit Care Med 2001; 163: 730-1754 G. Santelli Trattamento dei pazienti in UTI con CAP (IV) Le ultime linee guida dell’ATS • Pazienti a rischio per P. aeruginosa – Come gruppo precedente + Pseudomonas aeruginosa • Terapia – Betalattamico antipseudomonas EV (cefepime, imipenem, meropenem, piperacillina/tazobactam) PIU’ aminoglicoside EV + macrolide EV + fluorochinolone EV oppure PIU’ ciprofloxacina EV Adattato da ATS, Am J Respir Crit Care Med 2001; 163: 730-1754 91 G. Santelli Indicazioni della IDSA (Infection Diseases Society of America 2000) per il trattamento delle polmoniti nel paz ambulatoriale • Generalmente indicati senza un particolare ordine di preferenza : doxiciclina, macrolide o fluorchinolone. • Considerazioni sull’uso: tutti questi agenti antibatterici includono nel loro spettro di azione i patogeni più frequentemente implicati : S. pneumoniae, M. pneumoniae, C. pneumoniae. • La scelta dovrebbe tener conto del profilo di resistenza a livello locale di S. pneumoniae. • Nel paziente anziano o nel soggetto con malattie concomitanti i fluorchinoloni possono essere di prima scelta. 92 G. Santelli Linee guida della Infectious Diseases Society of America (IDSA) per la CAP in pazienti ospedalizzati Reparto di medicina generale Da preferirsi in via generale: cefalosporina o betalattamico protetto + un macrolide o un fluorochinolone (da solo) Pazienti ricoverati in terapia intensiva Da preferirsi in via generale:cefalosporina o betalattamico protetto + un macrolide o un fluorochinolone Fattori modificanti • Malattia strutturale del polmone: piperacillana, piperacillina-tazobactam, carbapenemico, cefepime + un fluorochinolone • Allergia alla penicillina: un fluorochinolone con o senza clindamicina • Sospetta aspirazione: un fluorochinolone più o meno clindamicina o metronidazolo, oppure un betalattamico + inibitore della betalattamasi 93 G. Santelli Indicazioni della ERS (European Respiratory Society 1998) per il trattamento delle infezioni delle basse vie respiratorie nel paz. ambulatoriale Prima scelta Alternative Casi particolari Aminopenicilline Doxiciclina, cefalosporine orali di 3^ generazione, macrolidi, streptogramine orali -Epidemie Mycoplasma: macrolide -Alta frequenza di H. Influenzae beta- lattamasi produttori. BPCO, recente fallimento con aminopenicilline: Aminopenicilline + inibitore beta lattamasi Streptogramine orali: pristinamicina 94 G. Santelli CAP - linee guida FADOI Pazienti non ospedalizzati Giovane adulto Claritromicina/Azitromicina Telitromicina Levofloxacina/Moxifloxacina 95 G. Santelli CAP - linee guida FADOI Pazienti non ospedalizzati Adulto senza fattori di rischio Adulto con fattori di rischio Amoxiclav/Cef orale 2 gen Amoxiclavulanato + Claritromicina/Azitromicina + Claritromicina/Azitromicina Telitromicina CTX/CRO/Cefepime Levofloxacina/Moxifloxacina + Claritromicina/Azitromicina Levofloxacina/Moxifloxacina 96 G. Santelli Qual è la durata ottimale? “La maggioranza concorda sul fatto che una riduzione della durata della terapia minimizzi l’esposizione batterica agli antibiotici, riducendo di conseguenza la pressione selettiva per l’insorgenza di resistenze. Tuttavia spesso l’informazione sulla durata ottimale del trattamento è scarsa.” Low D. & Scheld WM, JAMA, 1998 97 G. Santelli Durata della terapia antibiotica nelle CAP Microrganismo C. Pneumoniae Legionella Mycoplasma S. Pneumoniae S. Aureus Durata 14 - 21 giorni 21 giorni 14 - 21 giorni 3 - 5 giorni (dopo lo sfebbramento) 21 giorni 98 G. Santelli Trattamento antibiotico “Continua a prendere le compresse” È un dogma molto diffuso nella pratica medica altrimenti…. •non guarigione o ricaduta •insorgenza di resistenza Lambert HP, The Lancet 354, 1999 99 G. Santelli Sembra paradossale che, nonostante la tendenza attuale ad un uso più restrittivo degli antibiotici, si ingiunga così frequentemente e si creda così ampiamente che occorra completare il ciclo di terapia. Un trattamento antibiotico che sia prolungato senza necessità, aumenta il rischio di effetti collaterali per il singolo paziente e contribuisce ai nostri attuali problemi di antibiotico-resistenza. Lambert HP, The Lancet 354, 1999 100 G. Santelli Conclusione L’uso di una terapia di breve durata, per il trattamento di infezioni acquisite in comunità con una bassa carica batterica, è possibile in pazienti immuno-competenti. I vantaggi comprendono una migliore tollerabilità, una riduzione dei costi sanitari, una migliore compliance del paziente e la prevenzione dell’insorgenza di resistenze. Pechere JC, J Int Med Res, 2000 101 G. Santelli
Scaricare