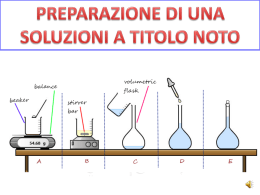
Tipi di reazioni chimiche Sintesi tra elementi :atomizzazione e formazione di molecola H-H + Cl-Cl >>> HCl + HCl K - O - K + O = C = O >>> K2CO3 K20 + CO2 >>> K2CO3 Combinazione tra due composti per originare un solo composto K2CO3 >>>> K - O - K + O = C = O K2CO3 >>> K20 + CO2 decomposizione di un composto in due composti NaCl + KI >>>> NaI + KCl Doppio spostamento: scambio di cationi Zn + 2HCl >>> ZnCl2 + H2 Spostamento semplice HCl + NaOH >>> NaCl + H2O Neutralizzazione: acido + base >>> sale + acqua Cinetica chimica Perché una reazione possa avvenire le particelle dei reagenti devono venire a contatto (urtarsi) con una energia opportuna (per rompere legami presenti) e con una orientazione (dipende dalla geometria molecolare) che permetta l’avvicinamento degli atomi che devono stabilire il nuovo legame:urti efficaci Poco veloci, orientamento non corretto Prodotto da ottenere Poco veloci, orientamento corretto Prodotto da ottenere veloci, orientamento corretto Prodotto da ottenere veloci, orientamento corretto Prodotto da ottenere
Scaricare