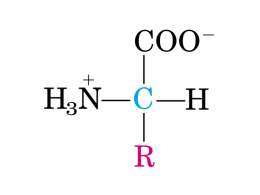
Ossidazione degli amminoacidi Gli amminoacidi, derivanti dalle proteine, possono essere degradati, ossidati, contribuendo in maniera significativa alla generazione di energia metabolica della cellula. Le situazioni che portano ad una maggiore degradazione degli amminoacidi sono: • Un eccesso di rispetto al fabbisogno per la sintesi delle proteine • Una dieta ricca di proteine che apporta più amminoacidi del necessario e quindi questi vengono degradati • Il digiuno o il diabete mellito portano ad una diminuzione degli zuccheri, le proteine diventano una fonte di energia Ossidazione degli amminoacidi Il gruppo amminico viene staccato ed lo scheletro carbonioso, un chetoacido, viene ossidato a CO2 e acqua. Quando il chetoacido è a tre o quattro atomi di carbonio può essere utilizzato per la neosintesi di glucosio, necessario per il fabbisogno energetico cerebrale o muscolare. L’eliminazione del gruppo amminico distingue la via catabolica degli amminoacidi dalle altre viste fino ad ora. Le proteine introdotte con la dieta, raggiunto lo stomaco, vengono denaturate dalla sua elevata acidità e idrolizzate in peptidi corti dalla pepsina che a pH acido è attiva su residui di amminoacidi aromatici. Nel duodeno invece operano la tripsina, la chimotripsina, la carbossipeptidasi ed altre peptidasi che liberano gli amminoacidi che vengono poi assorbiti attraverso le pareti cellulari. Digestione ed assunzione di proteine. Schema di una parte del tratto digestivo con evidenziate varie funzioni svolte nella digestione delle proteine. Ossidazione degli amminoacidi Ciclo dell’urea - Parte del metabolismo di alcuni organismi che conduce all’eliminazione dell’azoto ammoniacale in eccesso. L’azoto proviene dal metabolismo delle proteine e degli amminoacidi Dieta amminoacidi a-chetoacidi Glucosio Gluconeogenesi Proteine intracellulari Ciclo dell’acido citrico respirazione CO2 + H2O NH4+ escrezione Biosintesi AA. Nucleotidi ammine. Forme di escrezione dell’ammonio NH4 Animali ammoniotelici: la maggior parte dei vertebrati acquatici pesci con scheletro osseo, larve di anfibi + Ammonio H2N CONH2 Animali ureotelici: molti vertebrati terrestri (anche gli squali) Urea O H O H N N O N H N H Acido urico Animali uricotelici: uccelli, rettili L’ammonio è tossico, la sua conversione in urea è confinata nel fegato Dalla dieta a-chetoacidi amminoacidi a-chetoglutarato glutammato Dai muscoli NH4+ Dal muscolo e altri tessuti piruvato alanina NH4+ glutammina urea L’ammoniaca libera è molto tossica Altera il pH, reagisce con gli intermedi dei cicli energetici alterandoli, ha effetti neurotossici. NH4+ Interconversione tra amminoacidi: reazione di transamminazione CHO OH P-O COO| C=O | CH2 | CH2 | COO- COO| H3N+-C-H | R + PLP amminotransferasi L-amminoacido COO| H3N+-C-H | CH2 | CH2 | COO- + + COO| C=O | R N CH2 OH + N COO| C=O | CH2 | CH2 | COO- COO- + | H3N+-C-H | CH3 L-alanina H COO- PLP Alanina amminotransferasi | H3N+-C-H | CH2 | CH2 | COO- + COO| C=O | CH3 piruvato a-chetoglutarato glutammato PLP NH2 P-O glutammato CH3 H a-chetoacido a-chetoglutarato piridossal fosfato piridossammina fosfato CH3 PMP L’ammonio dei tessuti viene legato nella glutammina COO| H3N+-C-H + | CH2 | CH2 | COO- ATP COO| H3N+-C-H | CH2 | CH2 | O=C-OPO3= ADP Glutammina sintetasi glutammato NH4+ Pi Glutammina sintetasi COO| H3N+-C-H | CH2 | CH2 | O=C-NH2 glutammina g-glutammil fosfato L’ammonio viene liberato anche dal glutammato GTP ADP COO| H3N+-C-H | CH2 | CH2 | COO- NAD(P)+ NAD(P)H + H+ + glutammato + H2O glutammato deidrogenasi COO| C=O | CH2 | CH2 | COO- + a-chetoglutarato NH4+ Negli animali ureotelici l’azoto viene convogliato nei mitocondri degli epatociti e nel fegato viene convertito in urea. Hans Krebs, 1932 Sintesi dell’urea stimolata “cataliticamente” da: Ornitina Citrullina urea Arginina ornitina ammoniaca + CO2 arginina citrullina 2NH3 + CO2 H2N-CO-NH2 + H2O ammoniaca La reazione complessiva del ciclo dell’urea bicarbonato NH4+ + HCO3- NH3+ | -OOC-CH -CH 2 | COO- + ammonio aspartato 3 ATP 2ADP + AMP + 2Pi + PPi O || H2N-C-NH2 + urea -OOC-CH=CH-COO- fumarato + 2 H2O + H+ La sintesi dell’urea consiste di 5 reazioni enzimatiche ATP PPi aspartato citosol citrullina 3a (Citrullil-AMP) mitocondrio citrullina 3b 2ADP + 2Pi AMP NH4+ + HCO3- + 2ATP H2N-CO-O-PO3= 1 2 ornitina argininosuccinato 4 ornitina 5 urea arginina H2O fumarato Attivazione dell’ammonio prima che entri nel ciclo 1 NH4+ + HCO3- + 2ATP H2N-CO-O-PO3= + 2ADP + Pi Carbamilfosfato sintetasi I a) ATP + HCO3- [HOCO-O-PO3=] + ADP carbonilfosfato b) NH4+ + [HOCO-O-PO3=] [H2N-COO-] + Pi carbamato c) [H2N-COO-] + ATP H2N-CO-O-PO3= + ADP carbamilfosfato Condensazione con l’ornitina prima di uscire dal mitocondrio 2 H2N-CO-O-PO3= + +H NH3+ | NH3+ | 3N-CH2-CH2-CH2-CH ornitina H2N-CO-NH-CH2-CH2-CH2-CH | COO- citrullina Ornitina transcarbamilasi | COO- + Pi Trasformazione della citrullina in argininosuccinato nel citosol dell’epatocita 3 AMP | NH3+ O | | +H-N=C-NH-CH -CH -CH -CH 2 2 2 NH3+ a) | H2N-CO-NH-CH2-CH2-CH2-CH + ATP | COO - citrullina + PPi | COO - b) 2 Pi Citrullil-AMP Argininosuccinato sintetasi Citrullil-AMP AMP | NH3+ O | | +H-N=C-NH-CH -CH -CH -CH 2 2 2 | COO - + NH3+ | +H-N=C-NH-CH 2-CH2-CH2-CH | COO - | NH | CH-CH2-COO | COO - NH3+ | CH-CH2-COO | COO - argininosuccinato aspartato + AMP Liberazione di fumarato dall’argininosuccinato per dare arginina 4 arginina argininosuccinato NH3+ | +H-N=C-NH-CH -CH -CH -CH 2 2 2 | | COO NH | CH-CH2-COO | COO - Argininosuccinato liasi NH3+ | +H-N=C-NH-CH -CH -CH -CH 2 2 2 | | COO NH2 + - OOC-CH=CH-COO - fumarato Idrolisi dell’arginina per dare urea e rigenerare ornitina 5 urea arginina NH3+ | +H-N=C-NH-CH -CH -CH -CH 2 2 2 | | COO NH2 + H2O O || H2N-C-NH2 Arginasi ornitina NH3+ | +H N-CH -CH -CH -CH 3 2 2 2 | COO - Organizzazione del ciclo dell’urea all’interno della cellula Gli enzimi del ciclo dell’urea sembrano essere “raggruppati” cosicché la citrullina, l’argininosuccinato, l’arginina e l’ornitina non sono rilasciati nel citosol ma incanalati da un enzima all’altro; solo l’urea viene rilasciata. Il recupero del fumarato grazie a 2 enzimi del ciclo dell’acido citrico rifornisce di aspartato il ciclo dell’urea. NH3+ | CH-CH2-COO | COO - aspartato NH3+ | CH-CH2-COO | COO - aspartato transaminasi a-chetoglutarato citrullina ATP AMP + PPi malato deidrogenasi Glutammato - OOC-C-CH -COO 2 argininosuccinato || O NAD+ dal ciclo dell’acido citrico dal ciclo dell’urea NADH + H+ - OOC-CH-CH -COO 2 | OH - OOC-CH=CH-COO - fumarato - OOC-CH=CH-COO - fumarato H2O fumarasi arginina Bilancio energetico del ciclo dell’urea NH3+ | NH4+ + HCO3- + -OOC-CH2-CH | COO3 ATP 2ADP + AMP + 2Pi + PPi O || H2N-C-NH2 + 2Pi -OOC-CH=CH-COO- + 2 H2O + H+ Regolazione del ciclo dell’urea • Dieta • Digiuno • Regolazione a lungo termine • Regolazione a breve termine (arginina) CoA-S-CO-CH3 CoA-SH + + NH3+ | -OOC-CH -CH -CH 2 2 | COO - acetilglutammato sintetasi + NH-CO-CH3 | -OOC-CH -CH -CH 2 2 | COO - + NH4+ + HCO3- + 2ATP H2N-CO-O-PO3= + 2ADP + Pi Carbamilfosfato sintetasi I ATP Quando il ciclo dell’urea non funziona bene PPi aspartato 3a citrullina (Citrullil-AMP) STOP citrullina 3b 2ADP + 2Pi AMP STOP NH4+ + HCO3- + 2ATP STOP H2N-CO-O-PO3= 1 2 ornitina argininosuccinato citosol 4 mitocondrio ornitina 5 STOP arginina fumarato STOP H2O urea iperammoniemia NOME iperammoniemia tipo I “ tipo II citrullinemia arg-succ. aciduria argininuria difetto enzimatico carbamil-P sintetasi orn. transcarbamilasi arg-succ. sintetasi arg-succ. liasi arginasi si si + + - citrullinemia oroticoaciduria no si + si argininuria argininsuccinemia si si no si si Quando il ciclo dell’urea non funziona bene Difetti genetici - ridotta capacità di convertire l’NH4+ in urea Dieta selezionata, povera di proteine ed amminoacidi, ma arricchita di a-chetoacidi precursori degli amminoacidi essenziali. a-chetoacido (di aa. essenziale) transaminasi amminoacido (non essenziale) amminoacido (essenziale) a-chetoacido (di aa. non essenziale) Riepilogo • Il ciclo dell’urea è deputato alla trasformazione dell’azoto dalla forma ammoniacale, tossica, all’urea, meno tossica. • Il ciclo dell’urea è localizzato parte nel citosol e parte nei mitocondri degli epatociti. • L’urea si libera dall’arginina per idrolisi generando ornitina che viene poi convertita nei mitocondri in citrullina; la citrullina viene quindi addizionata di un azoto dall’acido aspartico per rigenerare l’arginina: gli intermedi quindi non vengono consumati e il loro livello ha un’influenza “catalitica”. • Costi energetici • Difetti genetici - dieta correttiva Ciclo del glucosio-alanina. L’alanina viene utilizzato come trasportatore di ammoniaca dai muscoli al fegato. Il piruvato, trasformato in glucosio attraverso la gluconeogenesi, ritorna al muscolo. Vie degradatorie degli amminoacidi • La degradazione degli amminoacidi normalmente contribuisce per il 10%-15% del nostro fabbisogno energetico. • I 20 processi catabolici portano alla formazione di 5 intermedi metabolici del ciclo degli acidi tricarbossilici: acetil-CoA a-chetoglutarato succinil-CoA fumarato ossalacetato Leucina Lisina Fenilalanina Triptofano Tirosina Isoleucina Leucina Triptofano Alanina Cisteina Glicina Serina Triptofano Piruvato Arginina Glutammina Istidina Prolina Acetil-CoA Acetoacetil-CoA 1 Citrato 2 Asparagina Aspartato Glutammato Ossalacetato Isocitrato NADH 3 8 CO2 Malato NADH a-chetoglutarato 7 4 CO2 Fumarato NADH Fenilalanina Tirosina 6 FADH2 5 Succinil-CoA Succinato GTP (ATP) Isoleucina Metionina Treonina Valina Fenilchetonuria PKU dovuta a deficienza dell’enzima finilalanina idrossilasi con accumulo di fenilalanina. Fenilchetonuria PKU dovuta a deficienza dell’enzima finilalanina idrossilasi L’accumulo di fenilalanina porta alla formazione di fenilacetato e fenillattato che vengono anche escreti nelle urine. Prolina, glutammato, glutammina, arginina, istidina H2C H2 C H C O OH C NH H2 Prolina O HO H2 O C H C C OH H2 NH2 glutammato O HO C H2 H2 C O OH O a-chetoglutarato glutammina O H2N O H2 C H C C OH H2 NH2 ornitina NH H2N H2 O H2 N C C H H C C OH H2 NH2 arginina istidina H2 O C H N C OH HC CH NH2 N H Amminoacidi convertiti in succinil-CoA Amminoacidi convertiti in ossalacetato
Scaricare