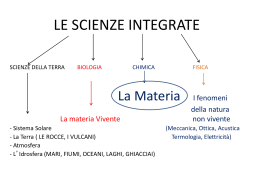
Dimensioni (sub)-atomiche • Il nucleo è 10.000 volte più piccolo dell’atomo • Il protone ed il neutrone sono 10 volte più piccoli del nucleo • Non ci sono evidenze che i quarks abbiano dimensione … Scale di raffronto 1 Å = 10-10 m 1 km globuli rossi 1 dm nucleo 1 cm nucleone ~10 µm elettrone Teoria VSEPR (Valence Shell Electron Pair Repulsion) La teoria della repulsione delle coppie elettroniche nel guscio di valenza parte dalla idea fondamentale che le coppie elettroniche nel guscio di valenza di un atomo si respingano tra loro. Questo riguarda sia le coppie solitarie (lone pair), che sono localizzate sull’atomo e non sono coinvolte nel legame, sia le coppie di legame, che sono condivise con altri atomi. Le coppie elettroniche si posizionano il più possibile lontano le une dalle altre per minimizzare l’energia e questo determina la geometria molecolare. Utile per prevedere geometrie approssimate di molecole che presentano un atomo centrale sebbene esistano limitazioni Numero sterico (SN) SN = Numero atomi legati + Numero coppie solitarie Per trovare la geometria occorre calcolare lo SN dell’atomo centrale ragionando sulla configurazione di Lewis 1 2 SN di C in CO2 C + O + O O C O SN = 2 (atomi di ossigeno legati) + 0 (coppie solitarie) = 2 1 SN di O in H2O O + H + H 1 H O 2 H 2 lone pair SN = 2 (atomi di idrogeno legati) + 2 (coppie solitarie) = 4 Geometria molecolare in funzione di SN e tipo di ibridazione SN = 2 sp Lineare sp3d SN = 5 Trigonale bipiramidale sp2 sp3d2 SN = 3 Trigonale planare SN = 6 Ottaedrica SN = 4 sp3 Tetraedrica SN = 7 Pentagonale bipiramidale Filmati http://didattica-online.polito.it Ulteriori aggiustamenti della geometria si calcolano considerando che: lone pair lone pair coppia legame coppia legame coppia legame Repulsione crescente lone pair Per cui ad esempio l’angolo diedro dell’acqua non è 109,5 ma 104,45° Stabilire la geometria molecolare di… H2O CO2 PF5 CH3Cl CH4 NH3 SF4 ClO3+ BrO4¯ Stabilire la formula di struttura di… acido ortosilicico. acido fosforico. acido difosforico (pirofosforico). acido solforico. acido nitrico. ione perclorico. Elencare gli idracidi alogenuri e ordinarli in ordine crescente del punto di ebollizione. continua… In genere per i metalli la temperatura di ebollizione diminuisce lungo il gruppo all’aumentare di Z (Gruppi IA, IIA, IIIA, IVA) In genere per i nonmetalli e i metalli di transizione la temperatura di ebollizione aumenta all’aumentare di Z (Gruppi VA, VIA, VIIA, VIIIA) Eccezioni: H e i gruppi IB e IIB L’andamento della temperatura di fusione segue all’incirca quello della temperatura di ebollizione Andamento temperature di ebollizione Alta T ebollizione IA 1 IIA 4 IIIA Bassa T ebollizione 2 3 VIIIA IIIB IVB VB VIB VIIB VIIIB IB IIB IVA Tavola periodica 5 6 7 Lantanidi Attinidi VA VIA VIIA risposta HCl < HBr < HI < HF HF ha il punto di ebollizione più alto perché le sue molecole formano legami idrogeno Gli altri idracidi seguono un andamento crescente con il peso molecolare Legge della conservazione della massa In una reazione chimica la somma delle masse delle sostanze reagenti è uguale alla somma delle masse dei prodotti della reazione, ovvero nulla si crea, nulla si distrugge ma tutto si trasforma. Lavoisier Nota: In realtà ad ogni sviluppo/assorbimento di energia la massa totale diminuisce/aumenta secondo l’equazione di Einstein E = m·c2. Tale variazione di massa è tuttavia del tutto trascurabile in una reazione chimica. Teoria atomica di Dalton •La materia è composta di atomi indivisibili •Tutti gli atomi dello stesso elemento hanno la stessa massa e stesse proprietà •Elementi diversi hanno atomi differenti; in particolare i loro atomi hanno masse differenti •Gli atomi sono indisttruttibili e mantengono la loro identità nelle reazioni chimiche •Un composto si forma dagli elementi mediante la combinazione degli atomi di elementi diversi secondo rapporti di numeri interi Dalton Stechiometria La stechiometria di una reazione chimica indica in che rapporti due o più sostanze reagiscono tra di loro. La stechiometria di una reazione viene rappresentata attraverso coefficienti, detti appunto stechiometrici e questi coefficienti esprimono i rapporti (molari) con cui le sostanze coinvolte nella reazione reagiscono. I coefficienti stechiometrici vengono posti prima di ogni specie chimica che partecipa alla reazione. In assenza di coefficiente si presuppone che il numero sia 1. Dozzina Quantità di sostanza di un sistema che contiene un numero di entità elementari pari al numero 12. Mole Quantità di sostanza di un sistema che contiene un numero di entità elementari pari al numero di Avogadro ( 6,02 x 1023) Numero di Avogadro (NA) 12 Numero di atomi in 12 g di carbonio 12 ( 6 C) NA 6 ,022 x 1023 Quante dozzine di tuorli ci sono in 2 dozzine di uova? Quante moli di ossigeno posso ricavare da 3 moli di acido solforico? 7 × 1022 stima del numero di stelle nell' universo osservabile. 1023 stima del numero di granelli di sabbia di tutte le spiagge del mondo. NA ≈ 6,022×1023 è il numero di atomi in 12 grammi di 12C 1024 è il numero totale di connessioni sinaptiche presenti nel cervello umano. Unità di massa atomica unificata (u / Da (dalton) u.m.a. / a.m.u.) La dodicesima parte della massa di un atomo di 12 carbonio-12 ( 6 C). 1 u = 1/NA g 1,66 x 10-24 g Partendo dalla definizione di NA ricavare il valore numerico di u. Se sommo la massa di 6 protoni e di sei neutroni non ottengo la massa del carbonio-12. Perché? Numero di massa (A) numero di protoni + numero neutroni (Z + N) A Z X Massa atomica (peso atomico) assoluta Massa di un atomo di un elemento espressa in grammi Massa atomica (peso atomico) relativa Numero che esprime il rapporto tra la massa di un atomo e la unità di massa atomica u Massa molecolare (peso molecolare) Grandezza analoga alla massa atomica (sia assoluta sia relativa) ma riferita a una molecola Peso formula Equivale alla massa molecolare relativa ma è riferita a composti chimici non molecolari e in particolare ai composti ionici. Massa molare Massa (peso) di 1 mole di qualsiasi sostanza. Viene espressa in g·mol-1. È numericamente (ma non dimensionalmente!) uguale alla massa atomica (relativa) Grammoatomo (desueto!) Massa molare di una specie atomica Grammomolecola (desueto!) Massa molare di una specie molecolare Attenzione! È molto comune parlare di peso (massa) atomico/molecolare confondendolo con la massa molare! Il peso atomico dell’azoto è 14 g ? Il peso atomico dell’azoto è 28 ? La massa molare di H2 è? 1. Quante moli di rame sono contenute in 6,2 g di Cu? 2. Quante moli di rame sono contenute in 6,2 g di solfato rameoso? 3. Calcolare la massa assoluta di 2,3 moli di HNO3 4. Calcolare la percentuale in peso di tutti gli elementi nel dicromato di potassio 5. Calcolare percentuale in peso di SO3 in H2SO4 6. Un fertilizzante azotato è venduto con un titolo del 19,2% in peso di azoto. Calcolare la percentuale di solfato di diammonio contenuto nel fertilizzante 7. Sapendo che il bicarbonato di sodio riscaldato si dissocia in carbonato di sodio, anidride carbonica e acqua, si calcoli in tal caso la perdita percentuale in peso del sale Soluzioni … Soluzioni 1. 2. 3. 4. 5. 6. 7. 0,098 mol 0,039 mol 145 g %K = 26,5 81,6% 90,56% 36,9% %Cr = 35,4 %O = 38,1
Scaricare