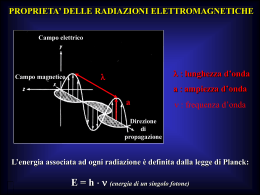
TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tutte quelle tecniche basate sull’interazione tra la materia e le radiazioni elettromagnetiche. La luce, il calore ed altre radiazioni elettromagnetiche sono vibrazioni di campi magnetici ed elettrici che si propagano nello spazio. Ogni radiazione, o onda elettromagnetica, è caratterizzata dai parametri: Frequenza (n) il numero di vibrazioni nell'unità di tempo Lunghezza d'onda (l) distanza tra due punti adiacenti in fase (ad esempio tra due massimi consecutivi) Velocità di propagazione(c) dipende dal mezzo in cui si propaga la radiazione. La relazione che lega questi parametri è: l = c/n E’ utile anche considerare queste radiazioni elettromagnetiche come un treno di particelle chiamate fotoni o quanti. La l di una radiazione elettromagnetica è in relazione con l’energia contenuta in un quanto mediante la relazione E=hn h costante di Planck = 6.63x10-34 Joule●sec ENERGIA E FREQUENZA SONO DIRETTAMENTE PROPORZIONALI Un fascio di luce è più o meno intenso a seconda che porti più o meno fotoni nell'unità di tempo, ma l'energia di ciascun fotone (il quanto di energia), è sempre la stessa per una determinata frequenza della radiazione. La frequenza è inversamente proprorzionale alla lunghezza d’onda Tipi di radiazione elettromagnetica Esistono quindi vari tipi di radiazione elettromagnetica, che differiscono per la loro lunghezza d'onda (e di conseguenza per la loro frequenza ed energia) L'analisi spettrofotometrica consiste in misurazione di radiazioni elettromagnetiche per ottenere informazioni sia qualitative che quantitative: ogni sostanza assorbe o emette radiazioni di lunghezza d'onda ben determinata – l'analisi dello spettro permette allora di individuare la natura della sostanza in esame – la misura dell'intensità delle radiazioni emesse o assorbite permette di risalire alla quantità di sostanza analizzata. PRINCIPIO Atomi o molecole, trovandosi in campi energetici possono assorbire quantità definite e caratteristiche di energia • quando atomi o molecole vengono eccitati da adatte radiazioni elettromagnetiche (“hν”), passando a stati energetici maggiori, si ha il fenomeno di ASSORBIMENTO • quando dagli stati eccitati, ritornano allo stato fondamentale, gli atomi e le molecole emettono quanti di energia sotto forma di radiazioni elettromagnetiche (“ hν ”) si ha il fenomeno di EMISSIONE (FLUORESCENZA) In genere per l’assorbimento nell’UV e nel Visibile (l=200–700 nm) sono interessati, nelle transizioni energetiche, gli elettroni esterni della molecola assorbente sia impegnati che non impegnati in un legame. La parte della sostanza assorbente chiamata cromoforo interessata a tali transizioni è generalmente costituita da anelli eterociclici aromatici, doppi legami coniugati, ponti disolfuri e gruppi chimici funzionali come COOH, NH2. Analisi qualitativa: spettro di assorbimento DEF: curva ottenuta congiungendo i valori di assorbimento presi in funzione della lunghezza d’onda in un certo intervallo di lunghezze d’onda. Ogni sostanza assorbente ha un suo caratteristico spettro utile alla identificazione di tale sostanza nel campione in esame. L’unicità dello spettro consiste nella presenza di caratteristici picchi di assorbimento a determinate lunghezze d’onda non riscontrabili negli spettri di altre sostanze assorbenti. Un esempio è lo spettro del coenzima NAD+ •NADH ha due picchi, 260 e 340 nm •NAD+ ha un solo picco, 260 nm Citocromi: REAZIONI DI TRASFERIMENTO REVERSIBILE MONOELETTRONICHE (Fe3+Fe2+) cit. b l ≃560nm Legame covalente (ponti tioeteri) cit. c l ≃550nm l ≃605nm cit. a Analisi quantitativa Le determinazioni quantitative sono basate sul fatto che, quando una radiazione attraversa intensamente a una seconda soluzione, della viene assorbita concentrazione; l'assorbimento dipende dalla concentrazione. I0 l’intensità della radiazione incidente I l’intensità della radiazione trasmessa. Definiamo Trasmittanza T = I/I0 in più altre o meno parole Trasmittanza : 0 ≤ T ≤ 1 T = 1 la radiazione è completamente trasmessa I0 = I T = 0 la radiazione è completamente assorbita I = 0 T = 10 –elc = I/I0 log I/I0= -ecl Definendo A (Assorbanza)= log I0/I A = ecl Legge di Lambert Beer C = concentrazione della soluzione o specie chimica in esame (moli/litro) l = cammino ottico (ovvero spessore dello strato attraversato dalla radiazione incidente) e = coefficiente di estinzione molare (ovvero l’assorbimento che subisce un raggio di luce monocromatica nell’attraversare una soluzione a concentrazione unitaria e cammino ottico di 1 cm) L’assorbanza è direttamente proporzionale alla concentrazione del campione: mettendo in grafico l’A in funzione di c avremo una retta passante per l’origine degli assi. Se l= 1 cm la pendenza della retta data da A/c = e fornisce il valore del coefficiente di estinzione molare alla l considerata A e c Secondo la legge di Lambert – Beer, più elevata è la concentrazione delle molecole che passano dallo stato fondamentale a quello eccitato, maggiore sarà l’assorbanza (maggiore sarà la diminuzione dell’intensità del raggio incidente). Validità della legge di Lambert-Beer: • la luce incidente e’ monocromatica • l’assorbimento del solvente e’ trascurabile • la concentrazione del campione e’ contenuta entro limiti adatti • non si verificano reazioni chimiche delle molecole del campione fra loro o con il solvente STRUMENTAZIONE: Spettrofotometro I componenti essenziali sono: • Sorgente di luce policromatica (tungsteno per il visibile, deuterio per l’UV) • Fessura d’ingresso-lente (per minimizzare la luce diffusa e rendere paralleli i raggi della sorgente) • Filtro o monocromatore (per selezionare una banda di l definita) • Fessura d’uscita • Cella o cuvetta • Fotomoltiplicatori (trasforma il segnale luminoso in impulso elettrico) Esistono diversi tipi di spettrofotometro, a seconda di come sono organizzati i vari componenti: •SPETTROFOTOMETRI MONORAGGIO •SPETTROFOTOMETRI A DOPPIO RAGGIO •SPETTROFOTOMETRI A DOPPIA LUNGHEZZA D’ONDA Spettrofotometro a singolo raggio Questo strumento lavora ad una singola lunghezza d’onda selezionata; è utilizzato normalmente per effettuare analisi che prevedono misure ad una sola lunghezza d’onda e per soluzioni con un solo analita. Spettrofotometro a doppio raggio E’ presente un componente che sdoppia il raggio: è possibile avere il confronto simultaneo tra l’assorbimento della cuvetta contenente il campione e la cuvetta di riferimento. E’ possibile effettuare misure direttamente a qualsiasi l senza ripetere azzeramenti, e soprattutto registrare continuativamente lo spettro. Spettrofotometro a doppia lunghezza d’onda Elimina l’assorbimento aspecifico ed è possibile registrare spettri differenziali per la possibilità di utilizzare due lunghezze d’onda, una di riferimento, l’altra di misura. APPLICAZIONI DELLA SPETTROFOTOMETRIA • analisi qualitativa: spettro d’assorbimento • analisi quantitativa diretta per sostanze che assorbono ad una data lunghezza d’onda, tipo le proteine il cui assorbimento a 280 nm si basa principalmente sul suo contenuto di tirosina e triptofano • analisi quantitativa indiretta tramite reazione colorimetrica; molte sostanze possono reagire con altre a dare un prodotto colorato. Si misura l’estinzione dei campioni rispetto a quella di un bianco che contiene tutti i reagenti tranne la sostanza da determinare • attività e cinetica enzimatica: si misura la velocità di comparsa o scomparsa di una sostanza con un picco caratteristico di assorbimento che partecipi come substrato o come prodotto alla reazione enzimatica in esame Analisi quantitativa indiretta •Metodo Bradford Questo metodo è semplice, rapido, economico e sensibile. Esso si basa sull'azione del Coomassie brilliant blue G-250 che si lega specificatamente a residui di arginina, triptofano, tirosina, istidina e fenilalanina. Si lega a questi residui in una forma anionica, con assorbanza massima a 595 nm. •Metodo del Biureto il reattivo del biureto consiste in una soluzione alcalina di solfato di rame contenente tartrato di sodio e potassio. Gli ioni rameici formano un complesso di coordinazione con 4 gruppi NH2 ed ha un picco di assorbimento a 540 nm. Entrambi i metodi necessitano del valore di concentrazione di una proteina di riferimento, l’albumina dosata a 280nm (analisi diretta) Dosaggio enzimatico 1.Dosare la quantità di un substrato che prende parte ad una reazione catalizzata da un enzima 2.Dosare l’attività di un enzima, cioè la velocità di una reazione catalizzata da un enzima • Enzimi plasmatici a scopo diagnostico: un dosaggio degli enzimi nel plasma può essere utilizzato per diagnosticare il danno di un tessuto od organo particolarmente ricco in alcuni enzimi e l’entità del rilascio enzimatico fornirà un indice del grado del danno cellulare. • carenze/difetti enzimatici responsabili di sindromi biochimiche Come si misura l’attività di un enzima ? Si misura la variazione nel tempo di una qualsiasi grandezza correlata alla concentrazione del substrato o del prodotto. Velocità di reazione: quantità di substrato trasformato nel tempo v = - d [S] / dt = d [P] / dt DO = elc c = DO/el v = dc/dt v = 1 dDO/dt el La misura della variazione di DO nel tempo è la misura della velocità di reazione. Quando si vuole misurare la velocità di una reazione enzimatica si misura la variazione di DO nel tratto iniziale : in questo intervallo il reagente si trasforma in prodotto alla massima velocità dopodichè la velocità diminuisce man mano che si instaura l’equilibrio. In quali condizioni fare i dosaggi? Vi = Vmax [S] / [S] + Km se [S] > > Km Vi = Vmax Per valutare l’attività di un enzima si lavora in eccesso di substrato (condizioni di Vmax ) Dosaggio dell’ attività enzimatica (metodo diretto) Un esempio è il dosaggio della lattico deidrogenasi che catalizza la reazione: Per dosare l’attività della LDH si misura la velocità iniziale della reazione catalizzata dall’enzima per concentrazioni di piruvato (substrato) saturanti. Dosaggio dell’attività enzimatica (metodo indiretto) Un esempio è dato dalla reazione catalizzata dalla PK Si aggiunge un enzima ausiliario (LDH) e il NADH LDH Piruvato + NADH + H+ <=> Lattato + NAD+ Si segue la scomparsa del NADH a 340 nm • il parametro da misurare deve essere limitante • tutti i substrati devono saturare l’enzima Dosaggio dell’attività enzimatica (metodo indiretto) Un esempio è dato dalla reazione catalizzata dalla GOT (glutammico ossalacetico transaminasi (GOT) Malato DH Dosaggio enzimatico del substrato Possiamo risalire al numero di moli di piruvato che vengono trasformate in lattato calcolando le moli di NADH ossidate, tenendo presente che esiste un rapporto stechiometrico 1:1 fra substrato e coenzima. DA = Af-Ai • • DA=elDC DC=DA/el enzimi ed eventuali substrati devono essere in eccesso il substrato da dosare deve essere limitante Elettrodo per ossigeno di Clark Misura l’ossigeno in una soluzione usando il principio polarografico, cioè monitorando la corrente che passa fra due elettrodi quando si applica un voltaggio. La porzione superiore di tale elettrodo è costituita da una camera di reazione termostatata in cui si posiziona il campione di cui si vuole conoscere la tensione di ossigeno La porzione inferiore è rappresentata dalla camera degli elettrodi, in cui si verificano reazioni di ossido-riduzione I due compartimenti sono separati da una membrana di teflon che da una parte, permette all’ossigeno di diffondere verso la camera degli elettrodi La camera degli elettrodi comprende un catodo di platino e un anodo d’argento, entrambi immersi nella stessa soluzione satura di cloruro di potassio (KCl). Quando viene applicata tra gli elettrodi una differenza di potenziale di circa 0.6 volt, all’anodo si verifica la seguente reazione di ossidazione: 4Ag + 4Cl- 4AgCl + 4e- Gli elettroni generati sono impiegati per ridurre al catodo l’ossigeno che diffonde attraverso la membrana, formando acqua: O2 + 4H+ + 4e- 2H2O La corrente prodotta dall’elettrodo è proporzionale alla tensione dell’ossigeno nel campione: tale valore può essere così amplificato e registrato attraverso un tracciato continuo. Il consumo di ossigeno in vitro dipende da vari fattori: •Disponibilità di ossigeno •Disponibilità di substrati ossidabili •Presenza di inibitori della catena respiratoria Il consumo di ossigeno in vitro permette di: •Valutare l’ICR (indice di controllo respiratorio) •Misurare il PO (efficienza di fosforilazione ossidativa) •Studiare gli effetti degli inibitori ICR = v st3/v st4 mito P/O = nmoli ATP prodotto / natomi di O2 consumati substrato ADP mM O2 Stato 3 Stato 4 ADP O2 consumato oligomicina DNP Tempo(min) Mit Pir/Mal Rot Succ Ant.A Asc/TMPD [O2] KCN tempo Succinato Piruvato/Malato Rotenone CII Antimicina A Cianuro NADH CI Q10 CIV CIII Cit.c Ascorbato/TMPD O2 cells DNP dig Pir/Mal Rot [O2] Succ Ant.A Asc/TMPD KCN tempo
Scarica