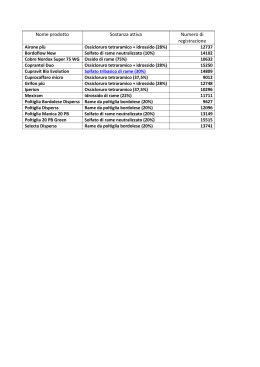
Sperimentazione Le trasformazioni chimiche • I.Comprensivo “F.Guglielmino”-Acicatena • Anno scolastico 2010-2011 • Classe II sezione “C” La classe in laboratorio Esperienza N°1 Idrossido + Acido = Sale + H o 2 I reagenti ACIDO CLORIDRICO IDROSSIDO DI SODIO 1-L’idrossido di sodio (NaOH), sciolto in acqua, viene versato in un becher 2- Viene aggiunto acido cloridrico(HCl),che innesta la reazione chimica, sotto forma di vapore e calore(reazione esotermica) 3-dopo un po’ se osserviamo sul fondo si viene a depositare il sale. Esperienza N°2 ACETO + BICARBONATO DI SODIO porta alla formazione di ANIDRIDE CARBONICA (gas che provoca il gonfiarsi del palloncino) • • • • • Materiale occorrente: Aceto Bicarbonato di sodio Palloncino Imbuto 1-Mettere un po’ di aceto in bottiglia 2-Con un imbuto mettere il bicarbonato nel palloncino Si continua l’operazione.. 3-capovolgere il palloncino sul collo della bottiglia, facendo attenzione che non fuoriesca il bicarbonato. 4-il bicarbonato con l’aceto formerà anidride carbonica CO2 ,gas che provocherà il gonfiarsi del palloncino. L’esperimento è riuscito! Esperienza N° 3 Reazione di sostituzione: CuSO4 (solfato di rame) + Fe (ferro-chiodi) =Fe SO4 (solfato di ferro + Cu (rame) 1-Il solfato di rame , diluito, va messo in un becher , 2- successivamente vanno messi i chiodi 3-Il colore del solfato di rame (CuSO4 ) inizialmente azzurro, con i chiodi , ferro, tende a cambiare Il giorno successivo , oltre al diverso colore del solfato di rame, si può osservare che i chiodi sono ricoperti di una “patina” di solfato. delle sostanze • Il pH indica il grado di acidità o basicità di una sostanza, rispetto a una scala di valori che va da 0 a 14. Per la misura del pH si utilizza l’indicatore universale;ma possono essere utilizzati anche altri indicatori ottenuti dal cavolo, dal geranio rosso ecc... Esperienza N° 4 A confronto provette contenenti lo stesso materiale ma diverso indicatore Indicatore vegetale(cavolo rosso) Indicatore universale :cartina tornasole In ultimo vengono rilevati registrati ed interpretati gli avvenuti viraggi di colore delle sostanze in esame.
Scaricare