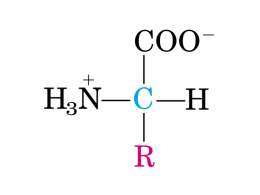
Proteine e Amminoacidi Proteine e Amminoacidi Lezione 1 Domanda! Che trasformazione avviene quando cuociamo un uovo al tegamino? Prova tu a rispondere e poi continua a leggere…. Proteine e amminoacidi Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina Le proteine sono macromolecole biologiche costituite da catene di amminoacidi. Amminoacido (unità base) Esistono decine di migliaia di differenti proteine Proteina Catena polipeptidica 20 amminoacidi che possono concatenarsi in ordine diverso Una o più catene polipeptidiche formano Gli amminoacidi Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina Gli amminoacidi essenziali sono 20, si trovano in tutte le cellule e formano le proteine. Struttura generale di un amminoacido: H PARTE FISSA (comune a tutti gli amminoacidi) H GRUPPO AMMINICO O N H C GRUPPO CARBOSSILICO C CARBONIO α OH R GRUPPO VARIABILE Determina le proprietà chimico fisiche Alcuni amminoacidi Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina H H H H O N C N C C H C H O OH OH H HC CH3 OH GLICINA TREONINA LISINA Emoglobina Classificazione degli amminoacidi Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina La classificazione degli amminoacidi avviene in base al gruppo variabile Amminoacidi con gruppi R. apolari 1. 2. 3. 4. 5. 6. 7. 8. 9. Amminoacidi con Glicina Alanina Valina Leucina Isoleucina Metionina Fenilanina Triptofano Prolina gruppi 1. 2. 3. 4. 5. 6. Amminoacidi con R. polari non carichi Serina Treonina Asparagina Glutammina Tirosina Cisteina R gruppi R. polari e carichi 1. 2. 3. 4. 5. Lisina Arginina Istidina Acido Aspartico Acido Glutamminico Legame peptidico Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina Gli amminoacidi si legano tra loro attraverso un legame peptidico. REAZIONE DI CONDENSAZIONE Amminoacidi Dipeptide Il carbonio del gruppo carbossilico si lega all’azoto del gruppo amminico e si libera una molecola d’acqua. Catena Polipeptidica Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina Tramite altre reazioni di condensazione si possono legare più amminoacidi formando una Catena polipeptidica (o polipeptide) Una catena polipeptidica può essere formata da 2-3 amminoacidi fino a centinaia di amminoacidi. Idrolisi Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina Il processo inverso alla condensazione è l’IDROLISI e permette di scindere, per effetto dell’acqua, una catena polipeptidica nei suoi amminoacidi. PROCESSO DI IDROLISI Dipeptide Amminoacidi Le proteine Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina Le proteine sono macromolecole formate da una o più catene polipeptidiche. Queste catene possono assumere differenti disposizioni spaziali che dipendono dalla sequenza di amminoacidi da cui sono formate. Esistono migliaia di differenti proteine. La funzione di una proteina dipende dalla sua struttura tridimensionale. Struttura primaria Introduzione Amminoacidi Legame peptidico Classificazione Proteine Classificazione Struttura Albumina Emoglobina La struttura primaria consiste nella sequenza di amminoacidi da cui è costituita la catena polipeptidica. Lys Hys Gly Leu Val Gly Lys Ala hys Lys Leu Ala Val Gly Lys Ogni cambiamento della struttura primaria può influenzare la struttura globale della proteina e la sua funzionalità. Struttura secondaria Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina La struttura secondaria consiste nella forma che assume la catena polipeptidica ripiegandosi su se stessa. ALFA ELICA LAMINE BETA (FOGLIO RIPIEGATO) Miosina (nei muscoli) Fibroina (nella seta e nella tela di ragno) Gli amminoacidi presenti in punti diversi della catena si uniscono tra loro formando legami a idrogeno. Struttura terziaria Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina La struttura terziaria è data da un ulteriore ripiegamento della molecola che dà origine all’aspetto globulare della proteina. Formazione di legami a idrogeno o di altro tipo tra i gruppi R di amminoacidi posti in posizioni diverse della catena polipeptidica. La struttura terziaria è direttamente legata alla funzione della proteina. Esempio: Le proteine globulari presenti in soluzioni acquose si avvolgono in modo da avere gruppi R idrofili rivolti verso la parte esterna della proteina e quindi a contatto con l’acqua. Struttura quaternaria Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina La struttura quaternaria è formata dall’unione di più molecole proteiche con una struttura terziaria (subunità). Le subunità che formano la stuttura possono essere identiche oppure di tipi diversi (come avviene nell’emoglobina). Struttura Introduzione Amminoacidi Lys Hys Gly Leu Val Gly Lys Ala Legame peptidico Classificazione hys Lys Leu Ala Val Lys Gly Proteine Struttura Classificazione Albumina Emoglobina STRUTTURA PRIMARIA STRUTTURA SECONDARIA STRUTTURA TERZIARIA STRUTTURA QUATERNARIA Classificazione delle proteine Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina Le proteine vengono classificate in base alla loro funzione in 7 classi: CLASSE FUNZIONE ESEMPI 1 STRUTTURALI Materiali per costruire ogni struttura Fibre dei tendini e dei legamenti, tela del ragno, albumina, …. 2 CONTRATTILI Permettono i movimenti muscolari Actina e Miosina (nei muscoli) 3 DI RISERVA Funzione energetica, scorta di nutrienti essenziali Ovalbumina (nell’albume dell’uovo): riserva di amminoacidi per l’embrione 4 DI DIFESA Difesa degli organismi da agenti esterni Anticorpi: difendono dalle infezioni 5 DI TRASPORTO Trasporto di elementi essenziali Emoglobina: trasporto dell’ossigeno 6 SEGNALE Messaggeri tra cellule per coordinare le attività corporee Ormoni 7 ENZIMI Catalizzatori chimici (aumentano la velocità di una reazione chimica) Idrolasi: catalizza reazioni di idrolisi Curiosità: l’ALBUMINA Introduzione Amminoacidi Classificazione Legame peptidico Che trasformazione avviene quando cuociamo un uovo al tegamino? Proteine Struttura Classificazione Albumina Emoglobina La struttura di una proteina può cambiare anche a causa di fattori chimici o fisici DENATURAZIONE: deformazione della struttura terziaria per rottura dei legami tra amminoacidi situati in posizioni diverse della catena polipeptidica. Nella cottura di un uovo l’alta temperatura causa la denaturazione dell’albumina rendendola non più solubile. Non viene compromessa la struttura primaria ma la molecola perde la sua funzione. Esempio di proteina: l’ EMOGLOBINA Introduzione Amminoacidi Classificazione Legame peptidico Proteine Struttura Classificazione Albumina Emoglobina L’emoglobina è una proteina globulare che si trova nei globuli rossi del sangue. La sua funzione è di trasporto dell’ossigeno dai polmoni alle altre parti del corpo. ANEMIA FALCIFORME Malattia causata dalla sostituzione di un amminoacido con un altro nella struttura primaria dell’emoglobina. Le molecole di emoglobulina risultano con una conformazione diversa e indurite I globuli rossi assumono una forma a falce anziché tonda e, ostacolandosi a vicenda, si creano accumuli nei vasi capillari. Proteine e Amminoacidi ESERCIZI Proteine e Amminoacidi Completa l’immagine con le seguenti parole CARBONIO α GRUPPO CARBOSSILICO PARTE FISSA GRUPPO VARIABILE GRUPPO AMMINICO H ………………. H O N ……………….. C …………………. C H OH ………………… R ………………. Soluzione Proteine e Amminoacidi Collega ogni struttura con la relativa immagine e descrizione: Struttura primaria Primo ripiegamento della catena polipeptidica Struttura secondaria Struttura terziaria Struttura quaternaria Unione di più subunità Ulteriore ripiegamento della catena polipeptidica Sequenza di amminoacidi Soluzione Proteine e Amminoacidi Collega ogni tipo di proteina con la sua funzione e il relativo esempio: Classe di proteine CONTRATTILI DI RISERVA Funzione Esempio Trasporto di elementi essenziali albumina Permettono i movimenti muscolari Ovalbumina Anticorpi ENZIMI Messaggeri tra cellule STRUTTURALI Difesa degli organismi da agenti esterni Miosina Ormoni SEGNALE Funzione energetica DI TRASPORTO Emoglobina Materiali per costruire i tessuti DI DIFESA Catalizzatori chimici Idrolasi Soluzione STRUTTURALI Materiali per costruire i tessuti CONTRATTILI Permettono i movimenti muscolari DI RISERVA Funzione energetica DI DIFESA Difesa degli organismi da agenti esterni Anticorpi DI TRASPORTO Trasporto di elementi essenziali Emoglobina SEGNALE Messaggeri tra cellule ENZIMI Catalizzatori chimici albumina Miosina Ovalbumina Ormoni Idrolasi Proteine e Amminoacidi Indica se ogni affermazione è vera (V) o falsa (F): Una catena polipeptidica è formata da una sequenza di proteine □V □F Esistono migliaia di tipi di amminoacidi che formano le proteine □V □F La denaturazione è un processo che causa l’alterazione della struttura terziaria di una proteina □V □F La denaturazione causa non causa cambiamenti nella funzionalità della proteina □V □F Una proteina può essere costituita da più catene polipeptidiche diverse tra loro □V □F L’α-elica è un tipo di struttura quaternaria delle proteine □V □F Un cambiamento nella struttura primaria di una proteina può influenzare la sua funzionalità □V □F Il processo di idrolisi, per scindere i legami peptidici, necessita di H2O □V □F Il legame peptidico si instaura tra i gruppi carbossilici di due amminoacidi □V □F La classificazione degli amminoacidi avviene in base al gruppo amminico □V □F Soluzione Una catena polipeptidica è formata da una sequenza di proteine □V □F Esistono migliaia di tipi di amminoacidi che formano le proteine □V □F La denaturazione è un processo che causa l’alterazione della struttura terziaria di una proteina □V □F La denaturazione causa non causa cambiamenti nella funzionalità della proteina □V □F Una proteina può essere costituita da più catene polipeptidiche diverse tra loro □V □F L’α-elica è un tipo di struttura quaternaria delle proteine □V □F Un cambiamento nella struttura primaria di una proteina può influenzare la sua funzionalità □V □F Il processo di idrolisi, per scindere i legami peptidici, necessita di H2O □V □F Il legame peptidico si instaura tra i gruppi carbossilici di due amminoacidi □V □F La classificazione degli amminoacidi avviene in base al gruppo amminico □V □F Proteine e Amminoacidi Individua la risposta corretta: Le proprietà chimiche e fisiche di un amminoacido dipendono A) B) C) D) dal gruppo carbossilico dal gruppo amminico dal gruppo variabile da tutti e 3 i gruppi L’emoglobina è A) un amminoacido strutturale B) un amminoacido di trasporto C) una proteina strutturale D) una proteina di trasporto L’anemia falciforme è una malattia causata da una anomalia A) B) C) D) nella struttura primaria nella struttura secondaria nella struttura terziaria nella struttura quaternaria Soluzione Le proprietà chimiche e fisiche di un amminoacido dipendono A) B) C) D) dal gruppo carbossilico dal gruppo amminico dal gruppo variabile da tutti e 3 i gruppi L’emoglobina è A) B) C) D) un amminoacido strutturale un amminoacido di trasporto una proteina strutturale una proteina di trasporto L’anemia falciforme è una malattia causata da una anomalia A) B) C) D) nella struttura primaria nella struttura secondaria nella struttura terziaria nella struttura quaternaria
Scarica