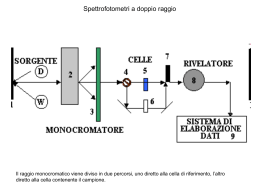
Spettroscopia atomica e molecolare La spettroscopia utilizza le radiazioni elettromagnetiche (raggi , raggi X, UV, visibile, IR, microonde e radiofrequenze) per: • studiare la stuttura elettronica degli atomi e delle molecole; • per eseguire determinazioni quantitative (misurare la concentrazione) di specifiche molecole o ioni; La spettroscopia sfrutta l’interazione tra radiazione elettromagnetica e la materia. Cos’e’ la radiazione elettromagnetica? • La radiazione elettromagnetica è una forma di energia che si propaga anche nel vuoto, cioè non richiede mezzo di supporto per la sua trasmissione – La velocità della radiazione (c) ~ 3 x 1010 cm/sec = 3 x 108 m/sec • La radiazione elettromagnetica è rappresentata da un campo elettrico e un campo magnetico perpendicolari tra loro. Caratteristiche della radiazione elettromagnetica • La radiazione elettromagnetica si comporta come un’ onda sinusoidale (modello classico). • La radiazione elettromagnetica è anche particella (modello copuscolare). Parametri di un’onda • Lunghezza d’onda (l) distanza lineare tra due massimi successivi di un’onda • Ampiezza distanza verticale tra un massimo e l’asse delle x • Frequenza (v) numero di oscillazioni del campo in 1 secondo (Hz = 1 ciclo/s) Caratteristiche di un’onda • In un mezzo contenente materia, la radiazione si propaga ad una velocità minore di c (v) perché il campo elettromagnetico della radiazione, interagendo con gli elettroni degli atomi o molecole del mezzo, si propaga meno rapidamente. • La frequenza di un’onda è fissata dalla sua sorgente, non cambia quando l’onda passa da un mezzo ad un altro. v = lv = c/n Dove n è l’indice di rifrazione del mezzo nvuoto = 1 naira = 1.0003 (varia = 0.9997c) nvetro ~1.5 (vvetro ~ 0.67c) • Dal momento che è fissata, al diminuire di l, anche v deve diminuire Il numero d'onda, è definito come il numero di onde per centimetro, ed è uguale a 1/l. Per definizione, ha le unità di cm-1. Proprietà delle particelle di radiazione elettromagnetica • L’energia di un fotone dipende dalla frequenza (v) della radiazione Efotone = hv hc E h hc l h = costante di Planck h = 6.63 x 10-34 Jxs Relazione tra onda e particella Efotone = hv ; = c l n Efotone = hc ln vmedia = lv = c/n Relazione tra onda e particella • Esempio: Quale è l’energia di un fotone a 500 nm ? = c/l = (3 x 108 m s-1)/(5.0 x 10-7 m) = 6 x 1014 s-1 E = h =(6.626 x 10-34 J•s)(6 x 1014 s-1)= 4 x 10-19 J 8 ASSORBIMENTO Se una particella ha livelli di energia potenziale E0, E1, E2 ecc., ed i fotoni hanno una frequenza Efotone1 = hv1 = E1 – E0, oppure Efotone2 = hv2 = E2 – E0, ecc., un elettrone della particella può essere eccitato dal livello fondamentale E0 al livello eccitato E1 o E2, rispettivamente. Efotone1 = hv1 = E1 – E0 Efotone2 = hv2 = E2 – E0 La particella eccitata si diseccita normalmente per decadimento termico, trasferendo l'eccesso di energia attraverso collisioni con altre particelle: in tal caso il decadimento è un processo non radiativo. Spettro elettromagnetico Spettro elettromagnetico e radiazioni del visibile. Il tipo di perturbazione dell’analita dipende dalla energia della radiazione perturbante. Una radiazione UV può provocare transizioni degli elettroni di valenza e di legame, non una fotoemissione degli elettroni dei livelli molecolari interni. Si ricordi che, per quanto possa essere intensa, una radiazione IR non è utile per eseguire una radiografia. Intensità ed energia sono quantità differenti. Caratteristiche dell’ assorbimento • Assorbimento: processo in cui il fotone promuove l’eccitazione dell’elettrone • Implica transizioni da uno stato “fondamentale” di energia ad uno “eccitato” M + h → M* • Coinvolge quantità discrete di energia: Efotone = ΔE transizione energetica • Distinguiamo due tipi di assorbimento: – Atomico – Molecolare Assorbimento Molecolare • Più complesso dell’assorbimento atomico perchè in una molecola bisogna considerare: – Transizioni elettroniche – Transizioni vibrazionali – Transizioni rotazionali • Emolecola = Eelettronica + Evibrazionale + Erotazionale – Eelettronica > Evibrazionale > Erotazionale • Risultato: spettri complessi 16 Livelli energetici possibili per un atomo. E2 E2 Livelli energetici possibili per una molecola E1 E1 UV-VIS UV-VIS E E v2 v1 Ad ogni livello elettronico possono essere associati più livelli vibrazionali e ad ognuno di questi più livelli rotazionali. IR r2 r1 r0 E0 v0 E0 In spettroscopia atomica l’analita è presente sotto forma di nube atomica. Essendo impossibili vibrazioni e rotazioni, lo spettro atomico è a righe, non a bande (una banda è l’inviluppo di numerosissime righe). 17 Consideriamo l’ idrogeno, l’atomo più semplice. • Ogni atomo ha un numero limitato di livelli energetici discreti. • Pertanto, solo i fotoni di una certa energia possono interagire con gli elettroni in un dato atomo. Spettri atomici Ogni atomo ha uno specifico set di livelli energetici, e pertanto solo certi fotoni con opportuna l possono essere assorbiti. Spettroscopia di assorbimento molecolare di assorbimento UV-VIS Questa spettroscopia si occupa delle transizioni fra diversi stati elettronici della molecola. Queste transizioni sono generalmente accompagnate a transizioni sia vibrazionali che rotazionali, per cui gli assorbimenti sono costituiti da moltissime righe molto vicine tra loro, tanto da apparire un continuo, cioè una banda. La “struttura fine” dovuta alle transizioni rotazionali e vibrazionali non è generalmente rilevabile, se non nel caso di spettri elettronici di gas rarefatti eseguiti con spettrografi ad alta risoluzione. Spettri atomici – a righe, e spettri molecolari - a bande Spettro di assorbimento di atomi di silicio nell’intervallo 250 – 253 nm. Spettro di assorbimento del permanganato nell’intervallo 450 – 650 nm. 21 ASSORBANZA L’assorbanza è il logaritmo negativo della trasmittanza A = - log(T) Secondo la legge di LAMBERT–BEER l’assorbanza A è proporzionale sia alla concentrazione della sostanza assorbente, sia allo spessore dello strato attraversato, per cui più elevata è la concentrazione delle molecole che passano dallo stato fondamentale a quello eccitato, maggiore sarà l’assorbanza (maggiore sarà la diminuzione dell’intensità del raggio incidente). A = bc Legge di Lambert-Beer A =bc A è privo di dimensioni = coefficiente di estinzione molare (se C=M) L mol-1 cm-1 b = lunghezza del cammino della radiazione incidente cm c = concentrazione molare mol L-1 Equazione di una retta con coefficiente angolare pari a b. Se il cammino ottico è di 1 cm, il coefficiente angolare della retta diviene pari a . SORGENTE È la parte dell’apparecchio da cui prende origine la radiazione policromatica (contenenti cioè tutte le lunghezze d'onda del campo richiesto) che viene diretta sul campione. Negli strumenti che utilizzano la luce visibile e l’ultravioletta, sono presenti due diverse lampade, in modo che la sorgente copra l’intervallo da 190 – 800 nm: -per la regione del visibile si utilizzano lampade a incandescenza a filamento di tungsteno, lampade quarzo-iodio o lampade tungsteno-alogeno) -per la regione UV si usano lampade a scarica in un gas (deuterio o a idrogeno); sono costituite da un'ampolla di quarzo contenente il gas rarefatto (ma non troppo) nella quale viene attivata, tra due elettrodi, una scarica elettrica con la conseguente emissione di radiazioni con spettro continuo. Gli SPETTROFOTOMETRI UV-VISIBILE avranno quindi al loro interno queste due lampade, che vengono opportunamente intercambiate dal meccanismo interno. Il valore di “cambio – lampada” è in genere intorno a 350 nm. La lampada a Deuterio D2 Segnale in uscita da una fenditura Stringendo la fenditura diminuisce l’ampiezza di banda ma diminuisce anche la potenza radiante. I filtri permettono una selezione limitata di lunghezze d’onda e forniscono bande passanti generalmente più large di quelle di prismi e monocromatori. Essi sono usati nei fotometri (strumenti di bassa qualità). 30 Filtri •Sono il più semplice tipo di selettore di λ •Sono progettati per selezionare (trasmettere) un intervallo di lunghezze d’onda il più stretto possibile Sono di due tipi: • filtri ad assorbimento • filtri interferenziali Prismi Si basano sul fatto che l’indice di rifrazione di un materiale è funzione della lunghezza d’onda e quindi diverse lunghezze d’onda verranno rifratte con diversi angoli. • I materiali più usati sono: Visibile - vetro o quarzo UV - silice fusa o quarzo IR - NaCl, KCl • Attualmente i prismi sono per lo più stati soppiantati dai reticoli di interferenza PRISMI Gli angoli i ed r tra i raggi e la normale sono definiti di incidenza e di rifrazione. Dato che n2 dipende dalla lunghezza d’onda, nella rifrazione la luce bianca incidente si separa nelle sue componenti colorate. La radiazione rossa è la meno deviata, la violetta è la più deviata. Reticoli • Sono attualmente i più utilizzati nei monocromatori nella moderna strumentazione analitica • Consistono di solito in una superfice riflettente contenente una serie di incavi paralleli Monocromatore a reticolo di riflessione. Si ricordi che un monocromatore è l’insieme di un prima (o di un reticolo) e delle fenditure di ingresso e di uscita. 39 CELLA Le pareti della cuvetta devono essere trasparenti per consentire il passaggio della luce che viene fatta passare attraverso le pareti lisce. In questa cuvetta viene inserito il campione (in soluzione) da esaminare. Poiché il vetro non è trasparente alla radiazione ultravioletta (UV), per quest’ultima si usa la cuvetta al quarzo. ♦ in UV si utilizzano celle in quarzo (SiO2) ♦ nel VISIBILE in vetro o quarzo o alcuni materiali plastici. ♦ in IR si rendono necessarie celle in NaCl, KBr, CaF2..... Fototubo • Si basa sull’effetto fotoelettrico: un fotone incide sul catodo rivestito di un materiale fotosensibile, provocando l’emissione di un elettrone • Si ottiene una corrente proporzionale alla intensità della radiazione incidente • I fototubi sono soggetti ad un rumore di fondo (dark current) causato da effetti termici FOTOMOLTIPLICATORE Il fotomoltiplicatore è simile al fototubo, ma molto più sensibile. Al posto dell’anodo a singolo filamento è composto di una serie di dinodi; gli e- emessi dal catodo vengono accelerati verso il primo dinodo che è a un potenziale 90-100 V più positivo del catodo. Ciascun e- colpendo il dinodo 1 produce diversi altri e- (secondari), che vengono accelerati al dinodo 2 che è a un potenziale 90-100 V più positivo del dinodo. Si ha così una amplificazione degli e- che, alla fine della catena di diodi, può arrivare ad un fattore nel range 105-107 per ogni fotone incidente sul fotocatodo. La cascata di e- è raccolta all’anodo e la corrente risultante amplificata elettronicamente e misurata. CLASSIFICAZIONE SPETTROFOTOMETRI Esistono diversi tipi di spettrofotometro, a seconda di come sono organizzate le varie componenti: ♥ SPETTROFOTOMETRI MONORAGGIO ♥ SPETTROFOTOMETRI A DOPPIO RAGGIO Gli SPETTROFOTOMETRI MONORAGGIO, sono usati prevalentemente in analisi quantitativa e non sono comodi per ottenere spettri di Assorbimento. La difficoltà sta nel fatto che per ogni misura, per ogni λ, si deve ripetere l'azzeramento contro il bianco, oppure registrare prima lo spettro del bianco, poi lo spettro del campione ed infine sottrarre al secondo il primo. Negli SPETTROFOTOMETRI A DOPPIO RAGGIO si ha invece un sistema che invia due raggi, identici per frequenza e intensità, uno attraverso il campione e l'altro attraverso il bianco, per cui si ha un confronto continuo tra l'assorbanza del campione e quella del bianco. Grazie a queste caratteristiche è possibile effettuare misure direttamente a qualsiasi λ senza ripetere azzeramenti, e soprattutto registrare continuativamente lo spettro di assorbimento. SCHEMA DI UNO STRUMENTO A SINGOLO RAGGIO IL MONOCROMATORE è una combinazione di filtri e reticoli 1) Si mette nella cuvetta il solvente e si misura l’Intensità. 2) Si lava la cuvetta. 3) Si mette la soluzione e si misura l’intensità. 4) Si fa il rapporto fra le due Intensità Converte l’Intensità della radiazione in Intensità di corrente SCHEMA DI UNO STRUMENTO A DOPPIO RAGGIO Il bianco (o riferimento) è costituito dal solvente ad eccezione della sostanza di cui si vuol esaminare l’assorbimento La radiazione proveniente dal MONOCROMATORE si divide in due raggi che sono inviati contemporaneamente al campione ed al solvente. Il secondo raggio passa attraverso il campione e fuoriesce con l’Intensità trasmessa Icampione Il computer registra entrambe in modo alterno e calcola il rapporto. Schema a blocchi e schema di uno spettrofotometro UV-VIS monoraggio Schema a blocchi e schema di uno spettrofotometro UV-VIS doppio raggio La legge di Beer è una LEGGE LIMITE. In particolari condizioni si possono osservare delle deviazioni alla relazione A=bc LIMITAZIONI REALI: Linearità rispettata solo per soluzioni diluite Effetto dell’indice di rifrazione del mezzo DEVIAZIONI CHIMICHE APPARENTI: Variazioni della forma chimica del composto (ad esempio indicatori di pH) Associazioni di varia natura della specie assorbente in funzione della composizione della soluzione È valida solo per soluzioni diluite (< 10-2 M) All'aumentare della concentrazione aumenta il numero di particelle in soluzione ed aumenta anche il numero di urti fra queste; le forze interioniche e/o intermolecolari aumentano e possono formarsi molecole o aggregati di particelle più complesse, diverse per struttura da quelle in esame, per cui si potrà avere uno spostamento del massimo di assorbimento. dipende dall’indice di rifrazione del mezzo che, per concentrazioni elevate, dipende a sua volta dalla concentrazione. Limiti strumentali Radiazione incidente non perfettamente monocromatica Radiazioni parassite che raggiungono il rivelatore A' log P0 Ps P Ps Ps = radiazione parassita non assorbita
Scaricare