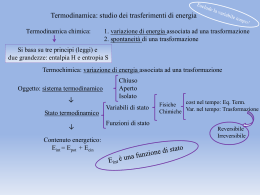
Lezione 8 Calore ed energia Calore (Q) = forma macroscopica nella quale l'energia passa da un sistema fisico ad un altro unicamente a causa di differenze di temperatura. Il calore fluisce dal corpo più caldo a quello più freddo ed essendo una forma di energia si misura in joule. C = Capacità termica cv = c a volume costante Q = C·ΔT C = m·c T2 – T1 massa calore specifico (c) c può essere cp o cv cp = c a pressione costante Caloria Quantità di calore necessaria ad elevare da 14,5 a 15,5 °C la temperatura della massa di un grammo di acqua distillata a livello del mare (pressione di 1 atm). (piccola) caloria Grande caloria = cal = 4,186 J = Cal = kcal = 4186 J Esempio: 100 g di zuccheri, se ingeriti, forniscono ~ 400 Cal 100 g di proteine, se ingerite, forniscono ~ 400 Cal 100 g di grassi, se ingeriti, forniscono ~ 900 Cal Nota: frigoria = caloria negativa Sistema termodinamico Porzione di spazio, separata dal resto dell’universo (cioè l’ambiente esterno) mediante una superficie di controllo (superficie reale o immaginaria, rigida o deformabile), sede di trasformazioni interne e scambi di materia o energia con l’ambiente esterno. sistema aperto: sistema che può scambiare con l’ambiente esterno sia energia (lavoro o calore) sia materia. sistema chiuso: sistema che può scambiare con l’ambiente esterno energia (lavoro o calore) ma non materia. sistema (dal bordo) adiabatico: sistema chiuso che può scambiare con l'ambiente esterno solo lavoro, ma non calore. sistema dal bordo rigido: sistema chiuso che può scambiare con l'ambiente esterno solo calore, ma non lavoro. sistema isolato: sistema che non interagisce in alcun modo con l'ambiente circostante, ovvero che non scambia massa, né energia (lavoro o calore). Principio 0 della termodinamica Se un corpo A è in equilibrio termico con un corpo B, e il corpo B è a sua volta in equilibrio termico con un altro corpo C, allora A è in equilibrio termico con il corpo C. Questo principio viene utilizzato per effettuare una misura della temperatura, se viene intesa come proprietà che determina se un corpo è in equilibrio termico con altri corpi oppure no. Due corpi in equilibrio termico fra loro sono alla stessa temperatura. Energia interna (U o E) In ogni sistema è contenuta una certa quantità di energia, in varie forme, che viene perciò definita energia interna del sistema. In un gas questa energia è essenzialmente l'energia cinetica totale delle molecole in movimento. Esistono due modi per modificare l'energia interna di un corpo: fornendo calore o compiendo un lavoro sul sistema. Sappiamo che l'energia interna del gas dipende dalla sua temperatura, infatti maggiore è questa e più velocemente le molecole del gas si muovono. Quando forniamo calore ad un gas vediamo che la sua temperatura aumenta, quindi aumenta anche la sua energia interna. Allo stesso modo se comprimiamo il gas, facendo quindi lavoro sul sistema, aumentiamo la sua energia interna. Da qui muove il primo principio della termodinamica, che non è altro se non una generalizzazione del principio di conservazione dell'energia per cui l'energia non si genera e non si distrugge Principio 1 della termodinamica Detto anche Legge di conservazione dell'energia esprime l’assunto fondamentale della equivalenza di calore e lavoro. Per un qualsiasi sistema ΔE = Q – L Q>0 L>0 Cioè, la variazione di energia interna E corrisponde alla differenza delle quantità di calore Q e lavoro L scambiati dal sistema con l’ambiente. L è considerato positivo quando è ceduto dal sistema all'ambiente, Q positivo quando è ceduto dall'ambiente al sistema. Nota1: Il primo principio implica l’impossibilità della esistenza del moto perpetuo di prima specie. Nota2: Per un sistema isolato l'energia è costante. L'universo è considerato un sistema isolato. Nota3: in alcuni testi il primo principio è scritto come ΔE = Q + L perché in quei casi si considera per convenzione L > 0 se L entra (invece di uscire) nel sistema. Trasformazioni notevoli per gas Trasformazione isoterma. In questo caso la temperatura del gas non varia e quindi nemmeno la sua energia interna. Possiamo quindi scrivere: ΔE = Q – L = 0 Q = L Tutto il lavoro che viene fornito al sistema si converte completamente in calore e viceversa. Trasformazione isocora. In questa trasformazione il volume resta costante, quindi il gas non compie nessun lavoro di espansione. Il primo principio diventa: L = 0 ΔE = Q Tutto il calore che viene fornito al gas va a variare la sua energia interna e quindi la sua temperatura. Viceversa se il sistema cede calore, la sua energia interna diminuisce e quindi il gas si raffredda (vedi ad es. bomba calorimetrica di Mahler). Trasformazione isobara. In questa situazione non vi è nessuna grandezza che si conservi: infatti il sistema compie o subisce lavoro, assorbe o cede calore e quindi la sua energia interna e la sua temperatura variano. In questo caso è però molto semplice calcolare il lavoro, che, come si può dimostrare, è dato dal prodotto tra la variazione di volume e la pressione (che resta costante): L = p·ΔV ΔE = Q – p·ΔV Trasformazione reversibile. È ad esempio una trasformazione isoterma e isobara ottenibile con variazioni infinitesimali di volume Q = L = p·ΔV Trasformazione adiabatica. Se il sistema è chiuso e non vi sono scambi di calore con l'esterno, si può scrivere: Q = 0 ΔE = -L Nota: la resa di una macchina termica è definita come Dove L = lavoro compiuto; Q = calore assorbito. L Q Funzioni di stato Il primo principio può essere scritto in forma differenziale: dE = δQ – δL Dove d indica un differenziale esatto mentre δ esprime un differenziale non esatto. Q ed L, infatti, non sono funzioni di stato, in quanto dipendenti dal particolare percorso compiuto nel corso della trasformazione. Una funzione di stato (o "quantità di stato") è una proprietà di un sistema che dipende solamente dallo stato iniziale e finale, e non dal particolare cammino seguito per arrivarvi. Una funzione di stato descrive perciò lo stato di equilibrio di un sistema; per esempio, l'energia interna, l'entalpia e l'entropia sono tutte "quantità di stato“. Entalpia (H) Per un sistema chiuso, è una funzione di stato definita come: H = E + p·V dove E è l'energia interna del sistema, p la sua pressione e V il suo volume. Se si deriva H e si tiene conto del 1° principio, si ottiene: dH = dE + p·dV + V·dp dH = δQ – δL + p·dV + V·dp p = costante V·dp = 0 Se il lavoro è solo quello di espansione δL = p·dV Dunque, in un sistema chiuso a pressione costante e in assenza di lavori diversi da quello di espansione (ad es. all’aria aperta): Entalpia di reazione (ΔH o ΔHr) Le variazioni di energia possono derivare solitamente da un lavoro meccanico fatto o subito dal sistema o dal calore prodotto o ceduto nel corso di una reazione chimica. Poiché le reazioni sono solitamente studiate a pressione costanti e senza lavori diversi da quelli di espansione, è comodo considerare i calori di reazione a pressione costante ovvero le entalpie di reazione. La reazione cede calore (reazione esotermica) ΔHr = Q < 0 La reazione assorbe calore (reazione endotermica) ΔHr = Q > 0 CO(g) + ½O2 CO2(g) ΔH = -283 kJ (reazione esotermica) Se viene invertita la direzione di una reazione, ΔH cambia segno: CO2(g) CO(g) + ½O2 ΔH = +283 kJ (reazione endotermica) Se l’equazione viene ad esempio moltiplicata per 2, anche il ΔH risulta moltiplicato per 2 dal momento che sono coinvolte il doppio di moli (l’entalpia, come l’energia, è una proprietà estensiva). 2CO2(g) 2CO(g) + O2 ΔH = +566 kJ Il fosforo rosso reagisce con bromo liquido secondo la reazione: 2P(s) + 3Br2(l) 2PBr3(g) ΔH = -243 kJ. Calcolare il ΔH quando 2,63 g di fosforo reagiscono con eccesso di bromo. -10,31 kJ Stati o condizioni standard Le entalpie assolute delle sostanze, così come le energie assolute, non possono essere misurate o calcolate. Si possono misurare solo le variazioni. Per far fronte a questo problema, per le sostanze chimiche, si definiscono gli stati o condizioni standard come segue: •Per i solidi e i liquidi è lo stato termodinamicamente stabile alla pressione di 1 atm e ad una temperatura di riferimento. •Per i gas è la fase gassosa con comportamento ideale alla pressione di 1 atm e ad una temperatura di riferimento. •Per le specie disciolte è una soluzione 1 M con comportamento ideale all pressione di 1 atm e ad una temperatura di riferimento. Qualsiasi temperatura può essere scelta come temperatura di riferimento. Se non specificato diversamente essa è 298,15 K (25°C). In questo caso si parla anche di STP o SATP. Nota: non confondersi con la vecchia convenzione di Temperatura e Pressione Standard (STP) per cui p = 1 atm e T = 0°C. Entalpia (molare) standard di formazione (ΔHf°) di un composto ad una certa temperatura di interesse è il cambiamento di entalpia che accompagna la formazione di 1 mole di quella sostanza dai suoi componenti elementari, al loro stato standard, cioè presi puri nella loro forma più stabile alla temperatura d'interesse e alla pressione di stato-standard, che come già detto è 1 atm (qualcuno propone 1 bar). Si ricorda che lo stato-standard termodinamico dipende dalla temperatura d'interesse la quale, se non espressa, si intende 298,15 K (25°C). La entalpia di formazione di un elemento è 0 per definizione. C(s, grafite) + O2 CO2(g) ΔHf° di CO2 = -393,5 kJ/mol Nota: le entalpie di formazione sono valori tabellati. Legge di Hess Stabilisce che in una reazione chimica il ΔH è indipendente dagli stati intermedi attraverso i quali si evolve il sistema e dipende solo dal suo stato iniziale e finale (infatti H è una funzione di stato). In altre parole: il ΔH di una reazione che può essere scomposta idealmente in più reazioni parziali è pari alla somma algebrica dei ΔH delle singole reazioni. C(s,gr.) + O2 CO2(g) 2CO2(g) 2CO(g) + O2 2C(s,gr.) + O2 2CO(g) Nota: gr. sta per grafite ΔH1 = -393,5 kJ ΔH2 = +566 kJ ΔH3 = 2ΔH1 + ΔH2 = -221 kJ Consideriamo la seguente reazione C + 2H2 ΔH4 CH4 Essa si può considerare come combinazione delle reazioni: C H2 CH4 + + + O2 ½O2 2O2 CO2 H2O CO2 + ΔH1 ΔH2 ΔH3 2H2O Infatti moltiplicate queste per opportuni coefficienti e sommate tra loro, ci restituiscono la reazione iniziale: (x 1) C (x 2) 2H2 (x -1) CO2 = C + + + O2 O2 2H2O + 2H2 CO2 2H2O CH4 + 2O2 CH4 Per la legge di Hess possiamo quindi scrivere che ΔH4 = ΔH1 + 2ΔH2 – ΔH3 ΔH1 2ΔH2 -ΔH3 ΔH4 Date tre reazioni chimiche e il loro ΔH° 1: Fe2O3 + 3CO(g) 2Fe(s) + 3CO2(g) ΔH1° =-26,7 kJ 2: 2C(s,gr.) + O2 2CO(g) ΔH2° =-221,0 kJ 3: C(s,gr.) + O2 CO2(g) ΔH3° = -393,5 kJ calcolare il ΔH4° della seguente reazione: 4: 4Fe(s) + 3O2(g) 2Fe2O3(s) - 1644,6 kJ Entalpia standard di reazione (ΔHr°) Per una certa temperatura di interesse è il cambiamento di entalpia che accompagna la formazione dei prodotti a partire dai reagenti presi al loro stato standard. La seguente relazione deriva dalla legge di Hess. H i H r f i i = coefficiente stechiometrico del composto i i = prodotto i > 0 i = reagente i < 0 La stessa relazione può essere scritta come: (n = coefficiente stechiometrico) H n prodotti H r f ( prodotti) nreagenti H f ( reagentii) Nota: Reagenti e prodotti devono essere alla stessa temperatura. Se così non fossero bisognerebbe usare la legge di Kirchhoff. Energia (interna molare) standard di formazione (ΔEf°) o di reazione (ΔEr°) Valgono le stesse considerazioni fatte per definire ΔHf° e ΔHr° in funzione di ΔH. Poiché in genere sono tabulate le ΔHf° invece che le ΔEf°, occorre ricordare come varia ΔE in funzione di ΔH. Nel caso (più comune) di trasformazioni isobare (solitamente 1 atm) e in assenza di lavori diversi da quello di espansione si ricorda che ΔE = Q – p·ΔV & Q = ΔH ΔE = ΔH – p·ΔV Se le trasformazioni includono dei gas ideali, in base alla legge dei gas ideali (P·V = n·R·T) si ricava facilmente che ΔE = ΔH – Δn·R·T Sarà quindi, ad esempio: ΔEf° = ΔHf° – Δn·R·T Calcolare l’entalpia standard di reazione e l’energia standard di reazione dell’equilibrio di Boudouard a 25°C e 1 atm. C + CO2 2CO Calcolare il calore sviluppato nella combustione a 25°C e a P = 1 atm di 1dm3 di CH3OH (l) (densità = 0,8 g/cm3) con formazione di H2O liquida. Calcolare il calore sviluppato nella combustione a 25°C e pressione costante, di 1 m3 (misurato in condizioni normali) di una miscela gassosa di composizione percentuale in volume: CO = 70%; Ar = 20%; N2 = 10% 172,5 kJ; 170,0 kJ 18,16 MJ 8,84 kJ
Scaricare