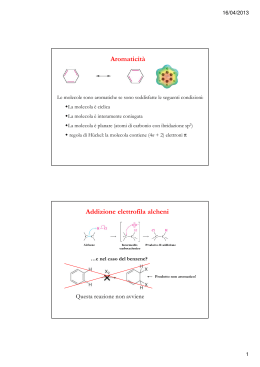
Chimica Organica II Formule di risonanza Come individuarle: ● Le formule di risonanza devono rispettare le regole delle strutture di Lewis ● La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte disponendo gli elettroni di valenza in modi diversi) ● Tutte le formule canoniche devono avere lo stesso numero di elettroni spaiati Come valutarne l’importanza: ● Le strutture con un numero maggiore di legami covalenti sono più stabili ● Le strutture con il maggior numero di atomi con 8 elettroni sono più stabili ● La stabilità è diminuita dall’aumento della separazione di carica (se vi sono più di due cariche la struttura è molto poco stabile, peggio ancora se vi sono due cariche uguali adiacenti) ● Strutture con cariche negative su atomi più elettronegativi sono più stabili di quelle con cariche negative su atomi meno elettronegativi. ● Strutture con angoli o lunghezze di legame distorte sono meno stabili. ● La presenza di due o più forme di risonanza identiche indica un’extra-stabilizzazione della molecola Chimica Organica II Formule di risonanza: a cosa servono • Stimare acidità legami X-H • Individuare siti acidi e basici di Lewis (elettrofili e nucleofili) Vacanze elettroniche OH O OH pKa ~ 16 O H C HH pKa ~ 5 C H C HH pKa = 20 Chimica Organica II Formule di risonanza O NH NH 3 O H O NH 3 veloce H2O OH NH 2 lenta H2O O OH O O diversi OH OH O N NH O NH 3 OH O Nu? Chimica Organica II Composti Aromatici: Benzene C6H6 (1825) (1865) Friedrich August Kekulé Chimica Organica II Composti Aromatici: formule di risonanza (Kekulè) ... ... ... (Dewar) Chimica Organica II Composti Aromatici: Benzene Distanza di legame C-C: 1.40 A (C-C: 1.48 A, C=C: 1.32 A) La reattività del benzene è differente (e molto più bassa) dalla reattività tipica delle olefine, anche se coniugate Br Br Br Br2 Br Br Br r Br (con catalizzatore) Chimica Organica II Composti Aromatici: Benzene, energia di coniugazione ∆H = -119.5 KJ/mol (-119.2 x 3 = -357.6) ∆H = -208.2 KJ/mol -357.6 KJ/mol – (-208.2 KJ/mol) = -149.4 KJ/mol ENERGIA DI CONIUGAZIONE Chimica Organica II Composti Aromatici: Benzene, orbitali molecolari 6 orbitali atomici p Orbitale π a più bassa energia Chimica Organica II Composti Aromatici: 4n+2 elettroni Anelli a 7 atomi: cicloeptatriene Ione tropilio Anione cicloeptatrienilico Altri anelli: NH Catione ciclopropenilico Ciclobutadiene (4e, antiaromatico) N N HN Porfina (18e) Azulene (µ = 0.8 D) Chimica Organica II Composti Aromatici: 6 elettroni Anelli a 6 atomi: N benzene antracene piridina Anelli a 5 atomi: N N H S O N H pirrolo tiofene furano imidazolo pKa (cp) ~ 16 ciclopentadiene Ciclopentadienil carbanione Chimica Organica II Composti Aromatici: 4n+2 elettroni E Ione tropilio Anione cicloeptatrienilico Chimica Organica II Reattività del benzene δH H H H H H δ+ Chimica Organica II Reattività del benzene a) Addizione: A Perde l’energia di A B B coniugazione b) β eliminazione: A -A B B Orbitale π instabile (poca sovrapposizione) Chimica Organica II Reattività del benzene c) Sostituzione: X Y Nessuna alterazione del sistema aromatico! Chimica Organica II Reattività del benzene a1) Sostituzione nucleofila (SN2): Il gruppo uscente porta via un doppietto elettronico da un atomo di C sp2 Y X Y Il nucleofilo attacca un centro ricco di elettroni a2) Sostituzione nucleofila (SN1): X Carbocatione molto instabile Y Chimica Organica II Reattività del benzene a3) Sostituzione radicalica H X Y X Y Radicale instabile a4) Sostituzione elettrofila: Y X Un elettrofilo attacca un centro ricco di elettroni Y Chimica Organica II Sostituzione elettrofila aromatica W Y X Perdita dell’energia di coniugazione W Y X Y X Y Il gruppo uscente lascia gli elettroni del legame Y Carbocatione stabilizzato per risonanza Y X X Chimica Organica II Sostituzione vs addizione ‡ ‡ ‡ H H G° A H B A H B A AB HB Coordinata di reazione Chimica Organica II Sostituzione elettrofila aromatica: reazioni 1) Alogenazione Br2 FeBr3 Br FeBr4 Br H Br H Br B 1) NBS 2) X2 3) X2 / FeX3, AlX3 X = Cl, Br, I Chimica Organica II Sostituzione elettrofila aromatica: reazioni 2) Nitrazione 2 HNO3 NO2+ H2O NO3 O N O NO2 H H NO2 B 1) HNO3 2) HNO3/H2SO4 3) HNO3 fumante / H2SO4 Chimica Organica II Sostituzione elettrofila aromatica: reazioni 3) Solfonazione SO3 2 H2SO4 O H HSO4 HSO3+ O O S H3 O + SO3 H SO3 B Reazione reversibile! 1) H2SO4 2) H2SO4/SO3fumante SO3H HB B Chimica Organica II Sostituzione elettrofila aromatica: reazioni 3) Alchilazione/Acilazione di Friedl-Craft RCl, RCOCl AlCl3 R , RCO FeBr4 R H R R H B 1) RCl, MXn 2) ROH, H2SO4 3) R-CH=CH2, H2SO4 ● La reazione non va in sistemi aromatici disattivati ● Nel caso delle acilazioni bisogna usare più di un equivalente di AlCl3 Chimica Organica II Sostituzione elettrofila aromatica: reazioni 3) Alchilazione/Acilazione di Friedl-Craft CH3CH2CH2CH2Cl H3C CH3CH2CHCl CH3 CH3 CH3 CH3 CH3CCl CH3 O CH3CH2CH2CCl Trasposizione carbocationi alchilici! Polisostituzione (il prodotto è più reattivo del reagente) AlCl3 O C CH2CH2CH3 Zn/HCl CH2CH2CH2CH3 Chimica Organica II Sostituzione elettrofila aromatica: attivazione e disattivazione Il fenolo reagisce con il Br2 senza catalizzatori, si forma il prodotto di trisostituzione e solo nelle posizioni orto e para: il gruppo OH è attivante e orientante Chimica Organica II Controllo cinetico A B Y X A B A Y X B Y X ‡ ‡ ‡ G° ‡ Coordinata di reazione Se i sostituenti stabilizzano la carica positiva, si abbassa l’energia dell’intermedio catione arenio e di conseguenza aumenta la reattività. Chimica Organica II Sostituzione elettrofila aromatica: attivazione e disattivazione HNO3 NO2 HNO3 NO2 a) Effetto induttivo (elettronegatività): I + NR3 -I Krel = 1 Krel = 23 Chimica Organica II Sostituzione elettrofila aromatica: attivazione e disattivazione b) Effetto di risonanza : R NR2 NR2 +R Chimica Organica II Sostituzione elettrofila aromatica: attivazione e disattivazione b) Effetto di risonanza : R +R 4000 volte più veloce del benzene Coniugazione σ Chimica Organica II Sostituzione elettrofila aromatica: attivazione e disattivazione b) Effetto di risonanza : -R -R La seconda reazione è molto più lenta della prima Chimica Organica II Sostituzione elettrofila aromatica: attivazione e orientazione Orto-para orientanti Meta orientanti Attivanti Disattivanti Potenti -NR2 (+R), -OH (-I, +R), -O- (+I, +R) -CF3, -NR3+ (-I) Intermedi -OR, -NHCOR (-I, +R) -CN, -SO3H, -NO2 (-R,-I) Deboli -R (+I, +R), -Ph (+R) -CHO, -COR, -COOR (-R,-I) Disattivanti -F, -Cl, -Br, -I (-I, +R) Cl Cl Y Alogeni (-I, +R): X Y X Chimica Organica II Sostituzione elettrofila aromatica: orientazione A A A Y X Y X A Y X X A Y X Y X X A Y X Y Y X A A Y X Y X A A Y A Chimica Organica II Sostituzione elettrofila aromatica: attivazione e disattivazione A B Y X A B A Y X B Y X Normalmente le reazioni di sostituzione elettrofila aromatica sono sotto controllo cinetico: si ottiene il prodotto che si forma più velocemente, non il più stabile. Sostituenti che stabilizzano la carica positiva stabilizzano l’intermedio (ione arenio) e quindi lo stato di transizione: aumenta la velocità della reazione Sostituenti che destabilizzano la carica positiva destabilizzano l’intermedio (ione arenio) e quindi lo stato di transizione: diminuisce la velocità della reazione L’effetto è maggiore nelle posizioni 2,4 (orto e para). I gruppi attivanti (che stabilizzano la carica positiva) sono orto-para orientanti, i gruppi disattivanti (che destabilizzano la carica positiva) sono meta orientanti. Chimica Organica II Sostituzione elettrofila aromatica: orientazione NO2 CH3 CH3 CH3 NO2 9 Il gruppo attivante prevale sul disattivante. 9 L’attivante forte prevale sull’attivante debole. 9 Bisogna tener conto degli effetti sterici. OCH3
Scaricare