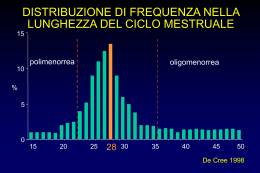
della fatti, notizie e opinioni I S S A MS e ndrologia edicina essualità A M Periodico Ufficiale della SIAMS • Società Italiana di andrologia e Medicina della sessualità Progetto “Sezioni Regionali” Cari Colleghi della SIAMS Uno dei maggiori compiti delle Società Scientifiche Mediche è quello di promuovere innovazione e formazione nelle specifiche discipline, al fine di favorire l’assistenza sanitaria e migliorare la qualità della vita. Nello specifico dell’Andrologia e Medicina della Sessualità questo compito non è facilmente raggiungibile senza permeare la tela sociale ove le necessità e le patologie si articolano, si sviluppano e prendono precipue dignità nosografiche. È per questo che da alcuni anni la nostra Società ha deciso di articolarsi in snelle strutture regionali, che ho avuto il piacere e l’onore di coordinare, su mandato del Consiglio Direttivo. Lo scopo delle Sezioni Regionali della nostra Società è stato da una parte quello di intercettare le esigenze locali e di riportarle verso il Consiglio Direttivo, e, dall’altro, di tradurne la filosofia nei “dialetti” locali, con adeguate forme e idonee logistiche. Lo spunto è nato dalla osservazione e dalla recente sistematizzazione di nuove forme nosografiche, ben note a noi specialisti ma del tutto ignorate dalla Autorità Sanitarie in termini di assistenza intesa a più livelli. L’esempio più eclatante, e che ha costruito il “traino” per quelli successivi, è stato quello del progetto “Ipogonadismo Maschile”, progetto varato a Firenze nel Giugno 2005, insieme all’allora Presidente SIAM (ora divenuta SIAMS) Mario Serio e all’amico Mario Maggi, e con il mio coordinamento davanti a tutti i Responsabili Regionali della nostra Società, presenti in gran numero. Si decise allora di incidere concretamente su questa negletta patologia, chiarendo l’incertezza che ne circondava la stessa definizione e l’iter diagnostico, ora sistematizzati in linee-guida internazionali, e stabilendo di ringiovanirne le opportunità, favorendo la fruizione rimborsabile da parte del Sistema Sanitario Regionale e/o Nazionale delle nuove opportunità terapeutiche. Così come, del resto, da tempo avviene per la controparte femminile, che gode di relativa assistenza per analoga patologia (si pensi alla terapia sostitutiva ormonale in menopausa!). In questo campo abbiamo incontrato il supporto di numerose Industrie che hanno parzialmente finanziato, e perciò reso possibile, il progetto. La relativa strategia si è articolata in periodici e successivi incontri che io stesso, in qualità di Coordinatore delle Sezioni Regionali, insieme al Prof. Mario Serio e con la fattiva partecipazione logistica dei Proff. Maggi e Jannini, abbiamo avuto con i Rappresentanti Regionali SIAM e – di volta in volta – con le Autorità sanitarie delle singole Regioni (Assessori alla Sanità, ecc). Anno 2 • n. 2 • Gennaio 2007 Consiglio Direttivo Presidente: M. Motta Presidente eletto: A. Lenzi Segretario: E.A. Jannini Tesoriere: S. Francavilla Consiglieri G. balercia d. canale c. carani m. de rosa a. fabbri g. forti l. gandini a. garolla l. gnessi a.a. sinisi e. vicari Commissione Scientifica C. foresta (Presidente) a. calogero a. filippini f. francavilla c. krausz a. lenzi m. maggi m. maggiolini m.c. meriggiola p. negri-cesi d. pasquali Direttore Responsabile paolo E. Zoncada Registrazione Tribunale di Milano in corso Editore Edizioni Internazionali srl Div. EDIMES Via Riviera, 39 - 27100 Pavia Tel. 0382.526253 - Fax 0382.423120 E-mail: [email protected] Realizzato con il contributo di A tutti costoro è stata consegnata una informativa relativa alla “indispensabilità del rimborso del trattamento farmacologico sostitutivo con testosterone- gel nel paziente maschio affetto da ipogonadismo, uno specchio aggiornato della incidenza – per singola Regione – delle patologie ricompresse nel termine “ipogonadismo”, le relative linee-guida internazionali e- last but not leastcopia della Delibera della Giunta Regionale della Regione Toscana che per prima, in data 29-5-2006 ha autorizzato tale tipo di trattamento, costituendo quindi la “base legale” per le successive richieste. I risultati concreti di questa non sempre facile azione, di cui ringrazio tutti i Rappresentanti Regionali sono stati molto soddisfacenti. Già alcuni milioni di italiani possono usufruire della rimborsabilità totale delle preparazioni transdermiche di testosterone, sotto forma di gel, in varie regioni fra cui la Toscana, le Marche e il Piemonte. In altre realtà regionali, quali il Triveneto o la Campania, il processo è molto avanzato. Molto spesso le Associazioni dei Pazienti (quali l’ANIPI) hanno fiancheggiato la SIAMS in questa campagna di sensibilizzazione degli organi regionali. Alcune iniziative locali SIAMS si sono già svolte (Viareggio 2005, Ancona, 2006), e altre sono in preparazione, per garantire una completa formazione agli operatori che erogheranno queste formulazioni sul territorio regionale, e per stimolare analoghe iniziative nelle altre Regioni. Credo che questo tragitto appena iniziato debba proseguire, nell’interesse prioritario dei pazienti e, se vogliamo, anche della Endocrinologia Italiana che si propone pioneristicamente in questo campo. Aldo Isidori Coordinatore delle Sezioni Regionali n. 2 - Gennaio 2007 Comitato editoriale CoordinatORE Prof. Marcella Motta Istituto di Endocrinologia Università degli Studi di Milano Via Balzaretti, 9 - 20133 Milano Tel. 02/50318242/3 Fax 02/50318204 [email protected] Dott. Massimo Bocchio Cattedra di Andrologia Unità complessa di Andrologia Medica Università degli Studi dell’Aquila 67100 L’Aquila Tel. 0862/368338 Fax 0862/368342 [email protected] Prof. Nunziatina Burrello Sezione di Endocrinologia, Andrologia e Medicina Interna, Dip. di Scienze Biomediche, Università di Catania, Ospedale Garibaldi Piazza S. Maria di Gesù 95123 Catania Tel. 095/7592056 Fax 095/310899 [email protected] Dott. Eleonora Carosa Corso Monografico di Sessuologia Medica Dip. di Medicina Sperimentale Università degli Studi dell’Aquila Coppito, 2 - Stanza A2/54 67100 L’Aquila Tel. 0862/433530 Fax 0862/433523 [email protected] Prof. Paolo Chieffi Dip. di Medicina Sperimentale, II Università di Napoli, Via Costantinopoli, 16 80138 Napoli Tel. 338/4967648 [email protected] Prof. Luigi Di Luigi Unità di Endocrinologia, Istituto Universitario di Scienze Motorie Piazza Lauro de Bosis, 15 00194 Roma Tel/Fax 06/36733231 [email protected] Dott. Alberto Ferlin Dip. di Istologia, Microbiologia e Biotecnologie Mediche Centro per la Crioconservazione dei Gameti Maschili, Università di Padova 35128 Padova Tel. 049/8212639 [email protected] Prof. Felice Francavilla Cattedra di Endocrinologia Dip. di Medicina Interna Università degli Studi dell’Aquila 67100 L’Aquila Tel. 0862/368338 - 0862/368339 Fax 0862/368342 cell 3335763040 [email protected] Dott. Andrea M. Isidori Dip. di Fisiopatologia Medica Università degli Studi di Roma “La Sapienza” Policlinico Umberto I 00161 Roma Tel. 06/49970540 [email protected] Prof. Patrizia Limonta Istituto di Endocrinologia Università degli Studi di Milano Via Balzaretti, 9 20133 Milano Tel. 02/50318213 Fax 02/50318204 [email protected] Prof. Michaela Luconi Dip. di Fisiopatologia Clinica Unità di Andrologia Università di Firenze V.le G. Pieraccini, 6 50139 Firenze [email protected] Dott. Paolo Sgrò Dip. di Fisiopatologia Medica Università degli Studi di Roma “La Sapienza” Policlinico Umberto I 00161 Roma Tel. 06/4469663 Fax 06/49970717 [email protected] Dott. Elena Vicini Dip. di Istologia ed Embriologia Medica Università di Roma “La Sapienza” Via A. Scarpa, 14 00161 Roma Tel. 06/49766803 Fax 06/4462854 [email protected] ANDROLOGIA e medicina della sessualità Opinioni del clinico Anche in Italia il nuovo testosterone undecanoato iniettabile long-acting (NEBID) de ad aumentare oltre il 52%, va ridotto il dosaggio allungando gli intervalli della somministrazione e interrotto il trattamento se l’ematocrito non si abbassa. In definitiva, per la sua lunga durata d’azione associata al mantenimento di livelli ematici costanti di testosterone, Nebid offre peculiari vantaggi rispetto alle altre preparazioni di testosterone e appare particolarmente adatto per il trattamento degli ipogonadici specie non anziani, sui quali peraltro è stato più ampiamente sperimentato. È auspicabile che sia questa nuova formulazione di Testosterone long acting, sia il testosterone gel, che rappresentano entrambi un notevole progresso nel trattamento sostitutivo androgenico, possano nel prossimo futuro essere erogabili in fascia A dal Sistema Sanitario Nazionale. Felice Francavilla I S nmol/L l’intervallo tra le somministrazioni può essere accorciato fino a 10 settimane, se i livelli sono > 15 nmol/L, l’intervallo può essere allungato fino a 14 settimane. Il preparato va iniettato profondamente nel muscolo gluteo e lentamente (non meno di 1 minuto) a paziente disteso. Non ci sono specifiche condizioni per la conservazione del farmaco. Studi di confronto tra testosterone undecanoato (1 grammo im ogni 12 settimane) e testosterone enantato (250 mg im ogni 3 settimane) hanno mostrato equivalente efficacia e sicurezza, con il vantaggio tuttavia, per il testosterone undecanoato, dell’assenza dei sintomi legati alle fluttuazioni dei livelli di testosterone riferiti abitualmente dai pazienti in trattamento con testosterone enantato. Pertanto, le controindicazioni, le precauzioni ed il monitoraggio dei pazienti rimangono gli stessi che per il testosterone enantato e per le altre modalità di trattamento sostitutivo androgenico. In particolare, il PSA, come pure il volume prostatico, aumentano durante il trattamento, soprattutto nel primo anno pur mantenendosi nel range di normalità. Il controllo del PSA deve essere almeno annuale e l’ aumento deve tuttavia essere inferiore a 0,5 ng/anno nei primi 3 anni di terapia sostitutiva e > 0,2-0,3 ng negli anni successivi di trattamento. Incrementi maggiori, come pure il rilievo di noduli prostatici all’esplorazione rettale richiedono l’esecuzione di una biopsia. La concentrazione di emoglobina e l’ematocrito aumentano durante il primo anno di trattamento per poi stabilizzarsi. Se l’ematocrito ten- S Sebbene la terapia sostitutiva con preparazioni di testosterone nell’ipogonadismo maschile sia stata introdotta in clinica da oltre mezzo secolo, negli ultimi anni l’industria farmaceutica ha prodotto e commercializzato nuove formulazioni che hanno ampliato le opzioni terapeutiche tra cui scegliere quella più idonea sulla base delle caratteristiche e le esigenze dei singoli pazienti. Dopo le preparazioni di testosterone gel, che applicate giornalmente mantengono costanti i livelli ematici di testosterone, obiettivo non raggiungibile con le precedenti formulazioni iniettabili e orali, di recente è stata commercializzata in diversi paesi europei e a breve anche in Italia, un nuovo preparato iniettabile long-acting di testosterone undecanoato (Nebid, Schering AG). La forma iniettabile per via intramuscolare di testosterone undecanoato in olio di ricino è stata originariamente ottenuta e sperimentata in Cina su pazienti con S. di Klinefelter. Successivamente essa è stata sperimentata in Germania prima nelle scimmie e successivamente in soggetti ipogonadici. La formulazione commercializzata è una soluzione oleosa di 4 mL contenente 1 grammo di testosterone undecanoato. Dopo una dose di attacco di 2 iniezioni a distanza di 6 settimane, i livelli di testosterone rimangono costanti nel range eugonadico per circa 12 settimane. Pertanto con tale intervallo vanno somministrate le dosi successive. Tuttavia, poiché ci può essere una certa variabilità inter-individuale nella risposta, se i livelli ematici raggiunti dal testosterone sono < 10 A M n. 2 - Gennaio 2007 Notizie Identificazione di un riarrangiamento cromosomico ricorrente nel tumore prostatico: fusione del gene TMPRSS2 con oncogeni della famiglia ETS Recurrent fusion of TMPRSS2 and ETS transcription factor genes in prostate cancer Tomlins et al., Science 310: 644-648, 2005 L’identificazione di alterazioni geniche che siano responsabili dello sviluppo dei tumori è uno dei principali scopi della ricerca oncologica. Riarrangiamenti cromosomici ricorrenti sono stati finora ben caratterizzati nei tumori ematologici e mesenchimali, ma non nei carcinomi epiteliali, quale il tumore della prostata. Utilizzando un approccio bioinformatico (COPA, cancer outlier profile analysis) applicato a dati di microarrays eseguiti su campioni di tumore prostatico, Tomlins e collaboratori hanno evidenziato come ‘outliers’ i geni di due fattori di trascrizione appartenenti alla famiglia ETS, ERG ed ETV1 (fattori noti per essere coinvolti nelle traslocazioni oncogeniche del sarcoma di Ewing e delle leucemie mieloidi). I due geni risultavano iperespressi, in modo esclusivo (o l’uno o l’altro, mai entrambi) in tutti i modelli sperimentali utilizzati: campioni bioptici di tessuto prostatico, metastasi linfonodali di pazienti affetti da tumore, linee cellulari di carcinoma prostatico. Queste osservazioni hanno portato gli autori ad ipotizzare che l’iperespressione di ERG e di ETV1 potesse essere correlata ad un processo di traslocazione genica. A conferma di questa ipotesi, Tomlins e collaboratori hanno identificato un prodotto di fusione genica tra la regione 5’ non tradotta del gene TMPRSS2 ed i geni ERG ed ETV1. Il promotore di TMPRSS2 è stato precedentemente dimostrato contenere elementi responsivi agli androgeni (androgen response elements). I geni ottenuti da questa fusione (TMPRSS2:ERG e TMPRSS2:ETV1) sono stati identificati in modo specifico in tessuti tumorali prostatici ma non in campioni di iperplasia prostatica benigna. Ad ulteriore conferma dei risultati discussi in questo lavoro, Tomlins e collaboratori hanno recentemente riportato la presenza di un gene di Un nuovo approccio per risolvere i problemi etici legati alla derivazione di cellule staminali embrionali? Human embryonic stem cell lines derived from single blastomeres nature 444:481-485, 2006 Irina Limanskaya, Young Chung, Sandy Becker, Shi-Jaing Lu and Robert Lanza Advanced Cell Technology, 381 Plantation Street, Worcester, Massachusetts 01605, USA Questa lettera apparsa come online publication su Nature del 23 Agosto 2006, ha suscitato numerose polemiche, in particolare, poiché da tale versione sembrava che gli autori avessero derivato cellule embrionali staminali dal blastomero recuperato da embrioni umani a 8-10 settimane, lasciando poi sviluppare in coltura gli embrioni da cui era stata effettuata la biopsia. La lettera corredata di un addendum chiarificatore degli autori (Nature 444:512, 2006) e di un ancor più interessante editoriale di Joe Leigh Simpson (Nature 444:432, 2006) è stampata tre mesi dopo sul numero di Nature del 23 Novembre 2006. fusione TMPRSS2:ETV4 in alcuni casi (anche se rari) di tumore della prostata (Tomlins et al., Cancer Res. 66: 3396-3400, 2006). Secondo gli autori, data l’elevata incidenza del tumore prostatico, la fusione di TMPRSS2 con membri della famiglia di oncogeni ETS rappresenta probabilmente il riarrangiamento più comune fino ad ora identificato nei tumori umani e l’unico riarrangiamento genico presente nella maggioranza di uno dei carcinomi più frequenti. Questi risultati potrebbero avere importanti implicazioni sia nella diagnosi molecolare che nel trattamento del carcinoma della prostata. Patrizia Limonta Uno dei traguardi della medicina rigenerativa è rappresentato dalla possibilità di riparare tessuti e organi danneggiati attraverso l’uso di cellule staminali. Tuttavia, l’origine delle cellule staminali, da adulto o da embrione, crea numerosi problemi etici e biomedici, oltre che condizionare la potenzialità di tali cellule e le metodiche di impianto. L’approccio di Klimanskaya et al, offre una possibile scappatoia all’obiezione che la creazione di cellule staminali embrionali (hES) implichi la distruzione dell’embrione da cui tali cellule sono state prelevate. Infatti, l’utilizzo di un solo blastomero prelevato da embrioni allo stato di 8 cellule per derivare le hES, permetterebbe di associare la metodica alla ormai consolidata tecnica di diagnosi genetica pre-impianto (PGD), utilizzata all’estero per la ricerca di anomalie genetiche nell’embrione generato in vitro da tecniche di procreazione medicalmente assistita (PMA). Nel presente lavoro, gli autori hanno separato i blastomeri derivanti da embrioni umani congelati ottenuti in vitro allo stadio di 8 cellule utilizzando tecniche di micromanipo- ANDROLOGIA e medicina della sessualità lazione impiegate nella PGD. I blastomeri disgregati sono stati coltivati insieme nello stesso medium senza però essere in contatto diretto ed in presenza di cellule feeder. Circa la metà si sono divisi e questi sono stati ulteriormente coltivati generando una linea di cellule ES. Di 91 blastomeri ottenuti dai 16 embrioni, 19 hanno dato crescita di tipo ES originando infine solo 2 linee stabili di cellule ES. Dei 16 embrioni usati, solo 6 erano di grado I e II (cioè divisione simmetrica priva di frammentazione citoplasmatica) ed hanno dato i risultati migliori. A differenza del precedente lavoro condotto sul topo, in cui il blastomero espiantato da embrione a 8 cellule era stato fatto crescere in presenza dell’embrione a 7 cellule, che poi era stato re-impiantato in utero, nel lavoro sull’uomo, l’em- brione è stato totalmente disgregato in singoli blastomeri poi coltivati insieme per generare le colture ES. Ciò ha generato la confusione e le polemiche seguite all’apparizione on line del lavoro. Le due linee di cellule hES derivate, si sono mantenute indifferenziate e proliferanti per circa 8 mesi. Presentavano inoltre cariotipo normale e l’espressione di marcatori di pluripotenza quali Oct-4, SSEA-3, SSEA-4 TRA-1-60, TRA-1-81, nanog e la fosfatasi alcalina. Tali cellule, opportunamente coltivate, hanno originato corpi embrioidi da cui derivavano i tre foglietti embrionali endoderma, mesoderma ed ectoderma. Inoltre, se iniettati in topi NOD-SCID, originavano teratomi contenenti tessuti dai tre foglietti embrionali, confermando così, la potenziale pluripotenza di tali linee. La tecnica applicata all’uomo, permetterebbe di espiantare un blastomero e lasciar poi sviluppare l’embrione a 7 cellule restante per re-impiantarlo, senza doverlo distruggere, come accade attualmente nella generazione di cellule ES dalla inner mass (ICM) dalla blastocisti (uno stadio più avanzato dello sviluppo embrionale, corrispondente circa al 5°-6° giorno dalla fertilizzazione). Si otterrebbe così una banca di cellule ES che potrebbero servire per effettuare una terapia cellulare all’individuo stesso in età adulta, oppure, tanto più ampia fosse la banca, questa permetterebbe di creare una riserva di cellule ES attraverso opportuna tipizzazione, compatibili immunologicamente con una larga parte della popolazione. Il problema principale rimane quello di permettere al blastomero prele- Congressi 2007 XXII Convegno Medicina della Riproduzione – Simposio AGEO – Convegno SIFR 22-24 Febbraio - Abano Terme (Padova) [email protected] www.unipd.it/esterni/wwwccgm Society for Endocrinology Annual BES Meeting 2007 5-8 Marzo - Birmingham ICC, UK E-mail: [email protected] www.endocrinology.org/SFE/confs. htm#26bes www.fertility.org.uk/meetings/ forthcoming.html 18th Congress of the World Association for Sexual Health – 1st World Congress for Sexual Health 15-19 Aprile - Sydney, Australia [email protected] www.sexo-sydney-2007.com ASA 32nd Annual Conference 18-24 Aprile - Tampa, Florida www.tamparegency.hyatt.com The 2nd World Congress on Gender-Specific Medicine 8-11 Marzo - Roma [email protected] www.gendermedicine.com 9th European Congress of Endocrinology 28 Aprile-2 Maggio Budapest, Hungary [email protected] International Symposium on Cancer & Reproduction 25-27 Marzo - Valencia, Spain [email protected] www.fundacioncac.es/eng/fundacion/ catedra/catedra/jsp IFFS 2007 - 19th World Congress on Fertility and Sterility 30 Aprile-5 Maggio Durban, South Africa [email protected] www.iffs-reproduction.org/ Joint Fertility Societies Meeting 15-18 Aprile - York, UK [email protected] ENDO 2007 2-5 Giugno - Toronto, Canada www.endo-society.org/endo The 10th International Pituitary Congress 5-7 Giugno - Chicago, USA [email protected] 32° Congresso Nazionale della Società Italiana di Endocrinologia 20-23 Giugno - Verona 23rd Annual Meeting of the European Society of Human Reproduction and Embryology (ESHRE 2007) 1-4 Luglio - Lione, Francia [email protected] - www.eshre.com 40th Annual Meeting of the Society for the Study of Reproduction 21-25 Luglio - San Antonio, Texas, USA [email protected] - www.ssr.org American Society for Reproductive Medicine 63rd Annual Meeting 13-17 Ottobre - Washington DC, USA www.asrm.org/Professionals/Meetings/ annualmeeting.html 57th Annual Meeting of the American Society of Human Genetics 23–27 Ottobre - San Diego, California [email protected] www.ashg.org/genetics/ashg/menuannmeet.shtml vato di dividersi in vitro generando due blastomeri da destinare rispettivamente all’analisi genetica pre-impianto ed allo sviluppo di cellule ES. Infatti, mentre la biopsia di un blastomero non sembra compromettere il successivo sviluppo normale dell’embrione, la rimozione di due blastomeri (uno per derivare cellule ES e l’altro per l’analisi genetica) costituirebbe sicuramente un trauma, suggerendo quindi che possa essere espiantato senza danni solo un blastomero. I risultati degli autori non sembrano molto incoraggianti, dato che riportano una divisone solo nella metà dei blastomeri prelevati (58%). Inoltre, dato che solo un blastomero verrebbe prelevato, ciò comporterebbe la sua co-cultura con l’embrione da re-impiantare, fino ad ottenerne la divisione. Tale procedura, allungando il tempo di coltura in vitro dell’embrione da re-impiantare, potrebbe generare dei disordini di imprinting e rendere l’embrione maggiormente soggetto a tutti i problemi legati alla manipolazione in vitro. La possibilità di creare cellule ES da blastomero con tecniche di PGD, non intaccando lo sviluppo normale dell’embrione da cui è stato effettuato il prelievo, rappresenta attualmente l’unica alternativa alle creazione di cellule hES derivate da ICM. Nonostante attualmente quest’ultima procedura abbia suscitato divieti di tipo etico, tuttavia resta ad oggi l’unica via concreta per generare cellule hES. E se la terapia rigenerativa con l’utilizzo di cellule staminali embrionali avrà successo, presto verrà meno la controversia sull’origine di tali cellule da embrioni che verranno distrutti. Il rapido successo di una procedura considerata inizialmente discutibile, ha spesso generato una rapida accettazione di questa. È avvenuto così per la diagnosi genetica prenatale negli anni ’60, per la IVF negli anni ’70 e per la PGD negli anni ’90. Michaela Luconi n. 2 - Gennaio 2007 L’FSH stimola il riassorbimento osseo ed è causa della osteoporosi che si associa alla menopausa e all’ipogonadismo FSH directly regulates bone mass. Sun L., Peng Y, Sharrow AC et al. Cell 125:247-260, 2006 É noto che l’osteoporosi rappresenta una malattia molto frequente in postmenopausa causata da un’alterazione della bilancia tra attività di formazione ossea osteoblastica e di riassorbimento osseo osteoclastico. Il trattamento sostitutivo estrogenico rallenta la perdita ossea e riduce il rischio di fratture mediante un’azione inibitoria sull’attività osteoclastica. Tuttavia il fenotipo osteoporosi non è dovuto esclusivamente alla riduzione dell’attività estrogenica come risulta per esempio dai modelli murini con assenza dei recettori estrogenici alfa o beta che mostrano solo una lieve osteoporosi. D’altro canto i livelli circolanti di FSH correlano meglio con i marcatori di turnover osseo e con i miglioramenti durante terapia estrogenica. L’ipotesi di partenza di questi Autori è stata quindi quella che gli aumentati livelli di FSH che si osservano in menopausa e in condizioni di ipogonadismo possano giocare un ruolo importante e diretto sul metabolismo osseo. A questo scopo hanno studiato diversi modelli animali e studi in vitro. Topi knockout per il recettore dell’FSH non mostrano nessun segno clinico o biochimico di osteoporosi, mentre i topi eugonadici con delezione del gene dell’FSH mostrano addirittura un incremento della densità ossea. L’mRNA per il recettore dell’FSH è stato identificato negli osteoclasti e nelle cellule staminali mesenchimali ma non negli osteoblasti e in vitro l’FSH stimolava la differenziazione in senso osteoclastico dei precursori midollari. La via di segnale collegata al recettore dell’FSH negli osteoclasti coinvolge la proteina G inibitoria con riduzione di cAMP e stimolazione delle vie MEK/Erk, NF-kB e Akt. In sintesi, questo studio dimostra per la prima volta un ruolo diretto dell’FSH sul metabolismo osseo e sulla patogenesi dell’osteoporosi associata alla menopausa e all’ipogonadismo. L’FSH stimola la formazione e la funzione degli osteoclasti in vitro e in vivo e la riduzione dell’attività dell’FSH protegge dalla perdita ossea nonostante un grave ipogonadismo. L’FSH sembra essere quindi un importante ormone che stimola il riassorbimento osseo e gli elevati livelli circolanti di FSH associati all’ipogonadismo contribuiscono alla perdita ossea. D’altro canto l’abbassamento dei suoi livelli circolanti (come si osserva durante la terapia sostitutiva estrogenica) migliora il quadro osseo. Alberto Ferlin OSSO SANO OSSO OSTEOPOROTICO della dizionario andrologico nA Acrosoma: struttura posta a cappuccio sul nucleo e occupante la porzione apicale della testa dello spermatozoo. Origina dall’apparato di Golgi durante la spermatogenesi. Contiene una serie di enzimi litici che vengono liberati in seguito all’induzione della reazione acrosomiale e permettono allo spermatozoo di penetrare le glicoproteine della zona pellucida che rivestono l’oocita. Adenocarcinoma della prostata: secondo tumore più frequente negli ultracinquantenni, insorge più frequentemente nella parte periferica della prostata. Gli esami fondamentali per la sua individuazione sono l’esplorazione rettale, l’ecografia transrettale, il dosaggio del PSA e la biopsia prostatica. La terapia si basa, spesso in associazione, sull’asportazione chirurgica, terapia ormonale, radioterapia e chemioterapia. Adenoipofisi: lobo anteriore dell’ipofisi, di cui costituisce la parte più cospicua e importante. È costituita da un sistema di cordoni epiteliali separati dai sinusoidi portali; gli elementi ghiandolari si distinguono in base alla colorazione con ematosilina-eosina in cellule cromofobe, acidofile e basofile. 5-Alfa-reduttasi: enzima che catalizza la conversione del testosterone nel suo metabolita più attivo diidrotestosterone (DHT). Esistono due isoforme: la SRD5A1 è prevalentemente localizzata sul cuoio capelluto e cute, la SRD5A2 negli organi sessuali maschili inclusa la prostata. AMH (MIS): l’ormone antimulleriano (Anti Müllerian Hormone o Müllerian Inhibiting Substance) è un ormone peptidico della famiglia del TGF-beta secreto dalle cellule del Sertoli che provoca la regressione delle strutture mulleriane durante l’embriogenesi. La mancata azione di questo ormone provoca la sindrome da persistenza dei dotti mulleria- ni con utero rudimentale e criptorchidismo. Analoghi del GnRH: farmaci analoghi all’ormone ipotalamico GnRH in grado di ridurre la secrezione delle gonadotropine FSH e LH da parte dell’ipofisi per interazione con il recettore del GnRH. Gli agonisti del GnRH inizialmente stimolano la secrezione delle gonadotropine e successivamente la inibiscono a seguito della down-regolazione del recettore. Gli antagonisti bloccano la secrezione delle gonadotropine. Gli analoghi del GnRH vengono utilizzati principalmente come terapia nel tumore prostatico e nella stimolazione ovarica durante fecondazioni assistite. Androgeni: ormoni steroidei, prodotti a livello testicolare, surrenalico, ovarico e placentare, con effetti di regolazione sulla crescita corporea, sullo sviluppo e la funzione degli organi sessuali e sullo sviluppo e mantenimento dei caratteri sessuali secondari maschili. Androgenizzazione: espressione fenotipica della fisiologica attività androgenica nel maschio e del patologico eccesso di androgeni nella femmina. Andrologia: specialità medica affine alla endocrinologia che si occupa con approccio multidisciplinare della riproduzione e della sessualità maschile. Andrologo: medico che si occupa con approccio multidisciplinare della riproduzione e della sessualità maschile. Andropausa: rappresenta il periodo della vita maschile in cui si verifica una progressiva riduzione delle capacità sessuali o procreative secondo ritmi variabili da individuo a individuo. Per tale motivo non è un periodo ben delimitato come la menopausa nella donna. Anedonia: assenza di piacere o di desiderio sessuale. I S S A MS e ndrologia edicina essualità A M Aneiaculazione: assenza di eiaculazione in assenza di congrui stimoli erotici. Aneuploidie spermatiche: alterazioni del corretto numero di autosomi e cromosomi sessuali portati dallo spermatozoo. Derivano da errori nella segregazione cromosomica durante la mitosi e la meiosi delle cellule germinali Anilina (test): metodica usata per valutare lo stato di condensazione cromatinica del nucleo spermatico. Sfrutta un colorante, il blu di anilina, che si lega alla componente istonica delle nucleoproteine, mettendo in evidenza alterazioni della corretta condensazione nucleare caratterizzate da un difetto nella normale sostituzione degli istoni con le protamine che avviene durante la spermiogenesi. Anorgasmia: assenza della fase dell’orgasmo. Antiandrogeni: gruppo di farmaci in grado di inibire gli effetti biologici degli androgeni, per azione sul recettore o sulla 5-alfa redattasi. Vengono utilizzati principalmente nel trattamento dell’ipertrofia prostatica benigna, del tumore prostatico e degli iperandrogenismi e irsutismi. AR (recettore degli androgeni, Adrogen Receptor): recettore steroideo intracellulare appartenente alla famiglia dei recettori nucleari degli ormoni steroidei, il cui gene si trova sul cromosoma X, AR media le azioni del testosterone e diidrotestosterone. In seguito al legame con il ligando l’AR trasloca nel nucleo dove regola la trascrizione di geni specifici androgeno dipendenti. Mutazioni del gene AR causano diversi gradi di sindrome da insensibilità agli androgeni e diverse forme di infertilità. Aromatasi: l’enzima che converte gli androgeni in estrogeni: il testosterone viene convertito in estrogeno, l’androstenedione in estrone. L’attività dell’aromatasi è presente dizionario andrologico sia nei surreni che nei tessuti periferici come quello adiposo. Aspermia: o aneiaculazione è la mancanza di emissione di liquido seminale dopo l’orgasmo. Tale condizione può essere transitoria o irreversibile a seconda della causa che la determina. Astenozoospermìa: riduzione al di sotto dei limiti di normalità della percentuale di spermatozoi mobili nell’eiaculato. Autosomi: coppie di cromosomi omologhi, portanti cioè gli stessi geni. Nell’uomo sono 23. Si appaiano in meiosi e si possono scambiare materiale genetico, determinando così la variabilità genetica nei gameti. AZF (AZoospermia Factor): regione del braccio lungo del cromosoma Y la cui delezione provoca la perdita di diversi geni e gravi alterazioni della spermatogenesi che si manifestano con azoospermia o grave oligozoospermia. Almeno tre regioni AZF sono note (AZFa, AZFb, AZFc), la più importante delle quali è rappresentata dall’AZFc che contiene il gene DAZ. Delezioni AZF si riscontrano nel 5-10% dei casi di azoospermia non ostruttiva e grave oligozoospermia. Azoospermia non ostruttiva: assenza completa di spermatozoi nell’eiaculato per cause pre-testicolari (quali l’ipogonadismo ipogonadotropo) o testicolari (alterazioni della spermatogenesi da cause ad azione diretta sul testicolo). Azoospermia ostruttiva: assenza completa di spermatozoi nell’eiaculato per cause post-testicolari, quali l’assenza o la ostruzione delle vie seminali. In questi casi la spermatogenesi intratesticolare è normale. Azoospermia: assenza completa di spermatozoi nell’eiaculato anche dopo analisi del centrifugato del liquido seminale. nB Balanite: processo flogistico a carico della mucosa del glande, quasi sempre esteso alla mucosa prepuziale (balanopostite), ad etiologia chimica (balanite semplice), batterica, micotica (Candida albicans), traumatica, protozoaria (Trichomonas vaginalis) o allergica. Balanopostite: processo flogistico-infettivo acuto o cronico, frequentemente associato a fimosi e a pato- logie dismetaboliche predisponenti (diabete mellito), a carico dello spazio balono-prepuziale con estensione alle mucose del glande, del prepuzio, del solco coronale e del meato uretrale. Biopsia prostatica: in genere sotto guida ecografica, la biopsia prostatica è la metodica principale per la diagnosi di patologie prostatiche, in particolare l’adenocarcinoma. Biopsia testicolare: praticata in genere in anestesia locale permette di effettuare un’analisi istologica testicolare, per la valutazione dello stato tubulare (cellule del Sertoli e spermatogenesi) e dell’interstizio (cellule di Leydig). È indicata in caso di azoospermia. Può essere associata alla ricerca con eventuale crioconservazione degli spermatozoi per tecnica ICSI (TESE). È stata proposta anche per l’analisi del carcinoma in situ del testicolo. Blastocisti: la blastocisti è un embrione di circa 100 cellule al 5° e 6° giorno di sviluppo. La blastocisti ha la struttura di una sfera cava. Dalle cellule dell’involucro si sviluppano le parti che origineranno la placenta e il cordone ombelicale. Dalla massa cellulare all’interno della blastocisti si svilupperà invece il feto. Le cellule staminali embrionali vengono ricavate da questa massa cellulare interna. BPH: ipertrofia o iperplasia prostatica benigna. Aumento di volume della prostata che si osserva generalmente dopo i 50 anni, ad eziologia sconosciuta, ma dipendente dall’azione degli androgeni. Può causare sintomi da ostruzione urinaria. La diagnosi si basa sull’esplorazione, l’ecografia transrettale ed il dosaggio del PSA. La terapia si basa sull’utilizzo di alfabloccanti e antiandrogeni o sulla resezione chirurgica, di solito per via transrettale (TURP). Brachiterapia: forma di radioterapia sviluppato prevalentemente per il trattamento del carcinoma prostatico localizzato con una dose di radiazioni estremamente elevate, senza danneggiare le strutture adiacenti alla ghiandola, inserendo impianti contenenti la sostanza radioattiva direttamente nel tumore. nC Carcinogenesi: processo attraverso il quale cellule normali si trasformano in cellule neoplastiche, in seguito a diverse e successive mutazioni genetiche. Cavernosografìa: indagine diagnostica radiologica in cui si eseguono una serie di radiogrammi in sequenza dopo la somministrazione di mezzo di contrasto per lo studio dei corpi cavernosi del pene. Cavernosometrìa: indagine diagnostica per lo studio dei flussi cavernosi durante l’erezione indotta dall’infusione di soluzione fisiologica. CBAVD: ssenza congenita dei vasi deferenti (Congenital Bilateral Absence of Vas Deferens). Può essere monolaterale o bilaterale ed in questi casi è frequentemente causata da mutazioni del gene CFTR della fibrosi cistica. Se bilaterale si associa ad azoospermia ostruttiva. Può essere associata ad alterazioni congenite epididimarie. CFTR: il regolatore della conduttanza transmembrana della fibrosi cistica (Cystic Fibrosis Transmembrane conductance Regulator) è una proteina trasportatore di cloruro delle cellule epiteliali. Mutazioni del gene CFTR causano la fibrosi cistica e/o l’assenza congenita dei vasi deferenti. Ciclo sessuale: è composto dalle seguenti fasi: desiderio, eccitazione, plateau, orgasmo e risoluzione. Contraccezione maschile: insieme di tutti i metodi contraccettivi gestibili da parte dell’uomo: preservativo, coito interrotto, vasectomia, somministrazione di ormoni e di sostanze chimiche. Coolidge (effetto): Stimolazione del desiderio maschile ottenuta cambiando frequentemente la partener. Corpi cavernosi: organi erettili del pene e del clitoride, costituiti da lacune vascolari comunicanti tra di loro e separate da setti che contengono fibre collagene ondulate e molte fibrocellule muscolari lisce. Le lacune sono tappezzate da endotelio continuo. Crioterapia: tecnica sviluppata per il trattamento del tumore prostatico che consiste nell’inserimento di alcuni aghi all’interno della prostata sotto guida ecografica. Gli aghi vengono poi sostituiti da alcuni dilatatori per permettere l’ingresso di sonde che provocano il raffreddamento, in grado di distruggere le cellule tumorali. Criptorchidismo: mancata discesa di uno (criptorchidismo monolaterale) o ANDROLOGIA MEDICA entrambi i testicoli (criptorchidismo bilaterale) nello scroto alla nascita presente in circa il 3% dei bambini. A parte rari casi ad eziologia endocrina o genetica, la causa è nella maggior parte dei casi sconosciuta. Può essere addominale o inguinale. Costituisce fattore di rischio per infertilità e tumore del testicolo. Cromosoma X: cromosoma appartenente insieme al cromosoma Y al paio dei cromosomi sessuali non omologhi. La sua inattivazione casuale, fenomeno della Lyonizzazione, nelle cellule somatiche della femmina, assicura che una egual quota di prodotti genici del cromosoma si ritrovi nelle cellule maschili e femminili. Cromosoma Y: cromosoma che determina con la sua presenza il sesso genetico maschile. Porta numerosi geni implicati nel controllo dei caratteri maschili ed in particolare il gene sry, responsabile dello sviluppo embrionale maschile. Cromosomi sessuali: coppia di cromosomi non omologhi X e Y che in base al loro assortimento definiscono il sesso genetico di un individuo. La presenza del cromosoma Y definisce il sesso maschile. Gli assetti corretti XX e XY identificano rispettivamente la femmina e il maschio Cromosomi: strutture contenenti l’informazione genetica portata dalla doppia elica di DNA organizzata con le proteine istoniche. Ogni cromosoma risulta altamente impaccato alla mitosi e si allinea in piastra metafisica ed è responsabile, grazie alla struttura discreta, del passaggio dell’informazione ereditaria. Ogni cromosoma alla mitosi ha una lunghezza e un motivo di bandeggio caratteristici. Nell’uomo i cromosomi sono 46 metà di origine paterna ed metà materna, organizzati in 22 coppie di omologhi autosomici e una coppia di cromosomi sessuali. nD DAZ: gene (Deleted in AZoospermia) testicolo-specifico presente in quattro copie nella regione AZFc del braccio lungo del cromosoma Y la cui delezione provoca azoospermia o grave oligozoospermia. Deferenti: o dotti deferenti, sono le strutture deputate al trasporto del liquido seminale prodotto nei testicoli verso le vescicole seminali. Desiderio sessuale: spinta psicologica verso pratiche sessuali; prima fase del ciclo sessuale. Detumescenza: fase di risoluzione dell’erezione, caratterizzata dalla perdita della turgidità del pene fino al graduale ritorno dell’organo alle dimensioni di riposo e allo stato di flaccidità. Dipendenza: Si ha quando l’approccio alla sessualità viene vissuto in modo ossessivo. Questa dipendenza rientra in quelle che sono state definite “dipendenze senza droga”, cioè alcuni comportamenti patologici che coinvolgono oggetti o attività apparentemente innocue, come il cibo, il gioco d’azzardo, il lavoro, il sesso. Disfunzione erettile (DE): persistente o ricorrente incapacità di ottenere e/ o mantenere un’erezione valida del pene tale da permettere la penetrazione in vagina ed un rapporto sessuale soddisfacente. Disgenesia gonadica: complessa patologia caratterizzata da alterazione morfologico-funzionale delle strutture urogenitali e gonadiche in seguito a danni che si verificano durante la determinazione sessuale nello sviluppo embrionale della gonade e dei genitali. È discussa l’influenza su tale patologia esercitata dell’esposizione fetale in utero a interferenti endocrini. Disgenesia testicolare (sindrome): condizione clinica causata da un’alterazione dello sviluppo embrionale testicolare causato da una combinazione di fattori genetici e ambientali che si manifesta in epoca post-natale con uno o più segni clinici caratterizzati da alterazione della spermatogenesi, criptorchidismo, ipospadia e tumore del testicolo. Dispareunia: Dolore genitale durante il coito. nE Eccitazione: prima fase del ciclo sessuale, caratterizzata nel maschio dall’erezione e nella donna dalla lubrificazione. Ecocolordoppler: vedi ecografia. Indagine diagnostica che sfrutta l’impiego di ultrasuoni per calcolare la velocità e la direzione del flusso ematico con una visualizzazione sul monitor di immagini a colori. Ecografia: o ecotomografia. Indagine diagnostica effettuata con l’impiego di ultrasuoni emessi da una sonda che vengono riflessi in maniera di- versa a seconda della densità dei tessuti attraversati. Gli ultrasuoni riflessi vengono raccolti dalla stessa sonda emettitrice ed elaborati dall’apparecchio e visualizzati come punti più o meno luminosi su di un monitor. EDV: end diastolic velocity (velocità di fine diastole) e un parametro che misura la funzione del meccanismo veno-occlusivo penieno e si calcola tramite l’ecolordoppler dopo farmacoinfusione intracavernosa. Eiaculato: fluido emesso dal pene nel corso dell’eiaculazione, costituito dal secreto delle ghiandole dell’apparato riproduttivo maschile e contenente gli spermatozoi raccolti dall’epididimo ed eventualmente cellule germinali immature e cellule somatiche, quali linfociti e cellule di sfaldamento del tratto riproduttivo maschile. Eiaculazione precoce: persistente o ricorente attività eiaculatoria prima della, o immediatamente susseguente alla, penetrazione vaginale e prima che il soggetto lo voglia, per incapacità di esercitare un controllo sul riflesso eiaculatorio su base psicogena, flogistica (possibile associazione con flogosi croniche dell’uretra posteriore e della prostata) o neurologica (possibile associazione con la sclerosi multipla). Eiaculazione retrograda: reflusso del liquido seminale in corso di eiaculazione nella vescica urinaria per insufficiente/mancata chiusura dello sfintere vescicale interno. Tale condizione, documentata dal rilievo di spermatozoi nelle urine dopo eiaculazione, rappresenta per lo più complicanza di interventi di chirurgia pelvica e di diabete mellito di lunga durata. Eiaculazione ritardata: difficoltà a raggiungere l’orgasmo durante il coito per inibizione specifica del riflesso eiaculatorio su base psicogena, iatrogena (farmaci antiadrenergici), neurologica o dismetabolica (diabete mellito). Endocrine disuruptos: vedi interferenti endocrini. Eosina (test): test di valutazione della vitalità cellulare. Utilizza il colorante cosina, che se penetra nella cellula, è indice di danneggiamento della membrana associato a morte cellulare. Epididimite: processo flogistico-infettivo acuto o cronico a carico del- n. 2 - Gennaio 2007 l’epididimo. Tra gli agenti infettivi più frequentemente coinvolti si annoverano la clamydia trachomatis, il gonococco e il bacillo di Koch. Epididimo: organo pari e simmetrico, appartenente al sistema escretore genitale maschile, consistente in un dotto unico e convoluto, adeso alla parete posteriore del testicolo e suddiviso in tre segmenti: prossimale (caput), originato dalla confluenza dei duttuli efferenti, intermedio (corpus) e distale (cauda); quest’ultimo, in corrispondenza del polo inferiore testicolare, si continua nel dotto deferente. Epispadia: malformazione uretrale caratterizzata dall’assenza, più o meno estesa, della parete superiore dell’uretra e conseguente sbocco del meato uretrale esterno sulla linea mediana della superficie dorsale dell’asta, più o meno prossimamente rispetto alla naturale posizione anatomica (varietà balanica, peniena, sottopubica e completa). Frequente l’associazione con incurvamento dorsale del pene da “corda penis”. Erezione: riflesso neurologico e vascolare che costituisce la risposta peniena e clitoridea alla fase di eccitazione Erezioni mattutine: erezioni spontanee che si verificano al risveglio dovute probabilmente a stimoli endocrini e/o neurovegetativi Erezioni notturne: erezioni spontanee che si verificano durante la fase REM del sonno Esame del liquido seminale: indagine di laboratorio condotta sul liquido seminale ottenuto per masturbazione che permette di valutare le caratteristiche macroscopiche degli spermatozoi e del plasma seminale. La procedura standard prevede la valutazione dei seguenti parametri: volume, pH, aspetto, fluidificazione e viscosità del liquido seminale ed inoltre concentrazione, numero, motilità, morfologia degli spermatozoi, presenza di agglutinazioni e di eventuali cellule spermatogenetiche, leucociti, cellule di sfaldamento e corpuscoli prostatici Estrogen receptor alpha e beta: le isoforme più comuni del recettore degli estrogeni, codificate da due diversi geni rispettivamente sul cromosoma 6 e sul cromosoma 14 umani. Il legame con il ligando determina la migrazione del recettore nel nucleo, dove, associato a un complesso di molecole attivatici regola l’espressione di geni bersaglio legandosi alle sequenze responsive ERE dei promotori. Estrogeni: famiglia di ormoni sessuali steroidei prodotti principalmente nella gonade femminile e nella surrene. Il loro nome è dovuto al ruolo fondamentale svolto nel ciclo estrale, nella regolazione della riproduzione femminile e nel controllo dei caratteri sessuali secondari femminili, anche se sono implicati in numerose altre funzioni non riproduttive. Sono prodotti anche nell’uomo, in particolare dalla conversione di testosterone ad opera dell’enzima aromatasi, e contribuiscono insieme agli androgeni a regolare la riproduzione maschile ed numerosi altri processi fisiologici. Oltre ad estradiolo, estriolo ed estrone, prodotti nella donna, esistono anche estrogeni di sintesi e composti estratti dalle piante, quali i fitoestrogeni. nF f/tPSA: rapporto tra forma libera e totale di PSA (antigene prostatico specifico). In caso di tumore prostatico tale rapporto si riduce a meno del 25%, con una buona correlazione tra riduzione di questo indice e rischio di tumore. È soprattutto utile in caso di valori di PSA totale tra 4 e 10 ng/ml. Fantasia sessuale: attività psichica a contenuto erotico più o meno contestualizzato in maniera genere-specifica Farmacoprotesi: o autoiniezione di farmaci vasoattivi. È l’iniezione autosomministrata da parte del paziente di farmaci vasoattivi come la prostaglandina PgE1 prima del rapporto sessuale. La PgE1 iniettata nei corpi cavernosi dilata le arterie, distende la muscolatura dei corpi cavernosi stessi, facilitando così il loro “riempimento” e quindi induce un’erezione meccanica senza stimoli sessuali Feromoni (o ferormoni): ormoni volatili che attirano individui della stessa specie Feticismo: con feticismo si intende lo spostamento della meta sessuale dalla persona nella sua interezza ad un suo sostituto, che può essere o una parte del corpo stesso, o una qualità, un indumento o qualsiasi altro oggetto. Fimosi: condizione congenita o acquisita di restringimento dell’orifizio prepuziale con impaccio del normale scorrimento del prepuzio sul glande e conseguente limitazione dell’attività sessuale per impossibile raggiungimento di una erezione valida alla penetrazione e ad un coito normale. FISH: ibridizzazione in situ fluorescente (Fluore–scence In Situ Hybridization). Tecnica che permette l’analisi di regioni cromosomiche mediante l’utilizzo di sonde complementari fluorescenti. In ambito andrologico clinico viene per esempio utilizzata per l’analisi delle aneuploidie spermatiche. FIV (Fecondazione In Vitro): tecnica di riproduzione assistita che consiste nella spontanea fecondazione in vitro, da parte di spermatozoi capacitati, di ovociti prelevati dall’ovaio dopo stimolazione di una crescita follicolare multipla. FIV-ET (Fertilizzazione In Vitro ed Embryo Transfer): tecnica di riproduzione assistita che consiste nella spontanea fertilizzazione in vitro, da parte di spermatozoi capacitati, di ovociti prelevati dall’ovaio dopo stimolazione di una crescita follicolare multipla e nel successivo trasferimento in cavità uterina degli embrioni ottenuti. Flaccidità: fase di riposo del pene caratterizzata dallo stato di contrazione della muscolatura liscia dei corpi cavernosi che determina la riduzione di volume delle lacune vascolari, essa è la conseguenza dell’aumento del tono ortosimpatico. Flutamide: antiandrogeno orale utilizzato soprattutto per il tumore prostatico, che compete con il testosterone ed il diidrotestosterone per il recettore a livello prostatico. È utilizzato anche per il trattamento degli irsutismi e iperandrogenismi. Frigidità: patologia della fase di eccitazione femminile, cioè della lubrificazione delle pareti vaginali. FSH: ormone follicolostimolante. Ormone glicoproteico prodotto dall’ipofisi anteriore che stimola nella donna la crescita dei follicoli ovarici e favorisce nell’uomo la spermatogenesi. La produzione di FSH è stimolata dal GnRH ipotalamico ed è inibita dagli estrogeni nella donna e dall’inibina B nell’uomo. continua sul n. 3 ANDROLOGIA e medicina della sessualità Un modulatore selettivo del recettore degli androgeni (SARM) che si può assumere per bocca è molto efficace sull’osso, sul muscolo e sulla funzione sessuale ma ha un effetto ridotto sulla prostata An Orally-Active Selective Androgen Receptor Modulator is Efficacious on Bone, Muscle and Sex Function with Reduced Impact on Prostate Miner JN, Chang W, Chapman MS, Finn PD, Hong MH, Lopez FJ, Marschke KB, Rosen J, Schrader W, Turner R, van Oeveren A, Viveros H, Zhi L, Negro-Vilar A. Endocrinology 148: 363-373, 2007 Molte patologie come l’osteoporosi, la perdita di massa muscolare e le disfunzioni sessuali, sia negli uomini sia nelle donne, trovano giovamento dalla terapia con androgeni. Questi ormoni non possono essere usati molto diffusamente per i notevoli effetti collaterali che si accompagnano al loro utilizzo, in particolare quelli sulla prostata e sui lipidi plasmatici. Negli ultimi anni la scoperta dei modulatori selettivi del recettore per gli estrogeni ha trasformato la terapia estrogenica. La possibilità di utilizzare dei modulatori selettivi per il recettore degli androgeni (SARMs) potrà portare una simile rivoluzione anche nell’uso terapeutico di questi farmaci. In questo lavoro gli autori hanno analizzato gli effetti di un legando del recettore androgenico che conserva le sue capacità anabolizzanti con un ridotto effetto sulla prostata. La molecola in questione si chiama LDG2226. Questo farmaco non ha una struttura steroidea, non è aromatizzabile ed è capace di legare con alta affinità il recettore degli androgeni in maniera selettiva, infatti è incapace di legare gli altri recettori come quelli per i mine- ralcorticoidi, i glucocorticoidi, gli estrogeni e il progesterone. La sua caratteristica è quella di interagire con il ligand binding domain (LBD) del recettore degli androgeni in modo differente rispetto al testosterone e ad altri androgeni, infatti fa assumere al recettore una conformazione particolare che induce risposte diverse nei vari tessuti rispetto al testosterone. Ciò potrebbe spiegare a livello molecolare la selettività della sua azione. Gli esperimenti condotti sia in vitro che in vivo nei ratti mostrano che LDG2226 ha attività anabolica sia sul tessuto osseo che su quello muscolare, ma lo stimolo alla crescita prostatica è notevolmente più basso rispetto agli altri androgeni. Test biomeccanici sulle ossa di animali trattati con LDG2226 mostrano un aumento della resistenza dell’osso, con riduzione del riassorbimento dell’osso spugnoso. Inoltre, sono stati analizzati gli effetti di questa molecola anche sulla funzione sessuale. LDG2226 è in grado di ripristinare la funzione sessuale negli animali castrati, sia per quanto riguarda la performance che per quanto riguarda la motivazione. Oggi la ricerca sui SARMs è ancora agli inizi, ma i risultati di questo studio suggeriscono che in futuro questi farmaci potrebbero essere degli utili strumenti terapeutici, infatti hanno dimostrato grandi vantaggi rispetto agli androgeni steroidei, come la selettività tissutale, le migliori proprietà farmacocinetiche e la specificità di legame associate alle riduzioni degli effetti indesiderati. Una delle prime applicazioni cliniche di questi farmaci potrebbe essere il trattamento delle patologie con perdita di massa muscolare. Quando si conosceranno meglio i meccanismi molecolari dell’azione dei SARMs, la messa a punto di nuove molecole potrà favorire l’ampliamento delle applicazioni terapeutiche. Eleonora Carosa È il controllo di qualità nell’analisi seminale ancora realmente necessario? NEW DEBATE: Is quality assurance in semen analysis still really necessary? A clinician’s viewpoint Jecquier A.M. Hum Reprod 2005; 20: 2039-2042 DEBATE-CONTINUED: Is quality assurance in semen analysis still really necessary? A view from the andrlogy laboratory Pacey A.A. Hum Reprod 2006; 21: 1105-1109 Influence of analytical and biological variation on the clinical interpretation of seminal parameters Castilla J.A. et al. Hum Reprod 2006; 21: 847-851 In un recente articolo provocatorio Anne Jecquier, eminente andrologo che, più di 20 anni fa, fu uno dei primi fautori della necessità del controllo di qualità (quality assurance-QA) nell’analisi del liquido seminale, confuta la reale utilità, per finalità cliniche, dei programmi di QA esterni, costosi e impegnativi, finalizzati a garantire e mantenere un’elevata accuratezza e riproducibilità nell’esecuzione dello spermiogramma. Argomentazioni addotte: 1) l’esame del liquido seminale è attualmente eseguito in modo soddisfacente nella maggior parte dei laboratori; 2) i parametri seminali hanno una scarsa accuratezza nel discriminare i soggetti fertili dagli infertili e uno scarso valore predittivo sull’evenienza di gravidanze, se non fortemente alterati. Molteplici sono le ragioni: l’ampia variabilità biologica intrinseca intraindividuale, il ruolo dell’interazione con il variabile potenziale di fertilità femminile, la inadeguatezza dello spermiogramma a valutare la competenza funzionale dell’eterogenea popolazione nemaspermica a superare i meccanismi di selezione che si realizzano nel tratto genitale femminile e a fecondare l’ovocita. Pertanto, l’analisi seminale andrebbe considerata solo come un test di screening orientativo, per il quale non si richiede un rigido QA, ma solo un’esecuzione ad un ragionevole standard, raggiungibile con un iniziale adeguato training. Che l’analisi seminale venga ovunque eseguita in modo soddisfacente viene messo in discussione nell’articolo di Pacey. In una recente indagine condotta in USA (Keel et al., Fertil Steril 78, 603-608, 2002) il 6% dei laboratori non riportavano dati sulla concentrazione, il 5% sulla motilità ed il 15% sulla morfologia nemaspermica. Nell’83% dei laboratori la morfologia veniva valutata su <100 spermatozoi. Anche l’analisi dei risultati ritornati da laboratori partecipanti a QA esterni, quali l’United Kingdom National External Quality Assurance (NEQAS) in Andrologia documentano ancora una considerevole variabilità (anche se la situazione va migliorando). Peraltro un adeguato training che garantisca un ragionevole standard nell’analisi seminale non è verificabile, dato che la partecipazione a corsi di training non è obbligatoria. Né è garantito che i partecipanti ai corsi, tornati ai loro laboratori continuino a mantenere lo stesso livello di accuratezza metodologica. Ciò può essere verificato solo mediante la partecipazione a QA esterni. Anche l’argomentazione della Jequier che il QA nell’analisi seminale non è essenziale perché essa non predice accuratamente la fertilità è ribattuta da Pacey, che sottolinea come, proprio per l’effetto dell’implementazione di QA nel laboratori seminologici, c’è un crescente numero di evidenze della correlazione tra risultati dell’analisi seminale e concepimenti sia naturali che con ART. Infine, anche se lo spermiogramma non indaga direttamente la competen- n. 2 - Gennaio 2007 za funzionale degli spermatozoi alla fecondazione, maggiore è il numero si spermatozoi mobili e morfologicamente normali nell’eiaculato, maggiore è la probabilità di avere un numero di spermatozoi funzionalmente competenti alla fecondazione “al posto giusto ed al momento giusto”. L’articolo di Castilla et al. è focalizzato sull’influenza dell’errore analitico (imprecisione) e della variabilità biologica intrinseca intorno ad un setting point omeostatico, le due principali componenti della variabilità intra-individuale del liquido seminale, sull’interpretazione clinica dei parametri seminali. La variabilità biologica può essere desunta sottraendo dalla variabilità totale dei risultati di ripetuti campioni seminali di uno stesso soggetto la variabilità analitica, analizzata su replicati di singoli campioni, tutte espresse come coefficiente di variazione (CVB, CVT e CVA, rispettivamente). Poiché la variabilità biologica dei parametri seminali è alta, un CVA molto basso non è necessario, ma un alto errore analitico può invalidare i risultati, quando contribuisca in modo rilevante alla variabilità totale. Per analisi non automatizzate, come quella seminale, per le quali non è facile raggiungere standards desiderabili, è stato proposto che il massimo errore analitico accettabile sia < 75% del CVB intra-individuale. Comunque, data l’alta variabilità biologica, per ridurre la dispersione dei risultati è più importante analizzare più campioni seminali che replicare l’analisi di uno stesso campione. Gli autori mostrano un’elegante analisi in cui, per ottenere una dispersione dei risultati <40%, considerata accettabile, rispetto al setting point omeostatico, sia sufficiente analizzare 2 eiaculati per tutti i parametri seminali, eccetto la concentrazione per la quale 3 o 4 determinazioni sono necessarie. Ho ritenuto interessante proporre alla nostra Società questo dibattito in corso su Human Reproduction, in un’epoca in cui si avverte in modo crescente il ricorso a trattamenti, spesso invasivi, dell’nfertilità di coppia senza un’accurato approccio diagnostico. Se da una parte è comprensibile il pragmatismo della Jecquier,, dato le pressioni a tener conto del rapporto costi/efficacia, è indiscutibile che il QA garantisce il mantenimento di un accettabile livello di accuratezza e precisione che serve a rassicurare i pazienti e i clinici, consente ai laboratoristi di avere consapevolezza del livello di precisione e, soprattutto, è indispensabile per l’accreditamento dei laboratori seminologici. Felice Francavilla Histological evaluation of the human testis-approaches to optimizing the clinical value of the assessment: Mini Review R.I. McLachlan, E. Rajpert-De Meyts, C.E. Hoei-Hansen, D.M. de Kretser, N.E. Skakkebaek Human Reproduction, 2007; 22: 2-16 L’analisi istologica testicolare mediante biopsia è una metodica molto importante nel management del maschio infertile. Ha un ruolo fondamentale non solo nell’iter diagnostico, ma anche ai fini prognostici per una tecnica di riproduzione assistita ed è fondamentale per determinare il rischio di neoplasia testicolare. La biopsia testicolare deve essere affiancata all’anamnesi, all’esame obiettivo, all’esame seminologico, alle indagini ormonali e genetiche non solo per poter distinguere le azoospermie ostruttive da quelle non ostruttive, ma anche per avere una definizione precisa dell’alterazione spermatogenetica, per indirizzare nella terapia e per ave- ANDROLOGIA e medicina della sessualità re informazioni circa il possibile recupero di spermatozoi (TESE). Infine, l’analisi istologica testicolare è necessaria per una corretta correlazione genotipo-fenotipo in ambito di ricerca. Nonostante l’importanza di questa tecnica la metodica di esecuzione, di analisi e di refertazione della biopsia testicolare non è uniforme e vengono utilizzate diverse terminologie che non fanno altro spesso di confondere il clinico. In questa review, gli Autori, tra i più importanti conoscitori dell’istologia testicolare, descrivono dal punto di vista tecnico e clinico la metodica di analisi istologica e propongono una classificazione dei disordini spermatogenetici allo scopo di uniformare le informazioni che possono provenire da questa analisi. Gli Autori presentano le tecniche più idonee per il processamento, la colorazione e l’analisi dei quadri istologici e forniscono una buona revisione della letteratura circa la correlazione con i risultati della TESE o con l’agoaspirato testicolare. Accanto alle forme classiche quali la sindrome a sole cellule del Sertoli o le forme ostruttive, gli Autori però utilizzano una classi- ficazione che merita alcune precisazioni. Infatti, gli Autori applicano il termine “ipospermatogenesi” a tutti i casi in cui siano evidenti spermatidi terminali, senza considerare il loro numero e la possibile presenza di alterazioni maturative. Inoltre, è controverso definire il completamento della spermatogenesi con la presenza di spermatidi, essendo forse più importante la presenza di spermatozoi maturi. Il termine “arresto della spermatogenesi” viene utilizzato dagli Autori solamente nei casi in cui la spermatogenesi cessa completamente ad uno stadio specifico in tutti i tubuli, senza distinzione tra arresti completi e arresti parziali. Infine gli Autori non prendono in considerazione un’analisi di tipo quantitativo, che dovrebbe registrare i singoli tipi cellulari (spermatogoni, spermatociti primari e secondari, spermatidi rotondi e allungati, spermatozoi) e rapportare questi tra di loro e con le cellule del Sertoli, allo scopo di identificare la quantità totale di cellule della spermatogenesi e la progressione attraverso le diverse fasi della spermatogenesi. Il termine “ipospermatogenesi” viene utilizzato dalla maggior parte degli Autori per indicare una riduzione quantitativa delle cellule germinali che sono tuttavia in proporzioni relative normali. L’arresto maturativo completo è definito come la completa assenza di cellule germinali oltre un certo stadio della spermatogenesi, ma solo un’analisi quantitativa può definire un arresto parziale o incompleto come l’accumulo di cellule germinali fino ad uno stadio della spermatogenesi con riduzione delle cellule a valle. È anche evidente che un arresto incompleto si può associare ad una ipospermatogenesi. Questa distinzione è importante anche per i risvolti clinici. Per esempio, il trattamento con FSH nei soggetti con grave oligozoospermia sembra essere efficace solamente quando non sono presenti alterazioni maturative. La quantificazione istologica è inoltre fondamentale per le analisi di correlazione genotipo-fenotipo, quali ad esempio le microdelezioni del cromosoma Y. Infine, un’accurata quantificazione degli spermatozoi maturi presenti in una biopsia testicolare è decisiva ai fini prognostici per una TESE o crioconservazione degli spermatozoi intratesticolari. Alberto Ferlin Quadri istologici testicolari.A-B: Normale spermatogenesi; C-D: ipospermatogenesi; E-F: arresto spermatocitico; G-H: sindrome a sole cellule del Sertoli. RCP 200x280 5-02-2007 15:06 Pagina 2 50mg testosterone RCP 20 12m RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. TESTOGEL 50 mg, gel. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA. Una bustina da 5 g contiene 50 mg di testosterone. Per gli eccipienti, vedere 6.1. 3. FORMA FARMACEUTICA. Gel in bustina. Testogel è un gel incolore trasparente o leggermente opalescente in bustina. 4. INFORMAZIONI CLINICHE. 4.1 Indicazioni terapeutiche. Terapia sostitutiva del testosterone nell’ipogonadismo maschile dovuto a deficit di testosterone diagnosticato attraverso segni clinici e test biochimici (vd. 4.4 Avvertenze speciali e opportune precauzioni d’impiego). 4.2 Posologia e modo di somministrazione. Applicazione cutanea. Adulti e soggetti anziani. La posologia raccomandata è pari a 5 g di gel (50 mg di testosterone) applicato una volta al giorno, più o meno alla stessa ora, preferibilmente al mattino. La dose giornaliera sarà adattata su parere del medico in funzione della risposta clinica o biologica del singolo paziente, senza superare i 10 g di gel al giorno. L’aggiustamento della posologia deve essere ottenuto con 2,5 g di gel alla volta. L’applicazione deve essere effettuata dal paziente stesso, sulla pelle pulita, asciutta e sana, su entrambe le spalle o braccia o sull’addome. Una volta aperta la bustina, tutto il contenuto dovrà essere estratto e applicato immediatamente sulla pelle. Il gel va semplicemente distribuito con delicatezza sulla cute per formare uno strato sottile. Non è necessario strofinare. Lasciare asciugare il prodotto per almeno 3-5 minuti prima di rivestirsi. Dopo l’applicazione lavarsi le mani con acqua e sapone. Non applicare sui genitali perché l’alto contenuto di alcool può provocare irritazioni locali. Lo stadio di equilibrio delle concentrazioni plasmatiche di testosterone viene raggiunto approssimativamente il 2° giorno di trattamento con Testogel. Al fine di poter adeguare la dose di testosterone, è necessario misurare la testosteronemia la mattina prima dell’applicazione a partire dal 3° giorno successivo all’inizio del trattamento (una settimana sembra ragionevole). Se la concentrazione plasmatica di testosterone supera il livello desiderato, è possibile ridurre la posologia. In caso di concentrazione bassa, la posologia potrà essere aumentata, senza superare i 10 g di gel al giorno. Bambini. Testogel non è indicato per i bambini e non è stato sottoposto a studi clinici nei ragazzi di età inferiore ai 18 anni. 4.3 Controindicazioni. Testogel è controindicato: • in caso di cancro della prostata presunto o confermato,o carcinoma mammario • in caso di ipersensibilità nota al testosterone o a qualunque altro componente del gel. 4.4 Avvertenze speciali e opportune precauzioni d’impiego. Non somministrare Testogel se non è stata dimostrata una condizione di ipogonadismo (iper- ed ipogonadotrofo) e se prima di iniziare il trattamento non sono state escluse altre eziologie che potrebbero essere all’origine della sintomatologia. L’insufficienza di testosterone deve essere dimostrata in modo chiaro da segni clinici (regressione dei caratteri sessuali secondari, cambiamento dell’immagine corporea, astenia, diminuzione della libido, disfunzione erettile, etc.) e confermata da due dosaggi separati di testosteronemia. Al momento non sono stati stabiliti all’unanimità i valori di riferimento del testosterone specifici per l’età. Bisogna però tenere conto che, per fattori fisiologici, i livelli plasmatici di testosterone si riducono con l’aumentare dell’età. A causa della variabilità dei valori delle analisi di laboratorio, tutte le misurazioni dei livelli di testosterone vanno effettuate all’interno dello stesso laboratorio. Testogel non è indicato per il trattamento della sterilità maschile o dell’impotenza. Prima di utilizzare un trattamento a base di testosterone, tutti i pazienti devono sottoporsi ad un esame approfondito al fine di eliminare qualsiasi rischio di cancro della prostata presistente. Nei pazienti sottoposti a trattamento con testosterone va eseguito almeno una volta l’anno e due volte l’anno nei soggetti anziani e nei pazienti a rischio (quelli con fattori clinici o familiari) un monitoraggio attento e regolare della ghiandola prostatica e del petto secondo i metodi raccomandati (esame rettale digitale e valutazione del PSA nel siero). Gli androgeni possono accelerare l’evoluzione di un cancro subclinico della prostata e dell’iperplasia prostatica benigna. Testogel deve essere utilizzato con prudenza nei pazienti affetti da cancro e a rischio di ipercalcemia (e ipercalciuria associata), dovuta a metastasi ossee. In tali pazienti si raccomanda di garantire un regolare monitoraggio della calcemia. Nei pazienti affetti da grave insufficienza cardiaca, epatica o renale, il trattamento con Testogel può comportare complicanze gravi caratterizzate da edema, accompagnato o no da insufficienza cardiaca congestizia, con conseguente sospensione immediata del trattamento. Potrebbe inoltre rendersi necessaria una terapia diuretica. Testogel va impiegato con prudenza nei pazienti con cardiopatia ischemica. Il testosterone può provocare un aumento della pressione arteriosa. Pertanto Testogel va usato con prudenza nei pazienti ipertesi. Nei pazienti sottoposti a trattamento androgeno di lunga durata, oltre alle analisi delle concentrazioni di testosterone, vanno controllati periodicamente i seguenti parametri di laboratorio: emoglobina, ematocrito (per rilevare un’eventuale policitemia), ed analisi della funzionalità epatica. Testogel va usato con cautela nei pazienti con problemi di epilessia ed emicrania perché può aggravare queste condizioni. In letteratura sono riportati casi di rischio di aumento di apnea notturna nei soggetti ipogonadici sottoposti a trattamento con gli esteri di testosterone, in particolare in soggetti a rischio con evidente obesità e patologia respiratoria cronica. Nei pazienti trattati con androgeni e che raggiungono livelli plasmatici di testosterone normali a seguito della terapia di sostituzione, si può osservare un miglioramento della sensibilità all’insulina. Taluni segni clinici come irritabilità, nervosismo, aumento di peso, erezioni prolungate o frequenti possono essere sintomatici di un’eccessiva esposizione agli androgeni e richiedere un adattamento della posologia. Se il paziente manifesta reazioni gravi sul sito di applicazione, il trattamento va esaminato e, se necessario, interrotto. Gli atleti devono essere informati del fatto che questa specialità contiene un principio attivo (testosterone) che potrebbe indurre una reazione positiva dei test praticati durante i controlli anti-doping. Testogel non è indicato per le donne a causa dei possibili effetti di tipo virilizzante. Potenziale trasferimento del testosterone. Se non si prendono le dovute precauzioni, il gel di testosterone può essere trasferito ad altre persone in caso di stretto contatto cutaneo, con conseguente aumento dei livelli plasmatici di testosterone e potenziali effetti indesiderati (ad es. crescita di peli sul viso e/o sul corpo, alterazione del timbro della voce, irregolarità del ciclo mestruale) nel caso di contatto ripetuto (androgenizzazione involontaria). Il medico deve informare il paziente del rischio di trasferimento del testosterone e delle precauzioni di sicurezza che vanno adottate (vd. di seguito). Testogel non va prescritto in pazienti che potrebbero non attenersi alle istruzioni di sicurezza (ad es. grave alcolismo, uso di sostanze stupefacenti, gravi disturbi psichiatrici). Il trasferimento del testosterone si evita indossando indumenti che coprano la zona di applicazione o facendosi una doccia prima del contatto. Si raccomandano pertanto le seguenti precauzioni: * per il paziente: • lavarsi le mani con acqua e sapone dopo l’applicazione del gel, • lasciar asciugare il gel e ricoprire la zona di applicazione con dei vestiti, • fare una doccia prima di qualunque situazione in cui si preveda la possibilità di contatto. * per le persone non sottoposte a trattamento con Testogel: • in caso di contatto con la zona di applicazione non lavata o non coperta con abiti, lavare appena possibile con acqua e sapone la superficie cutanea sulla quale ha potuto avere luogo il trasferimento di testosterone, • segnalare il manifestarsi di segni di eccessiva esposizione agli androgeni, come insorgenza di acne o modificazione dell’apparato pilifero. In seguito agli studi in vitro di assorbimento del testosterone effettuati con Testogel, risulta preferibile che i pazienti rispettino un periodo di almeno 6 ore dall’applicazione del gel prima di fare un bagno o una doccia. Tuttavia, un bagno o una doccia fatti occasionalmente in un periodo compreso tra una e 6 ore dall’applicazione del gel non dovrebbe influenzare in modo rilevante il corso del trattamento. Al fine di garantire la sicurezza della partner, al paziente va raccomandato ad esempio di osservare un lungo intervallo tra l’applicazione di Testogel e il rapporto sessuale, di indossare una maglietta che vada a coprire la zona di applicazione durante il periodo di contatto o di fare una doccia prima del rapporto sessuale. Inoltre, si raccomanda di indossare una maglietta, che copra il sito di applicazione, durante il contatto con i bambini, per evitare di contaminare la cute dei bambini. Le donne in gravidanza devono evitare qualunque contatto con le zone di applicazione di Testogel. In caso di gravidanza della partner, il paziente deve osservare con attenzione le precauzioni d’impiego (vd. sezione 4.6). 4.5 Interazioni con altri medicinali ed altre forme d’interazione. Anticoagulanti orali. Variazione dell’effetto anticoagulante (aumento dell’effetto dell’anti- c S r A z b o e t a l d t n O O A S S A C N b r c p a i i F t t b s n e L s f c d n d t m l v z d t d v t s T d A A A A A A A A A A A 9 m i n l e o e i e à i • n e i . i a e o i . d n o e n e o n i o o . - RCP 200x280 5-02-2007 15:06 Pagina 3 coagulante orale mediante modifica della sintesi epatica dei fattori della coagulazione e inibizione competitiva a livello dei legami delle proteine plasmatiche). Si raccomanda un esame più frequente del tempo di protrombina e del controllo dell’INR. I pazienti che assumono anticoagulanti orali richiedono un monitoraggio attento, in special modo in occasione dell’inizio o dell’interruzione del trattamento androgeno. La somministrazione concomitante di testosterone e di ATCH o di corticosteroidi può aumentare il rischio di manifestazioni edematose. Di conseguenza, questi medicinali devono essere somministrati con prudenza, in particolare nei pazienti affetti da malattie cardiache, renali o epatiche. Interazione con le analisi di laboratorio: gli androgeni possono ridurre i livelli di globulina legante la tiroxina e, di conseguenza, diminuire le concentrazioni plasmatiche di T4 ed aumentare la captazione della T3 e T4 su resina. I valori degli ormoni tiroidei liberi restano comunque invariati e non evidenziano segni clinici di insufficienza tiroidea. 4.6 Gravidanza e allattamento. Testogel è destinato esclusivamente all’impiego maschile. Testogel è controindicato durante la gravidanza o l’allattamento. Non sono stati effettuati studi clinici su questo tipo di trattamento nella donna. Le donne in gravidanza devono evitare qualunque contatto con le zone di applicazione di Testogel (vd. sezione 4.4). Il prodotto può avere effetti dannosi di tipo virilizzante sul feto. In caso di contatto, lavare con acqua e sapone appena possibile. 4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari. Testogel non influisce sulla capacità di guidare veicoli o di usare macchinari. 4.8 Effetti indesiderati. Alla posologia consigliata di 5 g. di gel al giorno, gli effetti indesiderati osservati con maggiore frequenza sono costituiti da reazioni cutanee (10%): reazioni sul sito di applicazione, eritemi, acne, pelle secca. Gli effetti indesiderati osservati in 1 - <10% dei pazienti sottoposti a trattamento con Testogel in studi clinici controllati sono elencati nella tabella seguente: Organo apparato classe Organismo in generale Apparato urogenitale Sistema nervoso centrale e periferico Sistema cardiovascolare Apparato gastrointestinale Cute e appendici Reazioni indesiderate Alterazioni delle analisi di laboratorio (policitemia, lipidi), cefalee Disturbi alla prostata, ginecomastia, mastodinia Vertigini, parestesia, amnesia, iperestesia, turbe dell'umore Ipertensione Diarrea Alopecia Nei pazienti trattati per ipogonadismo, si osservano frequenti fenomeni di ginecomastia, talvolta persistente. Altri effetti indesiderati noti dei trattamenti a base di testosterone per via orale o per iniezione sono: alterazioni della prostata e evoluzione di cancro subclinico della prostata, ostruzione urinaria, prurito, vasodilatazione arteriosa, nausea, ittero colestatico, alterazione dei test funzionali epatici, aumento della libido, depressione, irritabilità, mialgia e, in caso di trattamento prolungato con dose massiccia: modifiche elettrolitiche (ritenzione di sodio, potassio, calcio, fosfati inorganici e acqua), oligospermia e priapismo (erezioni frequenti o prolungate). Applicazioni frequenti sulla pelle possono provocare irritazioni e secchezza della cute dovute alla presenza di alcool. 4.9 Sovradosaggio. In letteratura è descritto un solo caso di sovradosaggio acuto di testosterone in seguito a iniezione. Si trattava di un caso di incidente cerebrovascolare in un paziente che presentava un’elevata concentrazione plasmatica di testosterone pari a 114 ng/ml (395 nmol/l). È del tutto improbabile che il trattamento per via transdermica possa comportare il raggiungimento di tali concentrazioni plasmatiche di testosterone. 5. PROPRIETÀ FARMACOLOGICHE. 5.1 Proprietà farmacodinamiche. Gruppo farmacoterapeutico: ANDROGENI, Codice ATC: G03BA03. Gli androgeni endogeni, soprattutto il testosterone e il suo metabolita principale DHT, secreti dai testicoli, sono responsabili dello sviluppo degli organi genitali esterni e interni e del mantenimento dei caratteri sessuali secondari (sviluppo della peluria, alterazione del timbro della voce, comparsa della libido); dell’azione generale sul metabolismo delle proteine; dello sviluppo della muscolatura scheletrica e della distribuzione del grasso corporeo; della riduzione dell’eliminazione di azoto, sodio, potassio, cloro, fosforo e acqua attraverso le urine. Il testosterone non induce lo sviluppo testicolare: riduce la secrezione ipofisaria di gonadotropine. Gli effetti del testosterone in alcuni organi si manifestano dopo la conversione periferica del testosterone in estradiolo che poi si lega ai recettori per gli estrogeni nel nucleo della cellula bersaglio, ad es. le cellule ipofisarie, adipose, cerebrali, ossee e testicolari di Leydig. 5.2 Proprietà farmacocinetiche. L’assorbimento percutaneo del testosterone varia dal 9% al 14% circa della dose applicata. Successivamente all’assorbimento percutaneo, il testosterone si diffonde nella circolazione sistemica con concentrazioni relativamente costanti nelle ventiquattr’ore. La concentrazione serica di testosterone aumenta fin dalla prima ora successiva all’applicazione per raggiungere una situazione di equilibrio a partire dal secondo giorno. Le variazioni quotidiane della concentrazione di testosterone presentano dunque un’ampiezza analoga a quelle osservate nel corso del ritmo circadiano del testosterone endogeno. La via di di somministrazione percutanea evita così i picchi di diffusione sanguigna indotti dalle iniezioni e, contrariamente all’androgenoterapia per via orale, non induce concentrazioni epatiche dello steroide superiori a quelle fisiologiche. La somministrazione di 5 g di Testogel corrisponde a un aumento medio del tasso di testosterone pari a circa 2,5 ng/ml (8,7 nmol/l) nel plasma. In seguito a sospensione del trattamento, la diminuzione delle concentrazioni di testosterone ha inizio circa 24 ore dopo l’ultima applicazione. Il ripristino delle concentrazioni di base si verifica nelle 72-96 ore successive all’ultima somministrazione. I principali metaboliti attivi del testosterone sono il diidrotestosterone e l’estradiolo. Il testosterone viene escreto per la maggior parte nell’urina e nelle feci sotto forma di metaboliti del testosterone coniugato. 5.3 Dati preclinici di sicurezza. Il testosterone si è dimostrato non mutageno in vitro secondo il modello delle mutazioni inverse (test di Ames) o delle cellule ovariche di criceto. Gli studi condotti su animali da laboratorio hanno evidenziato una relazione tra il trattamento a base di androgeni e certi tipi di tumori. I dati degli esperimenti sui topi hanno mostrato un aumento delle incidenze di cancro alla prostata dopo il trattamento con testosterone. È noto che gli ormoni sessuali facilitano lo sviluppo di certe forme tumorali indotte da agenti cancerogeni noti. Non è stata stabilita alcuna correlazione tra questi dati e il rischio effettivo per l’uomo. 6. INFORMAZIONI FARMACEUTICHE. 6.1 Elenco degli eccipienti. Carbomer 980, isopropile miristato, etanolo 96%, sodio idrossido, acqua depurata. 6.2 Incompatibilità. Non pertinente. 6.3 Periodo di validità. 2 anni. 6.4 Speciali precauzioni per la conservazione. Nessuna speciale precauzione per la conservazione. 6.5 Natura e contenuto del contenitore. 5 g in bustina (PET/Aluminium/PE). Astuccio contenente 1, 2, 7, 10, 14, 28, 30, 50, 60, 90 o 100 bustine. È possibile che non tutte le confezioni siano commercializzate. 6.6 Istruzioni per l’impiego e la manipolazione, e per lo smaltimento. Nessuna istruzione particolare. 7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO. Laboratoires BESINS INTERNATIONAL - 3, rue du Bourg l’Abbé - 75003 PARIS/Francia; Importatore e distributore in Italia: Schering S.p.A. - Via E. Schering, 21 - 20090 Segrate (MI). 8. NUMERO DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO. Astuccio contenente 1 bustina monodose AIC N° 035864127/M Astuccio contenente 2 bustine monodose AIC N° 035864139/M Astuccio contenente 7 bustine monodose AIC N° 035864141/M Astuccio contenente 10 bustine monodose AIC N° 035864154/M AIC N° 035864166/M Astuccio contenente 14 bustine monodose AIC N° 035864178/M Astuccio contenente 28 bustine monodose AIC N° 035864180/M Astuccio contenente 30 bustine monodose Astuccio contenente 50 bustine monodose AIC N° 035864192/M Astuccio contenente 60 bustine monodose AIC N° 035864204/M Astuccio contenente 90 bustine monodose AIC N° 035864216/M AIC N° 035864228/M Astuccio contenente 100 bustine monodose 9. DATA DI PRIMA AUTORIZZAZIONE/ RINNOVO DELL’AUTORIZZAZIONE. Marzo 2004. 10. DATA DI REVISIONE DEL TESTO. Gennaio 2006. RCP 200x280 5-02-2007 15:06 Pagina 1 Dep. presso AIFA in data 5 dicembre 2006 12m Testogel®: il gel di testosterone G03BA03 50mg testosterone Prezzi aggiornati a dicembre 2006 Confezione da 30 bustine Classe C Prezzo al Pubblico Euro 65,70
Scaricare