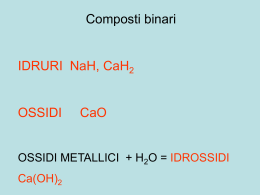
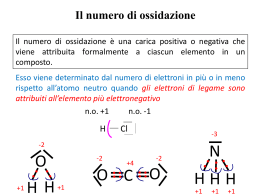
ELEMENTI METALLI I, II, III, Sn, Pb, Bi blocco d e blocco f SEMIMETALLI Zn, Al, Si, Ge, As. Sb NON METALLI B, C, N, P, VI, VII + ossigeno OSSIDI + ossigeno OSSIDI ANFOTERI + ossigeno ANIDRIDI + acqua IDROSSIDI + acqua IDROSSIDI + acqua ACIDI OSSIGENATI idrossidi + acidi ossigenati SALI + + acqua acqua ACIDIOSSIGENATI OSSIGNATI ACIDI Le regole della nomenclatura in chimica sono redatte dalla International Union of Pure and Applied Chemistry (IUPAC) http://www.iupac.org/index_to.html http://www.acdlabs.com/iupac/nomenclature/ Scopo: razionalizzare i nomi dei composti in modo che vi sia una correlazione univoca fra la formula e il nome del composto stesso. La nomenclatura IUPAC utilizza la definizione di numero di ossidazione e il concetto di elettronegatività. Elettronegatività : misura della tendenza di un atomo ad attrarre su di sé gli elettroni di legame. Numero di ossidazione : rappresenta la carica che formalmente un atomo acquisterebbe se gli elettroni di legame venissero attribuiti all’atomo più elettronegativo nei composti covalenti. Nei composti ionici (monoatomici) il numero di ossidazione dell’atomo coincide in valore e in carica con la sua carica ionica. Molecole poliatomiche di sostanze elementari Il nome dell’elemento deve essere preceduto da un un prefisso che indica il numero di atomi in ogni molecola 1 mono- 2 di- Esempi 3 tri- simbolo Nome IUPAC Nome classico 4 tetra- O (mono)ossigeno ossigeno atomico 5 penta- O2 diossigeno ossigeno 6 esa- O3 triossigeno ozono 7 epta- F2 difluoro fluoro 8 otta- P4 tetrafosforo fosforo bianco 9 nona- S8 ottazolfo zolfo 10 deca 11 undeca 12 dodeca Nomenclatura dei cationi (monoatomici): I nomi dei cationi si formano premettendo il termine “ione” al nome dell’elemento Es. Na+: ione sodio Gli elementi del I e del II gruppo formano sempre ioni con un unico tipo di carica: elemento carica ionica caratteristica GRUPPO I (metalli alcalini): +1 GRUPPO II (metalli alcalino-terrosi) +2 Altri elementi come Al, Zn e Cd hanno sempre ioni con un solo tipo di carica: Al3+, Zn2+, Cd2+ Molti metalli di transizione posso dare origine a più di un tipo di ione caratteristico. Es. il Rame può esistere come Cu+ o come Cu2+. Per distinguerli si usa “attaccare” al nome dello ione un numero romano (scritto tra parentesi) che corrisponde alla carica dello ione stesso (Notazione di Stock). Quindi Cu+ si indicherà come “ione rame(I)” e Cu2+ come “ione rame(II)” Analogamente, Fe2+ è lo ione ferro(II) e Fe3+ è lo ione ferro(III) In un sistema di nomenclatura un po’ più vecchio (tradizionale), gli ioni con carica diversa vengono denominati aggiungendo alla radice del nome dell’elemento (radice=nome-desinenza) un suffisso identificativo della carica. In particolare, per gli ioni con la carica più bassa si usa il suffisso –oso, mentre per quella più alta si usa –ico. Es. Fe2+, ione ferro(II), oppure ione ferroso Fe3+, ione ferro(III), oppure ione ferrico Altri esempi: Cobalto Co2+ Co3+ Cobalto(II) Cobaltoso Cobalto(III) Cobaltico Rame Cu+ Cu2+ Rame(I) Rame(II) Piombo Pb2+ Pb4+ Piombo(II) Piomboso Piombo(IV) Piombico Stagno Sn2+ Sn4+ Stagno(II) Stagno(IV) Rameoso Rameico Stannoso Stannico Nomenclatura degli anioni (monoatomici): Ione + radice del nome dell’elemento + desinenza -uro Eccezioni: BrFS2P3- Ione bromuro Ione fluoruro Ione solfuro Ione fosfuro O2HN3C4- Ione ossido Ione idruro Ione nitruro Ione carburo (NON ossigenuro) (NON idrogenuro) (NON azoturo, che è invece N3-) (NON carboniuro) Composti binari AB I composti binari, costituiti solo da due elementi, si scrivono indicando a sinistra l’elemento che precede nella serie M,Xe,Kr, B, Si, C, Sb, As, P, N, H, Te, Se, S, At,I, Br, Cl, O, F Nomenclatura IUPAC Nomenclatura classica pref-B-uro di A B-uro di A-suff Esempi simbolo Nome IUPAC Nome classico NaCl cloruro di sodio cloruro di sodio MgCl2 dicloruro di magnesio cloruro di magnesio FeCl2 dicloruro di ferro (cloruro di ferro(II) in Stock) cloruro ferroso* FeCl3 tricloruro di ferro (cloruro di ferro(III), in Stock) cloruro ferrico* FeI2 diioduro di ferro (ioduro di ferro(II), in Stock) ioduro ferroso* *-ico quando A è nel suo stato alto di ossidazione -oso quando A è nel suo stato basso di ossidazione Composti binari dell’idrogeno L’idrogeno si può trovare in due stati di ossidazione: -1 (IDRURI) +1 (ACIDI) Esempi simbolo Nome IUPAC Nome classico LiH idruro di litio idruro di litio BeH2 diidruro di berillio idruro di litio BH3 triidruro di boro borano B2H6 esaidruro di diboro diborano NH3 triidruro di azoto ammoniaca H2S solfuro di diidrogeno acido solfidrico HF fluoruro di idrogeno acido fluoridrico HCl cloruro di idrogeno acido cloridrico HBr bromuro di idrogeno acido bromidrico I composti binari con l’ossigeno vengono chiamati ossidi CaO Ossido di calcio CO Ossido di carbonio CO2 Diossido di carbonio SO2 Diossido di zolfo SO3 Triossido di zolfo NO Ossido di azoto NO2 Diossido di azoto Nomenclatura tradizionale I composti fra metallo e ossigeno sono detti ossidi basici. I composti fra non metallo e ossigeno sono detti anidridi. Negli ossidi basici i diversi stati di ossidazione, e quindi le diverse sostanze, sono differenziati usando i suffissi OSO e ICO. Nelle anidridi vengono utilizzati i suffissi OSA e ICA e i prefissi IPO e PER nel caso di più di 2 stati di ossidazione. FeO Ossido ferroso Fe2O3 Ossido ferrico Cl2O Anidride ipoclorosa CO2 Anidride carbonica Cl2O3 Anidride clorosa SO2 Anidride solforosa Cl2O5 Anidride clorica SO3 Anidride solforica Cl2O7 Anidride perclorica Composti binari dell’ossigeno: schema riassuntivo Tranne OF2 sono del tipo XmOn Nomenclatura IUPAC Nomenclatura classica pref-ossido di pref-X ossidi/anidridi Carattere basico Æ ossidi Carattere acido Æ anidridi Prefissi e suffissi di ossidi e anidridi per-A-ico quando A è nel suo massimo stato di ossidazione (es. Cl+7) A-ico quando A è nel suo stato alto di ossidazione (es. Cl+5) A-oso quando A è nel suo stato basso di ossidazione (es. Cl+3) ipo-A-oso quando A è nel suo minimo stato di ossidazione (es. Cl+1) Nei perossidi, l'Ossigeno ha n° di ossidazione -1. Nei superossidi, l'Ossigeno ha n° di ossidazione -1/2. Composti binari dell’ossigeno Metallo + Ossigeno: MxOy Gli indici x e y dipendono dai rispettivi numeri di ossidazione: M(+1) + O(2-) Æ M2O M(+2) + O(2-) Æ MO M(+3) + O(2-) Æ M2O3 M(+4) + O(2-) Æ MO2 Non metallo + Ossigeno: MxOy x e y dipendono dai rispettivi numeri di ossidazione: E(+1) + O(2-) Æ E2O E(+2) + O(2-) Æ EO E(+3) + O(2-) Æ E2O3 E(+4) + O(2-) Æ EO2 E(+5) + O(2-) Æ E2O5 E(+7) + O(2-) Æ E2O7 Esempi simbolo Nome IUPAC Nome classico Li2O ossido di dilitio ossido di litio Na2O ossido di disodio ossido di sodio Na2O2 diossido di disodio perossido di sodio KO2 diossido di potassio superossido di potassio CaO ossido di calcio calce viva Al2O3 triossido di dialluminio allumina FeO ossido di ferro ossido ferroso Fe2O3 triossido di diferro ossido ferrico (sesquiossido di ferro) SnO ossido di stagno ossido stannoso SnO2 diossido di stagno B2O3 triossido di diboro anidride borica CO2 diossido di carbonio anidride carbonica SiO2 diossido di silicio anidride silicica (silice) ossido stannico Esempi simbolo Nome IUPAC Nome classico SO2 diossido di zolfo anidride solforosa SO3 triossido di zolfo anidride solforica Cl2O ossido di dicloro anidride ipoclorosa Cl2O3 triossido di dicloro anidride clorosa Cl2O5 pentaossido di dicloro anidride clorica Cl2O7 eptaossido di dicloro anidride perclorica Idrossidi (prodotti di idratazione di ossidi basici) Del tipo M(OH)n Nomenclatura IUPAC Nomenclatura classica pref-idrossido di M idrossido M-suff Esempi simbolo Nome IUPAC Nome classico NaOH idrossido di sodio soda caustica Ca(OH)2 idrossido di calcio calce spenta Fe(OH)2 diidrossido di ferro idrossido ferroso Fe(OH)3 triidrossido di ferro idrossido ferrico Ioni poliatomici Cationi Tra i cationi poliatomici sono importanti quelli formati da elementi non metallici con idrogeno. Ione+ nome dell’elemento legato all’idrogeno + desinenza onio Eccezione: H3O+ PH4+ NH4+ Ione ossonio Ione fosfonio Ione ammonio (non azotonio) Anioni Per alcuni anioni si usa la desinenza uro tipica dei monoatomici: Ione+ nome dell’elemento + desinenza uro S22CNN3O3- Ione disolfuro Ione cianuro Ione azoturo Ione ozonuro OHO22- Ione idrossido Ione perossido Eccezioni rilevanti: Composti importanti: NaOH H2O2 (non ossidrile) idrossido di sodio perossido di idrogeno (acqua ossigenata) Di regola, gli anioni poliatomici si considerano formati da un elemento centrale il cui nome assume la desinenza ato; si precisa il numero degli altri atomi legati all’elemento centrale con i prefissi di, tri, tetra, ecc., eventualmente indicando con la notazione di Stock il numero di ossidazione dell’elemento centrale. Esempi: - BF4 2SiF6 ione tetrafluoroborato (III) ione esafluorosilicato (IV) Tra gli anioni poliatomici costituiscono una classe molto importante gli OSSOANIONI, cioè gli anioni in cui l’ossigeno è legato all’atomo centrale. Il numero di atomi di ossigeno viene precisato con i prefissi: (mono)osso, diosso, triosso, tetraosso, ecc. Esempi: - NO3 2SO4 MnO4 2MnO4 ione triossonitrato (V) ione tetraossosolfato (VI) ione tetraossomanganato (VII) ione tetraossomanganato (VI) Nomenclatura tradizionale: se l’elemento centrale può avere 2 diversi stati di ossidazione, si adottano i suffissi ato per il numero di ossidazione più alto e ito per il numero di ossidazione più basso. Esempi: NO2 NO3 SO3 SO4 - 22- ione nitrito ione diossonitrato (III) ione nitrato ione triossonitrato (V) ione solfito ione triossosolfato (IV) ione solfato ione tetraossosolfato (VI) Se l’elemento centrale ha più di 2 stati di ossidazione, si usano i prefissi ipo con desinenza ito per indicare l’ossoanione che ha un numero di ossidazione più basso rispetto all’ossoanione indicato con la desinenza ito; per con desinenza ato per indicare l’ossoanione che ha un numero di ossidazione più alto rispetto all’ossoanione indicato con la desinenza ato. Esempi: ClO - ClO2 ClO3 ClO4 - ione ipoclorito ione (mono)ossoclorato (I) ione clorito ione diossoclorato (III) ione clorato ione triossoclorato (V) ione perclorato ione tetraossoclorato (VII) Ossoanioni contenenti idrogeno La perdita parziale di ioni H+ dà luogo a radicali ionici negativi indicati col prefisso IDROGENO-: HSO4- Æ ione idrogenosolfato E, se necessario, anche i prefissi mono-, di-, tri- per indicare il numero di ioni H+: H2PO4- Æ ione diidrogenofosfato HPO42H2PO4HCO3HSO4HSO3Ione Ione Ione Ione Ione Idrogeno Diidrogeno Idrogeno Idrogeno Idrogeno -fosfato -fosfato -carbonato -solfato -solfito Bicarbonato, bisolfato, bisolfito Nomenclatura corrente: prefisso “bi” Ioni poliatomici comuni Carica +1 Carica -1 Carica -2 Carica -3 NH4+ (ammonio) OH- idrossido (ossidrile) NO3- (nitrato) NO2- (nitrito) ClO4- (perclorato) ClO3- (clorato) ClO2- (clorito) ClO- (ipoclorito) CN- (cianuro) C2H3O2- (acetato) MnO4- (permanganato) HCO3(idrogenocarbonato) H2PO4- (diidrogenofosfato) CO32- (carbonato) SO42- (solfato) SO32- (solfito) CrO42- (cromato) Cr2O72(bicromato) HPO42(idrogenofosfato) PO43(fosfato) H3O+ (idronio) Acidi Gli acidi possono essere suddivisi in: -acidi binari o pseudo-binari (idracidi) -acidi derivanti dagli anioni poliatomici Acidi binari o pseudo-binari Sono composti formati dall’idrogeno con elementi non metallici del VI e VII gruppo. La nomenclatura IUPAC usa le regole descritte per i composti binari. La nomenclatura tradizionale usa acido + nome dell’elemento non metallico + suffisso idrico. Esempi: HCl HBr HF H2S HCN Cloruro di idrogeno Bromuro di idrogeno Fluoruro di idrogeno Solfuro di diidrogeno Cianuro di idrogeno Acido cloridrico Acido bromidrico Acido fluoridrico Acido solfidrico Acido cianidrico Acidi derivanti dagli anioni poliatomici Gli acidi più comuni sono quelli che derivano dagli ossoanioni e sono chiamati OSSOACIDI. La nomenclatura IUPAC utilizza il nome del corrispondente ossoanione variando la desinenza -ato in -ico e premettendo la parola acido. Alternativamente può essere mantenuto il suffisso -ato specificando il numero di ossidazione dell’elemento centrale e precisando il numero di atomi di idrogeno. Esempi: HNO2 HNO3 Acido diossonitrico (III) Acido triossonitrico (V) Diossonitrato (III) di idrogeno Triossonitrato (V) di idrogeno La nomenclatura tradizionale utilizza il nome del corrispondente ossoanione variando la desinenza ato in ico e ito in oso e mantenendo i prefissi per e ipo se presenti. Acido triossosolforico (IV) Acido solforoso Esempi: H2SO3 Triossosolfato (IV) di diidrogeno Acido tetraossosolforico (VI) Acido solforico H2SO4 Tetraossosolfato (VI) di diidrogeno Esempi: HClO HClO2 HClO3 HClO4 H2CO3 HIO4 H2CrO4 H3AsO3 H3AsO4 Acido (mono)ossoclorico (I) (Mono)ossoclorato (I) di idrogeno Acido diossoclorico (III) Diossoclorato (III) di idrogeno Acido triossoclorico (V) Triossoclorato (V) di idrogeno Acido tetraossoclorico (VII) Tetraossoclorato (VII) di idrogeno Acido triossocarbonico (IV) Triossocarbonato (IV) di diidrogeno Acido tetraossoiodico (VII) Tetraossoiodato (VII) di idrogeno Acido tetraossocromico (VI) Tetraossocromato (VI) di diidrogeno Acido triossoarsenico (III) Triossoarseniato (III) di triidrogeno Acido tetraossoarsenico (V) Tetraossoarseniato (V) di triidrogeno Acido ipocloroso Acido cloroso Acido clorico Acido perclorico Acido carbonico Acido periodico Acido cromico Acido arsenioso Acido arsenico Ossoacidi (prodotti di idratazione di ossidi acidi) Del tipo HjXkOl dove X è un metallo in alto stato di ossidazione o un non metallo. La nomenclatura corretta di questi composti specifica. 1. Lo stato di ossidazione dell’elemento X mediante i prefissi ipo-X-oso,X-oso,Xico,per-X-ico in ordine crescente di numero di ossidazione. 2. Il grado di idratazione dell’acido (orto- alta idratazione, meta- bassa idratazione) Si definisce orto l'acido che contiene il maggior numero possibile di molecole d'acqua. L'acido meta contiene una molecola d'acqua in meno rispetto all'orto. Il termine di- (o piro) si usa invece per indicare gli ossiacidi che derivano dalla condensazione di due molecole di un ortoacido. (La formula bruta degli acidi 'di' si costruisce quindi raddoppiando gli elementi dell'acido orto e sottraendo due idrogeni e un ossigeno.) 3. La presenza di legami perossidici O–O (prefisso perosso-). Tioacidi: con questo termine si indica la sostituzione di un O con S in un ossiacido. Esempio: H2S2O3, acido tiosolforico (ipotetico). Esempi: (nomenclatura derivante dal diversi stato di ossidazione di X) (Anidride ipoclorosa) Cl2O + H2O Æ H2Cl2O2 Æ 2HClO (acido ipocloroso) (Anidride clorosa) Cl2O3 + H2O Æ H2Cl2O4 Æ 2HClO2 (acido cloroso) (Anidride clorica) Cl2O5 + H2O Æ H2Cl2O6 Æ 2HClO3 (acido clorico) (Anidride perclorica) Cl2O7 + H2O Æ H2Cl2O8 Æ 2HClO4 (acido perclorico) (Anidride bromica) Br2O5 + H2O Æ H2Br2O6 Æ 2HBrO3 (acido bromico) (Anidride bromosa) Br2O3 + H2O Æ H2Br2O4 Æ 2HBrO2 (acido bromoso) Esempi: (nomenclatura derivante dal diverso grado di idratazione dell’acido) Alcuni non metalli, soprattutto del IV e del V gruppo formano acidi con formula corrispondente all’addizione di una quantità variabile di molecole di H2O all’anidride. Così per uno stesso numero di ossidazione possono esistere diversi acidi, distinguibili con appropriati prefissi, fermo restando il suffisso associato a quel n.o. All’aumentare del numero di molecole d’acqua si usano i seguenti suffissi: META-, PIRO- (o DI-), ORTO. P2O5 + H2O Æ HPO3 (acido metafosforico) P2O5 + 2 H2O Æ H4P2O7* (acido pirofosforico o difosforico) P2O5 + 3 H2O Æ H3PO4 (acido ortofosforico) *Può anche essere visto come il risultato della condensazione di 2 orto-acidi simbolo Nome IUPAC simbolo Nome IUPAC HNO2 acido nitroso HClO acido ipocloroso HNO3 acido nitrico HClO2 acido cloroso H2CO3 acido carbonico HClO3 acido clorico HBO2 acido metaborico HClO4 acido perclorico H3BO3 acido ortoborico H2CrO4 acido cromico H3PO3 acido fosforoso H2SO3 acido solforoso H3PO4 acido ortofosforico H2SO4 acido solforico HPO3 acido metafosforico H2S2O7 acido disolforico H2S2O8 acido perossodisolforico H4P2O7 acido pirofosforico H2SO5 acido perossosolforico. H2S2O3 acido tiosolforico I sali I sali semplici sono prodotti dalla sostituzione di tutti gli idrogeni di un acido. Il loro nome si ottiene dal nome dell’acido da cui il sale formalmente deriva, sostituendo i prefissi e i suffissi che caratterizzavano l’acido per-A-ico per-A-ato A-ico A-ato A-oso A-ito ipo-A-oso ipo-A-ito a cui segue la specificazione dell’atomo o del gruppo che ha sostituito gli atomi di idrogeno. Esempi simbolo Nome IUPAC simbolo Nome IUPAC Li2SO3 solfito di dilitio NaNO2 nitrito di sodio (NH4)2SO4 solfato di ammonio Ca(NO3)2 nitrato di calcio KMnO4 permanganato di potassio Sali Sia la nomenclatura IUPAC sia quella tradizionale utilizzano il nome dell’anione seguito dalla preposizione di e dal nome dello ione positivo. Nella nomenclatura IUPAC si precisa il numero degli atomi con i prefissi (mono), di, tri, ecc. Nella nomenclatura tradizionale sono mantenuti tutti i prefissi ed i suffissi visti in precedenza. Esempi: CaCl2 FeCl3 NaClO Fe(OH)2 Fe(OH)3 KCN Na2O2 CaSO4 CaSO3 dicloruro di calcio tricloruro di ferro (mono)ossoclorato (I) di sodio diidrossido di ferro triidrossido di ferro cianuro di potassio perossido di sodio tetraossosolfato (VI) di calcio triossosolfato (IV) di calcio cloruro di calcio cloruro ferrico ipoclorito di sodio idrossido ferroso idrossido ferrico Na3PO4 tetraossofosfato (V) di trisodio ortofosfato di sodio solfato di calcio solfito di calcio Sali che contengono atomi di idrogeno acidi (Sali acidi) La nomenclatura IUPAC fa precedere al nome dell’anione il termine idrogeno, indicando il numero di atomi di idrogeno attraverso opportuni prefissi, seguito dalla preposizione di e dal nome dell’elemento che costituisce il catione . La nomenclatura tradizionale fa precedere al nome dell’anione il prefisso bi. Esempi: NaHCO3 idrogeno triossocarbonato (IV) di sodio KHSO4 idrogeno tetraossosolfato (VI) di potassio Bicarbonato di sodio Bisolfato di potassio Schema riassuntivo composti ossigeno Esercizi: 1) Scrivere la formula dei seguenti composti: Carbonato di Sodio Na2CO3 Nitrato di Alluminio Al(NO3)3 Cloruro d’Argento AgCl Nitrito di Calcio Ca(NO2)2 Idrogeno fosfato di Calcio CaHPO4 Idrossido di Bario Ba(OH)2 2) Assegnare il nome ai seguenti composti: SO2 PbO2 HClO3 H3PO3 Es. Scrivere la formula o il nome dei seguenti composti: • • • • • • • • • • • • • K2CO3: Cu(NO3)2: CuCl: FeCl3: Fe2(SO3)3: Na2SO4: BaSO4: Na3PO4: Al2S3: AlPO4: MnCl2: KMnO4: NH4Cl: carbonato di potassio nitrato rameico cloruro rameoso cloruro ferrico solfito ferrico solfato di sodio solfato di bario fosfato di sodio solfuro di alluminio fosfato di alluminio cloruro di manganese permanganato di potassio cloruro di ammonio
Scaricare