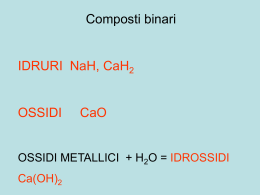
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in più o in meno rispetto all’atomo neutro quando gli elettroni di legame sono attribuiti all’elemento più elettronegativo n.o. +1 n.o. -1 H Cl -3 -2 O +1 H H +1 -2 +4 N -2 O C O HHH +1 +1 +1 REGOLE PER IL CALCOLO DEI NUMERI DI OSSIDAZIONE 1) Tutte le sostanze allo stato elementare hanno numero di ossidazione zero. Per esempio O2, Fe, H2, O3 2) Negli ioni monoatomici gli elementi hanno numero di ossidazione uguale alla carica ionica. Per esempio -1 per Cl-, +2 per Ca2+ 3) Alcuni elementi mantengono costante il loro numero di ossidazione in tutti i composti che formano, mentre altri lo variano da un composto all’altro. In particolare: L’idrogeno nei composti ha sempre numero di ossidazione +1 (-1 negli idruri) L’ossigeno nei composti ha sempre numero di ossidazione -2 (-1 nei perossidi) Composti con L’idrogeno Alogeni + H2 Metalli + H2 idruri Idracidi Composti binari con idrogeno IONICI (idrogeno ed elementi del I° e II° gruppo) NaH CaH2 IDRURO DI _______________ COVALENTI (idrogeno ed elementi del VI° e VII° gruppo HF HCl H2S Fluoruro di idrogeno Cloruro di idrogeno Solfuro di idrogeno H2O NH3 ACQUA AMMONIACA Acido fluoridrico Acido Cloridrico Acido Solfidrico Composti binari con L’ossigeno NM + O2 Metalli + O2 Ossidi Anidridi OSSIDI (o OSSIDI BASICI) OSSIGENO + METALLO Poiché l’ossigeno è molto più elettronegativo dei metalli, tutti gli ossidi sono composti ionici e quindi solidi a temperatura ambiente Nomenclatura tradizionale a) se il metallo ha un solo numero di ossidazione: ossido di + nome metallo es. ossido di sodio Na2O b) se il metallo ha due numeri di ossidazione: ossido + nome metallo con desinenza OSO, per il numero di ossidazione minore. ossido + nome metallo con desinenza ICO, per il numero di ossidazione maggiore. es. ossido ferroso FeO (numero di ossidazione +2) es. ossido ferrico Fe2O3 (numero di ossidazione +3); Nomenclatura ufficiale FeO ossido di ferro (II) Fe2O3 triossido di diferro (III) ANIDRIDI (o OSSIDI ACIDI) OSSIGENO + NON METALLO La differenza di elettronegatività tra l’ossigeno e non metalli è piccola; le anidridi sono quindi composti covalenti più o meno polari, che a temperatura ambiente possono essere solidi, liquidi o gassosi. Nomenclatura tradizionale a) se il non metallo ha un solo numero di ossidazione: anidride + nome nn met con desinenza ICA (es. anidride carbonica CO2) b) se il non metallo ha due numeri di ossidazione: anidride + nome nn met con desinenza OSA, per il numero di ossidazione minore. Ad es. anidride solforosa SO2 (+4); anidride + nome nn met con desinenza ICA, per il numero di ossidazione maggiore. Ad es. anidride solforica SO3 (+6). Nomenclatura ufficiale Anche i composti tra ossigeno e non metalli sono chiamati ossidi; si utilizzano sempre i prefissi relativi al numero di atomi degli elementi. Ad esempio: SO2 biossido di zolfo (+4); SO3 triossido di zolfo (+6) IUPAC OSSIDI: composti binari con ossigeno Quando i due elementi formano più di un composto questi si distinguono usando i seguenti prefissi (IUPAC) 1 2 3 4 5 monobitritetrapenta- 6 7 8 9 10 esaeptaoctanonadeca- Esempi CO CO2 NO2 N 2O 4 ClO2 Cl2O7 Monossido di carbonio Biossido di carbonio Biossido di azoto Tetrossido di diazoto Biossido di cloro Eptossido di dicloro Composti ternari con L’ossigeno NM Metalli + O2 Ossidi + O2 Anidridi +H2O + H2O idrossidi Acido OSSIACIDO ANIDRIDE + ACQUA Acidi Un ossiacido è un acido contenente idrogeno, ossigeno ed un altro elemento (un non-metallo). In acqua un ossiacido produce uno o più ioni H+ ed un ossianione. HNO3 in acqua dà H+ e NO3- Il nome dell’acido si ottiene dalla radice del nome dell’elemento centrale più il suffisso –ico oppure –oso HNO3 Acido nitrico HNO2 Acido nitroso Se l’elemento forma tre o quattro ossiacidi si usano i prefissi ipo– e per- associati con i due suffissi –oso e –ico HClO Acido ipocloroso HClO2 Acido cloroso HClO3 Acido clorico HClO4 Acido perclorico IDROSSIDO OSSIDO + ACQUA Fe(OH)3 Idrossido ferrico Fe(OH)2 Idrossido ferroso Composti ionici Un composto ionico prende il nome dagli ioni che contiene scrivendo prima il catione e poi l’anione NaCl sodio cloruro NaCl cloruro di sodio oppure Uno ione monoatomico è uno ione formato da un singolo atomo Uno ione poliatomico è uno ione costituito da due o più atomi legati chimicamente Na+ Cl- ioni monoatomici NH4+ SO42- ioni poliatomici Sn4+ Pb4+ Bi5+ Gruppi I e II Metalli di transizione Carica dello ione coincidente con il gruppo Na+ Ca2+ ione sodio ione calcio Possono formare cationi con diverse cariche Fe2+ Fe3+ ione ferro (II) o ione ferroso ione ferro (III) o ione ferrico ALCUNI CATIONI formula nome Cr3+ Cromo(III) o cromico Mn2+ Manganese(II) o manganoso Fe2+ Ferro(II) o ferroso Fe3+ Ferro(III) o ferrico Ni2+ Nichel(II) o nichel Cu2+ Rame(II) o rameico Zn2+ Zinco Ag+ Argento Cd2+ Cadmio Hg2+ Mercurio(II) o mercurico Un anione monoatomico prende il nome dall’elemento seguito dal suffisso -uro Cl- cloruro S2- solfuro ma O2- ossido I non metalli formano anioni con carica pari al numero del gruppo meno 8 Cl- VII A 7-8=-1 S2- VI A 6-8=-2 Ioni poliatomici L’unico catione poliatomico di rilievo è: NH4+ ione ammonio La maggior parte degli ioni poliatomici sono ossianioni, contenenti ossigeno più un altro elemento: CO32- ione carbonato SO42- ione solfato I nomi degli ossiacidi e quelli degli ossianioni sono strettamente correlati. Per ottenere il nome dall’ossianione da quello dell’ossiacido si sostituiscono i suffissi –oso con –ito e –ico con –ato: HNO2 Acido nitroso NO2- Ione nitrito HNO3 Acido nitrico NO3- Ione nitrato Acido ipocloroso ClO- Ione ipoclorito HClO2 Acido cloroso ClO2- Ione clorito HClO3 Acido clorico ClO3- Ione clorato HClO4 Acido perclorico ClO4- Ione perclorato HClO ALCUNI IONI POLIATOMICI Nome Formula ___________________________________________________________ Ammonio NH4+ Acetato CH3COO Carbonato CO32 Ipoclorito Clorito Clorato Perclorato ClO ClO2 ClO3 ClO4 Nitrito Nitrato NO2 NO3 Fosfato Solfato Solfito PO43 SO42 SO32 Ossido Idrossido O2 OH Composti binari Composti Ternari
Scaricare