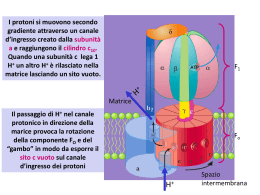
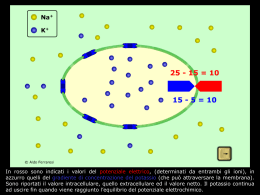
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche FOSFORILAZIONE OSSIDATIVA 4 Modello chemiosmotico Misura del gradiente protonico Disaccoppianti e ionofori IPOTESI CHEMIOSMOTICA (Mitchell, 1961) Il trasporto elettronico e la sintesi di ATP sono accoppiate da un gradiente protonico piuttosto che da un intermedio ad alto contenuto energetico, o da una proteina attivata come era stato ipotizzato fino a quel momento. Questo modello richiede: a) che la membrana mitocondriale interna sia impermeabile agli ioni H+, perchè un compartimento chiuso è essenziale per l’esistenza di un gradiente. b) che i carriers elettronici e l’ATPasi siano organizzati vettorialmente, cioè con un orientamento ben preciso nella membrana mitocondriale interna (reazioni che sottraggono H+ sul lato interno, reazioni che generano H+ sul lato esterno); da: Nelson & Cox MODELLO CHEMIOSMOTICO (Mitchell, 1961) L’energia delle reazioni red-ox è elettrochimica del gradiente protonico. “conservata” nell’energia FORZA MOTRICE PROTONICA per portare i protoni fuori (contro gradiente di concentrazione) occorre energia (ENERGIA DELLE REAZIONI RED-OX) il rientro dei protoni (secondo gradiente di concentrazione) è un processo spontaneo che libera energia ⇒ SINTESI DI ATP POTENZIALE ELETTROCHIMICO ∆µH+ = ∆Ψ + ∆pH ∆Ψ = potenziale di membrana (componente elettrica) ∆pH = differenza di pH (componente chimica) Evidenze sperimentali per l’ipotesi di Mitchell (modello chemiosmotico) 1) Esistenza di un gradiente protonico attraverso la membrana mitocondriale interna che è stato misurato sperimentalmente. 2) Se, in assenza di trasporto di elettroni (e quindi di substrati ossidabili), si impone artificialmente un gradiente protonico ai mitocondri, questi sintetizzano ATP. 3) E’ nota l’esistenza di una proteina della membrana purpurea di un alobatterio (BATTERIORODOPSINA) in grado di pompare protoni quando viene colpita dalla luce. Vescicole sintetiche che contengono questa proteina batterica e una ATP sintasi mitocondriale purificata sintetizzano ATP quando vengono illuminate. La RODOPSINA in questo caso sostituisce la CATENA RESPIRATORIA. Questo dimostra che la C.R. e l’ATP sintasi sono due sistemi separati, legati solo da un gradiente protonico 4) Sia i carriers elettronici che l’ATPasi sono organizzati vettorialmente, cioè con un orientamento ben preciso nella membrana mitocondriale interna (reazioni che catturano H+ sono localizzate sul lato interno, reazioni che generano H+sul lato esterno) SECONDO IL MODELLO CHEMIOSMOTICO La fosforilazione di ADP → ATP è accoppiata al trasporto di elettroni DIMOSTRAZIONE 1 Mitocondri isolati in presenza di substrati ossidabili e O2 producono ATP 1 NADH + H+ → 2.5 ATP 1 FADH2 → 1.5 ATP 2 fosforilazione di ADP → ATP e trasporto di elettroni sono accoppiati; l’inibizione di uno dei due processi deve ripercuotersi sull’altro: inibitori della catena respiratoria abbassano la produzione di ATP, mentre inibitori della sintesi di ATP a livello di ATP sintasi bloccano il trasporto di elettroni. 3 trattamenti fisici e/o chimici disaccoppiano i due sistemi (trasporto di elettroni e sintesi di ATP): • rottura della membrana (i frammenti di membrana sono ancora capaci di trasferire elettroni ma non c’è sintesi di ATP). • disaccoppianti e ionofori : 2,3 dinitrofenolo (DNP), valinomicina L’energia rilasciata dall’ossidazione dei coenzimi ridotti viene utilizzata inizialmente per generare un gradiente protonico che è utilizzato poi per la sintesi di ATP e il trasporto di metaboliti attraverso la membrana mitocondriale interna Come si può quantificare un gradiente protonico? da: Nelson & Cox ∆ pH ≈ 0.75 ∆ Ψ ≈ 0.15 V ∆ µ (gradiente protonico) = ∆ pH + ∆ Ψ MISURA DEL POTENZIALE ELETTROCHIMICO .1 ∆G = RT ln c2ext / c2int + z F ∆Ψ variazione di energia libera che accompagna la formazione di un gradiente elettrochimico da parte di una pompa ionica c2 / c1 = rapporto di concentrazione dello ione z = carica (1 per il protone) ∆Ψ = differenza di potenziale elettrico transmembrana misurato in volt. ln(c2 / c1) = 2.3 (log[H+]P – log[H+]N ) = 2.3 (pHN – pHp) = 2.3 ∆pH ∆G = 2.3 RT ∆pH + F ∆Ψ (A) Poiché il pH esterno è minore del pH interno,il pompaggio di protoni fuori dalla matrice mitocondriale (contro il gradiente protonico) è un processo endoergonico. Infatti, entrambi i termini sul lato destro dell’equazione (A) hanno valore positivo per cui il ∆G è + quando i protoni fluiscono spontaneamente nella direzione del gradiente elettrochimico una quantità di energia potenziale pari a ∆G diviene disponibile per compiere un lavoro chimico ⇒ FORZA MOTRICE PROTONICA. MISURA DEL POTENZIALE ELETTROCHIMICO.2 ∆pH ≈ 0.75 unità(matrice alcalina) ∆Ψ ≈ 0.15 – 0.2V ( negativo all’interno),dipende dai tessuti sostituendo in (A) si ottiene ∆G = ∼ 20 KJ/mole di H+ ; Trasporto di H+ :∼ ∼10/NADH; per 10 H+ pompati ⇒ ∆G ≈ 200 KJ (quasi tutti i 220 KJ/mole rilasciati dalla ossidazione di 1 NADH). Sperimentalmente si è visto che 4 H+ che rientrano attraverso il canale F0 dell’ATP sintasi (c. V) sono necessari per la sintesi di 1mole di ATP ,di cui 1 è usato per il trasporto del Pi attraverso la m.m.i. La forza motrice protonica permette il trasporto attivo di substrati e precursori ATRATTILOSIDE X ATP sintasi 3 3 La stechiometria della reazione di consumo di ossigeno e di sintesi di ATP secondo il modello dell’accoppiamento chemiosmotico x ADP + x Pi +1/2 O2 + NADH + H+ x ATP + H2O + NAD+ x = rapporto P/O (ossia quanto P è consumato per O ridotto) Qual è il valore del rapporto P/O? Misurare il P/O richiede misurare i flussi protonici attraverso la membrana mitocondriale: è tecnicamente complicato (capacità tamponante dei mitoc., perdita non produttiva di H+, uso del gradiente protonico per funzioni diverse dalla sintesi di ATP) Si è stabilito che il numero di H+ pompati fuori per coppia di elettroni trasferiti è 10 per il NADH e 6 per il succinato (FADH2). Il numero di H+ che rientrano per la sintesi di 1 ATP è 4 H+ ( 1 H+ è usato per il trasporto di Pi all’interno dei mitocondri). quindi 10 H+ / 4H+ = 2.5 ATP per 1 NADH 6 H+ / 4H+ = 1.5 ATP per 1 succinato (FADH2) rapporto P/O SOLUBILI NEI LIPIDI Il gradiente protonico può essere annullato parzialmente o completamente da alcune sostanze come gli ionofori e i disaccoppianti. Ioni (H+, K+, Na+…) sono insolubili nella membrana lipidica:possono entrare attraverso composti liposolubili DISACCOPPIANTI DNF trasportano H+ all’interno dei mitocondri FCCP ∆ µ = ∆ pH + ∆ Ψ CCCP IONOFORI valinomicina → K+ (int) nigericina gramicidina A (est) H+ ∆ µ = ∆ pH + ∆ Ψ K+ (int) K+, Na+, H+ ∆ µ = ∆ pH + ∆ Ψ ∆ µ = ∆ pH + ∆ Ψ La gramicidina A è un antibiotico che forma nella m.m.i. un canale permeabile a cationi monovalenti. Disaccoppianti : nel grasso bruno → calore; → dimagranti AZIONE DEL 2,4 DINITROFENOLO: acido debole idrofobico H+ Lato acido= spazio intermembrana + + + + - + + + + + + - H+ Lato alcalino= matrice mitoc. 2,4 dinitrofenolo:un disaccoppiante della fosforilazione ossidativa mitocondriale. In sua presenza,nei mitocondri isolati, il trasporto di elettroni prosegue, la respirazione viene stimolata ma la sintesi di ATP si blocca. DIMOSTRAZIONE FUNZIONALE DELL’ACCOPPIAMENTO OXPHOS da: Nelson & Cox I MITOCONDRI DISACCOPPIATI PRODUCONO CALORE La proteina UCP1 (uncoupling protein 1),detta anche termogenina, presente nei mitocondri del tessuto adiposo bruno,forma un canale che permette l’ingresso di protoni nella matrice mitocondriale senza passare dall’ATP sintasi :l’energia che si libera dall’ossidazione degli acidi grassi sotto forma di NADH viene dissipata sotto forma di calore. Questo calore contribuisce per es. a mantenere costante la temperatura corporea degli animali in letargo. Importanza centrale del gradiente protonico nel fornire l’energia per diverse attività cellulari Trasporto di ADP e ATP Sintesi di ATP Trasporto di Ca2+ Trasporto di fosfato, acidi dicarbossilici e tricarbossilici ∆µH+ gradiente di membrana calore Rotazione dei flagelli dei batteri L’energia del gradiente protonico è usata anche per il trasporto di metaboliti contro gradiente di concentrazione Parte dell’energia conservata nel gradiente protonico è utilizzata per questi scopi, per cui 2,5 molecole di ATP sono il limite massimo per ogni NADH riossidato M.Roberti
Scaricare