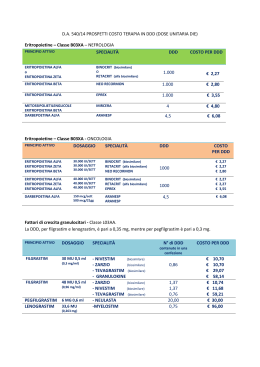
Lo scenario Epoetina alfa Epoetina beta Epoetina zeta E S A Darbepoetina (Novel Erythropoietin Stimulating Protein ) Metossipolietilenglicole epoetina (Continous Erythropoietin Receptor Activator ) Metossipolietilenglicole epoetina Continous Erythropoietin Receptor Activator MIRCERA® PRINCIPI ATTIVI NON SOGGETTI A NOTE AIFA PRESCRIVIBILI CON PIANO TERAPEUTICO come da determinazioni AIFA pubblicate sulla G.U. PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI ERITROPOIETINE (ex NOTA 12) Centro prescrittore …… Nome cognome del clinico prescrittore...…………. Recapito telefonico………………………………… e-mail………… Paziente (nome,cognome) ……………………data di nascita sesso M ! F ! codice fiscale …………………………………… Residente a …………………………Tel………………………… Regione……………………… ASL di residenza ……………Prov Medico di Medicina Generale………………………………………… 5 La prescrizione di eritropoietine è a carico del SSN per le seguenti condizioni cliniche: Trattamento dell’anemia (HB<11 g/dL e suo mantenimento tra 11 e 12 g/ dL) associata ad IRC in pazienti adulti e in soggetti pediatrici* sia in trattamento dialitico che in trattamento conservativo Principi attivi: eritropoietina alfa, eritropoietina beta , darbepoietina alfa, eritropoietina zeta, metossipolietilenglicole eritropoietina beta Trattamento dell’anemia (HB<11 g/dL e suo mantenimento tra 11 e 12 g/ dL ) associata ad IRC in pazienti adulti * sia in trattamento dialitico che in trattamento conservativo Principi attivi: metossipolietilenglicole- eritropoietina beta Trattamento dell’anemia (HB<10 g/dL ) in pazienti adulti oncologici che ricevono chemioterapia antiblastica; in caso di Hb<8 g/dL è indicato il ricorso all’emotrasfusione. Principi attivi: eritropoietina alfa, eritropoietina beta , eritropietina zeta, (*per darbepoietina sono disponibili dati in età pediatrica solo con pazienti con età<11 anni) Trattamento dell’anemia sintomatica in pazienti adulti affetti da neoplasie non mieloidi che ricevono chemioterapia. Principi attivi: darbepoietina alfa Trattamento per incrementare la quantità di sangue autologo nell’ambito dei programmi di predonazione con le limitazioni previste in scheda tecnica. Principi attivi: eritropoietina alfa, eritropoietina beta, , eritropoietina zeta FARMACO PRESCRITTO 5 eritropoietina alfa 5 eritropoietina beta 5 darbepoetina alfa 5 eritropoietina zeta 5 metossipolietilenglicole – eritropoietina beta Dosaggio:…………………………… Durata prevista del trattamento:………………………. Indicare se: 5 Prima prescrizione 5 Prosecuzione della cura Data ___/____/____ Timbro e firma del clinico prescrittore BIOSIMILARI Farmaci “copia” o “ diversi”? La Commissione, ha ritenuto i dati clinici sufficienti per l’introduzione del farmaco in PTORV, seguendo la linea proposta dall’AIFA di non permettere la sostituibilità in automatico. Sarà, infatti, giudizio del medico, ricorrere alla possibilità di sostituire il farmaco in base alla situazione clinica; secondo AIFA tale prudenza, tuttavia, appare non giustificata nei pazienti naive, essendo il farmaco biosimilare rispondente a requisiti di sicurezza ed efficacia. La Commissione ritiene di inserire il farmaco in PTORV in considerazione dei potenziali vantaggi in ambito economico. 843 € 1200 € 1624 € 1700 € Epoetina zeta (RETACRIT) 150 UI /kg x 3 900 € volte alla settimana 450/U.I/kg 1 volta a 780 € settimana
Scaricare