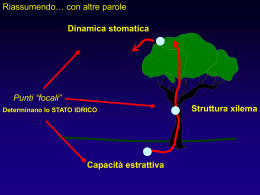
Review n. 9 – Italus Hortus 16 (1), 2009: 23-44 Meccanismi fisiologici e molecolari di resistenza a stress idrico in Vitis vinifera L: aspetti del metabolismo primario e secondario e adattamenti di genotipi diversi Alessandra Ferrandino, Irene Perrone, Sara Tramontini e Claudio Lovisolo* Dipartimento Colture Arboree, Università di Torino, via Leonardo da Vinci 44, Grugliasco (TO) Ricezione: 28 novembre 2008; Accettazione: 12 gennaio 2009 Physiological and molecular mechanisms of resistance to drought in Vitis vinifera L: aspects of primary and secondary metabolisms and adaptation of genotypes Abstract. In this review, we address the main aspects of grapevine (Vitis vinifera L.) resistance to water stress. We point to examine physiological and molecular answers, involving both primary and secondary metabolisms. The grapevine has been generally classified as drought-avoiding or as “pessimistic” following the ecological classification of plants into “pessimists” and “optimists”, even if different grapevine cultivars show different behaviours of defence against drought. This ecological classification is analogous to the physiological classification into isohydric and anisohydric plants and fundamentally linked to stomatal behaviour. Stomatal regulation of grapevine is under hormone (ABA) and hydraulic control, the latter linked to embolism formation and recovery in xylem tissues up-stream the stomata. We review ABA effects on stomata, and their interrelationship with hydraulics of the plant. To this aim, we show that in grapevine, xylem embolism occurs and repairs during diurnal cycles, extreme water potential causing embolism, whereas an almost full recovery of water potential is needed to promote repair mechanisms. In this phase, an ABA-induced transpiration control is proposed. Aquaporins play fundamental role on water stress control, and both early or late contribution (especially in root) are discussed. When droughtavoidance mechanisms are limiting in further plant dehydration avoidance (earlier in anisohydric varieties, but in all grape cultivars during late and/or severe drought stages) metabolic mechanisms of dehydration tolerance arise. In all tissues solutes accumulate to prevent water loss, by minimizing interferences with cellular function. Grapevines accumulate one or more types of compatible solutes (osmotic adjustment). Metabolite profiling reveals that there are higher concentrations of glucose, malate, proline, phenolics and flavour precursors upon water stress. The metabolite differences are linked to differences in transcript * [email protected] abundance of many genes involved in energy metabolism, particularly photosynthesis and photorespiration. Droughted grapevines appear to have a higher demand than non-stressed plants to detoxify free radicals (reactive oxygen species), and to cope with photoinhibition. Results of these defence strategies accumulate in berries, during the ripening period, and are at the base of grape quality. Berry metabolites accumulated in several cultivars, as a response of controlled levels of water stress applied to the grapevine, are shown. Berry (skin, pulp and seed) phenolic fractions and flavours are reviewed and linked to perturbations of their molecular pathways, when known. Physiological, molecular and metabolic peculiarities genotype-specific are underlined. Future perspectives of research on the reviewed topic are proposed, as focused on the interrelationship between ABA metabolism and molecular aspects of water control (aquaporins). Key words: aquaporin, abscisic acid (ABA), phenolics, flavour, transcriptomics. Introduzione La vite è la pianta da frutto più diffusa al mondo, sia in termini di produzione che di valore economico (66.271.676 Mt prodotte su 7.501.872 ha nel 2007, da FAOSTAT, http://faostat.fao.org/). Si tratta di una coltura per tradizione non irrigua, diffusasi su un’ampia area, anche in presenza di ecosistemi aridi e semiaridi. Il rendimento produttivo e qualitativo della vite, da cui dipende la sua importanza economica, è strettamente legato all’adattabilità di questa coltura alla siccità. Per la vite lo stress idrico non va pertanto esclusivamente considerato in termini negativi, se correttamente gestito. Il controllo del livello di stress è infatti alla base di pratiche agronomiche affermate – uso del portinnesto, inerbimenti e lavorazioni controllati, tecniche irrigue di soccorso quali la RDI, regulated deficit irrigation (Keller, 2005), o la PRD, partial rootzone drying (Dry e Loveys, 1999) – per inibire la crescita vegetativa della pianta a vantaggio della qua- 23 Ferrandino et al. lità del frutto. Lo stress idrico moderato sembra inoltre promuovere la colonizzazione radicale da parte di funghi micorrizici arbuscolari (Schreiner et al., 2007). In queste pagine verranno approfonditi alcuni aspetti della resistenza di Vitis vinifera a condizioni di carenza idrica, con particolare attenzione alle risposte ecofisiologiche e molecolari legate al metabolismo primario e secondario, soprattutto a livello di bacca. Nell’ultima parte saranno presi in esame gli aspetti legati alle peculiarità varietali, a tutti i livelli d’indagine considerati e fino ai più recenti risultati pubblicati. Meccanismi di elusione o tolleranza dello stress idrico Come schematizzato in figura 1, il deficit idrico produce svariate reazioni, a seconda che agisca nel breve o nel lungo periodo. Nel primo caso, può favorire la chiusura degli stomi, idropassiva ed idroattiva (quest’ultima controllata dall’acido abscissico), limitante la fotosintesi, l’abscissione fogliare e la rottura della colonna d’acqua sotto tensione nello xilema (cavitazione). Nel secondo caso, può frenare lo sviluppo dell’area fogliare complessiva, agendo su numero e dimensioni delle foglie, stimolare l’estensione dell’apparato radicale, provocare la sintesi di una spessa cuticola sulla superficie fogliare (Kramer e Boyer, 1995). La vite bilancia lo stress idrico, per lo più prodotto da condizioni di siccità, eccessiva salinità e gelo, con un meccanismo di resistenza composto di elusione/tolleranza allo stress (da una definizione di Levitt, 1972). Con l’elusione la pianta tenta di mantenere un alto potenziale idrico anche quando è sottoposta a condizioni di aridità. Quando questa condizione non può più essere mantenuta e i tessuti soffrono lo stress idrico, la pianta reagisce o mantenendo alto il contenuto idrico dei tessuti o tollerandone l’abbassamento. L’elusione agisce nel breve periodo sulla chiusura della rima stomatica e nel lungo su altri meccanismi capaci di influenzare più o meno direttamente la gestione della riserva idrica a disposizione della pianta. Nel lungo periodo, perciò, si possono osservare crescita degli elementi sotterranei (Soar e Loveys, 2007) e abscissione volontaria delle foglie (con incremento del rapporto radici/fusto), modifiche dell’orientamento fogliare (Palliotti et al., 2008), variazioni dei pigmenti fotosintetici, di dimensione e densità degli stomi (Gomez-Del-Campo et al., 2003) e degli elementi xilematici (Lovisolo e Schubert, 1998), incremento della capacità di immagazzinamento dell’acqua nei tessuti (Patakas e Noitsakis, 1999), riduzione di superficie e spessore fogliare (diretta conseguenza delle limitazioni a divisione ed espansione cellulare), 24 inspessimento della cuticola, aumento della pubescenza, variazioni nell’elasticità della parete cellulare (Patakas e Noitsakis, 1997), variazioni della composizione lipidica della foglia (Toumi et al., 2008) e variazioni nella permeabilità idrica della superficie fogliare (Keller, 2005). In tal modo e per condizioni di siccità temporanee o leggere, l’elusione può da sola garantire le performances della pianta. Quando poi lo stress si acutizza, la regolazione della fotosintesi è determinata da meccanismi non stomatici: principalmente dalla riduzione dell’attività fotochimica, dalla depressione dell’attività degli enzimi fotosintetici, dall’abbassamento della conduttanza del mesofillo e del tasso di trasporto elettronico sulla membrana del tilacoide e dalla ridotta capacità di rigenerazione della RuBisCO (Medrano et al., 2003). Oltre una certa soglia di stress, però, la pianta deve contare sulla propria tolleranza alla disidratazione. I diversi eventi molecolari e le corrispondenti risposte metaboliche della pianta allo stress non possono essere classificati come solo di tolleranza o solo di elusione, poiché agiscono in un continuum su vari fronti in contemporanea, senza una progressione lineare su durata o intensità dello stress e regolati da un network di risposte complesse (Verslues et al., 2006); tuttavia verranno qui di seguito descritti in paragrafi distinti per favorirne la comprensione. Meccanismi di elusione: la regolazione stomatica La prima reazione della vite allo stress idrico si verifica a livello degli stomi, la cui apertura e chiusura sono regolate attraverso meccanismi di tipo idraulico, ormonale e chimico. Allo scopo, entrano in gioco varie componenti: l’ABA (acido abscissico) inviato dalle radici con il flusso xilematico o redistribuito a livello fogliare, la domanda evaporativa, l’efficienza traspirativa, la formazione di embolismi, la rapidità di crescita fogliare, le componenti esogene origine del deficit, nonché una certa influenza dovuta alla variabilità genetica. Proprio in funzione del comportamento di controllo stomatico, le specie vegetali possono essere classificate come isoidriche o anisoidriche (Tardieu e Simonneau, 1998), riprendendo da un punto di vista fisiologico i concetti ecologici di piante “pessimiste” ed “ottimiste”. In condizioni limitanti, le prime tendono a modificare crescita e fisiologia per salvaguardare il più a lungo possibile il proprio stato idrico e le temporanee risorse, mentre le seconde a subire gli stress senza evidenti reazioni di controllo del contenuto d’acqua nei tessuti. Il meccanismo isoidrico, tipico delle piante ecologicamente “pessimiste”, agisce sotto stretto controllo stomatico. Meccanismi di resistenza a stress idrico della vite Fig. 1 - Meccanismi di elusione o tolleranza dello stress idrico: il deficit idrico produce svariate reazioni, a seconda che agisca nel breve o nel lungo periodo. Fig. 1 - Avoidance and tolerance of water stress in the grapevine: different responses are related to short or long term strategies. La vite è stata genericamente classificata come specie isoidrica, capace di elevata regolazione stomatica sotto il controllo di segnale ABA, tuttavia esiste una diffusa variabilità varietale che determina scostamenti anche considerevoli da questo tipo di comportamento. Il delicato meccanismo di regolazione stomatica che nella vite si attiva in risposta a condizioni di moderate carenze idriche del suolo fa della conduttanza stomatica stessa un indicatore dello stress idrico più preciso e sensibile di altri parametri di misura delle relazioni idriche (Cifre et al., 2005), primo fra tutti il potenziale idrico. 25 Ferrandino et al. La regolazione stomatica influenza direttamente l’assimilazione della CO2 fotosintetica. È probabile che, in condizioni di moderato stress idrico, la fotosintesi nella vite venga depressa quasi esclusivamente a livello degli stomi, a conferma dell’incremento di efficienza intrinseca nell’uso dell’acqua, cosa per altro presumibilmente comune a varie specie vegetali. In condizioni più limitanti, però, l’inibizione della fotosintesi è provocata da fattori non direttamente legati all’attività delle cellule di guardia (Flexas et al., 2004). Sebbene, infatti, l’effetto stomatico giochi un ruolo determinante nella risposta della vite allo stress idrico, è stato dimostrato come effetti permanenti non stomatici divengano più importanti mano a mano che le condizioni ambientali si fanno più limitanti (Escalona et al., 1999). L’acido abscissico. Gli stomi si chiudono per induzione ormonale originata dalle radici le quali, in penuria d’acqua, inviano messaggeri biochimici, in particolare l’ABA, verso gli organi fogliari attraverso il flusso di linfa grezza del legno. L’ABA, in sinergia con la concentrazione cellulare di ioni Ca2+, ha un effetto stimolante sulle strutture radicali, mentre su quelle stomatiche favorisce la chiusura delle cellule di guardia (Quintero et al., 1999), e non produce nessun effetto su sviluppo e funzionalità idraulica dei tessuti xilematici (Lovisolo et al., 2002). In presenza di stress idrico, l’ABA è ridistribuito nella foglia a seguito dell’alcalinizzazione del succo xilematico. In condizioni naturali, infatti, il succo xilematico è debolmente acido, cosa che favorisce l’assorbimento della forma indissociata di ABA (ABAH) da parte delle cellule del mesofillo. Al verificarsi dello stress, il succo xilematico diventa debolmente alcalino, favorendo la dissociazione dell’ABAH in ABA-, che non permea la membrana cellulare. Di conseguenza le cellule del mesofillo assorbono meno ABA, rendendone disponibile una quantità maggiore che raggiunge le cellule di guardia, dotate di canali ionici specifici. Gli effetti del segnale di ABA sono avvertiti dagli stomi della vite non solo in stress idrico (vedi bibliografia in Lovisolo et al., 2002), ma anche nelle prime fasi della reidratazione, quando i flussi xilematici dilavano l’elevato ABA residuo radicale e lo trasportano verso le rime stomatiche (Lovisolo et al., 2008a). L’importanza della relazione tra ABA, conduttanza stomatica e stato idrico della pianta (potenziale idrico) si può evincere da un modello di simulazione (Tardieu, 2003) col quale è stato confrontato il comportamento di quattro genotipi virtuali che presentino differenti abilità nella sintesi di ABA in condizioni di 26 stress idrico. Nel virtuale wild type il potenziale idrico fogliare non varia nella prima settimana di carenza d’acqua per poi decrescere progressivamente fino a -1,5 MPa nelle successive due settimane, secondo un trend piuttosto comune in differenti esperienze reali su vite. Al contrario, il potenziale quasi non varia in un genotipo virtuale capace di un tasso di sintesi ABA doppio, mentre crolla in cinque giorni o in due giorni a -2,0 MPa in due genotipi virtuali la cui sintesi di ABA è rispettivamente la metà o un quinto del controllo wild type. Formazione e recupero degli embolismi. L’ABA sintetizzato in condizioni di stress idrico, e più in generale i segnali di tipo chimico, controllano però solo parzialmente la risposta stomatica nella vite: sembrano essere i segnali di tipo idraulico i primi ad essere avvertiti (Rodrigues et al., 2008). La struttura dello xilema garantisce una semplice via di transito a bassa resistenza attraverso cui l’acqua può muoversi liberamente in risposta a gradienti di pressione o tensione, richiedendo una forza motrice 1010 volte inferiore rispetto a quella necessaria a spostare l’acqua attraverso la cellula. Struttura e dimensioni delle diverse subunità xilematiche, poi, sono determinanti nell’efficienza della conduttività (Lovisolo e Schubert, 1998). L’acqua scorre all’interno dello xilema in minima parte sospinta dalla pressione radicale positiva (quasi solo al germogliamento) ed in massima parte attirata verso l’apice dalla forte pressione idrostatica negativa (tensione) che la traspirazione produce. Quest’elevata tensione, che tenderebbe a far collassare gli elementi di trasporto, viene sopportata grazie alla lignificazione dei tessuti vasali, ma con un’importante conseguenza sul liquido: favorisce la separazione dei gas che vi sono disciolti. È così che si formano le bolle di gas all’interno dei tessuti xilematici per il fenomeno detto di cavitazione. Secondo l’ipotesi più accreditata (Zimmermann, 1983), i gas che penetrano nei condotti xilematici attraverso i micropori, una volta all’interno, produrrebbero la perdita di coesione fra le molecole d’acqua. Questo meccanismo è frequente e minimizzabile dalla pianta: infatti i piccoli pori che connettono le varie unità costituenti dello xilema impediscono alla bolla di espandersi all’infinito, grazie alla tensione superficiale che l’acqua adiacente oppone a questo livello. Se la vite non è in grado di evitare l’embolizzazione, ha i mezzi per limitare il fenomeno: l’embolizzazione, infatti, causa in primo luogo una riduzione della conduttività idraulica, che a sua volta, limitato il flusso idrico, provoca la chiusura degli stomi Meccanismi di resistenza a stress idrico della vite (Schultz, 2003). Ne risultano un abbassamento dell’efficienza traspirativa, quindi della tensione di suzione dell’acqua e, in ultima analisi, delle condizioni favorevoli al (ri-)verificarsi dell’evento. Esistono poi vie alternative, fornite dai capillari vicini e comunicanti, che permettono al flusso idrico di proseguire aggirando l’ostacolo, e meccanismi di recupero dell’embolismo. Inoltre, quando durante le ore pomeridiane e la notte la traspirazione si riduce, anche la tensione dello xilema scende e i gas sono riassorbiti, almeno parzialmente, nel liquido circolante. La dinamica di recupero degli embolismi nella vite segue un modello proposto di recente (Lovisolo et al., 2008a) secondo tre punti principali: i) il recupero avviene in primo luogo a livello di fusto e poi in radice e piccioli fogliari, ma solo a seguito di risalita del potenziale idrico; ii) il recupero avviene anche durante le ore del giorno, mentre la vite traspira; ma iii) la traspirazione nelle fasi di recupero è ridotta da un segnale di ABA, residuale dello stato di stress. Ruolo delle acquaporine. L’acqua si muove all’interno delle strutture vegetali attraverso tre diverse vie: apoplastica, simplastica e transmembrana. La via apoplastica individua il passaggio del liquido attraverso il continuum di pareti cellulari e spazi aeriferi intercellulari che incontra nei tessuti della pianta, senza penetrare la membrana cellulare. Questo tipo di trasporto è guidato da forze fisiche e regolato principalmente da differenze di potenziale tra suolo, pianta e atmosfera (Lovisolo et al., 2002). La via transmembrana, con cui l’acqua attraversando il citoplasma percorre almeno due volte, in entrata ed in uscita la membrana e la via simplastica, creata dai plasmodesmi quale passaggio preferenziale fra due cellule contigue, sono invece difficilmente distinguibili sperimentalmente e comunemente riunite sotto la più ampia definizione di via cellulare (Steudle, 2000). La conduttanza della via cellulare è fortemente influenzata dalla presenza e attività delle acquaporine (Vandeleur et al., 2008). Un aspetto interessante delle acquaporine vegetali consiste nella loro abbondanza e complessità: basti pensare che solo in Vitis sp. ne sono state identificate 28, attraverso analisi del genoma sequenziato (Fouquet et al., 2008). Come già accennato, è intuitivo arrivare a comprendere l’importanza fisiologica che le acquaporine sono in grado di rivestire per le piante, in tutti i processi fondamentali in cui entra in gioco il trasporto idrico, dall’assorbimento radicale, alla crescita cellulare (Maurel et al., 2008), alla traspirazione e al controllo dell’embolizzazione (Kaldenhoff et al., 2008). Il fatto che queste proteine facilitino il flusso di molecole d’acqua attra- verso la membrana, non è, di per sé, garanzia di un miglior funzionamento del sistema: piante di tabacco in cui la sintesi di una specifica acquaporina, precisamente la PIP1, era stata geneticamente incrementata, hanno mostrato sì un aumento di efficienza fotosintetica e traspirativa, ma anche di velocità di appassimento (Aharon et al., 2003). Questi risultati possono essere interpretati come utili delucidazioni sulle reciproche proporzioni entro cui l’acqua utilizza nella pianta il cammino endo- ed esocellulare. Se quest’ultimo, infatti, è strettamente governato da forze fisiche, controllato dai salti di energia potenziale esistenti fra suolo, pianta e atmosfera e stimolato dalla traspirazione, il primo dipende prevalentemente da numero e funzionalità delle acquaporine. Una pianta con “troppi” canali per l’acqua, come osservabile in individui mutanti, potrebbe traspirare di più, producendo un flusso idrico di maggior portata; in tal caso, all’alta traspirazione corrisponderanno un’elevata fotosintesi e un aspetto vigoroso. Un sistema così esigente non è però sempre in grado di far fronte a condizione di stress idrico e/o salino. Il mezzo con cui questi canali facilitano il flusso dell’acqua è la riduzione dell’energia di attivazione per il trasporto. Le molecole d’acqua che utilizzano questo cammino preferenziale, infatti, possono superare l’alta barriera energetica prodotta dall’acqua incanalata all’interno della fase idrofobica del doppio strato fosfolipidico attraverso un flusso passivo. Se la funzionalità delle acquaporine viene meno, l’energia di attivazione cresce immediatamente, secondo un effetto che può essere provocato artificialmente ricorrendo all’uso di reagenti mercuriali. Il mercurio interagisce con i legami solfidrilici presenti nella struttura proteica e dovuti ai residui di cisteina, posti in specifici punti della molecola. Il blocco così ottenuto è reversibile per somministrazione di composti riducenti, come il ß-mercaptoetanolo. L’utilizzo di queste sostanze presenta però dei limiti: prima di tutto, la sensibilità agli agenti mercuriali non è una caratteristica comune a tutte le acquaporine, mentre lo è ad altri trasportatori di membrana; poi, il mercurio produce una serie di effetti negativi, come la depolarizzazione delle membrane e l’inibizione del metabolismo in generale, non sempre riconoscibili e quantificabili (Tyerman et al., 2002). Ciononostante, continua ad essere un utile supporto in indagini sperimentali su tessuti e organismo. In vite, l’uso del mercurio ha dimostrato che il recupero degli embolismi necessita di apporto metabolico e non si verifica se l’attività cellulare, e quella delle acquaporine, viene inibita (Lovisolo e Schubert, 27 Ferrandino et al. 2006). Inoltre, a livello radicale, ha permesso di suggerire che i portinnesti ibridi di Vitis rupestris conferiscono resistenza a stress idrico maggiore che gli ibridi di Vitis riparia, grazie ad un miglior controllo dell’embolizzazione (Lovisolo et al., 2008b). Il ruolo delle acquaporine è nella vite funzione del tipo di tessuto, dello stadio di sviluppo e delle condizioni ambientali (Galmés et al., 2007): in effetti, la permeabilità all’acqua, può essere anche una caratteristica che la pianta rifugge, come avviene in caso di condizioni idriche limitanti. Per far fronte alle esigenze ambientali, l’attività dei canali per l’acqua è regolata in fase di trascrizione genica in funzione di messaggi di tipo ormonale (Kaldenhoff et al., 2008), e a livello post-traduzionale attraverso reazioni di fosforilazione e defosforilazione (Maurel et al., 2008). L’espressione di alcuni geni è stimolata dalla siccità e dagli stress salini (Yamada et al., 1997) mentre, per altri, non subisce alcuna influenza di tipo ambientale. In condizioni avverse, la capacità delle cellule radicali di interrompere chimicamente questo flusso transmembrana preferenziale potrebbe essere un mezzo per limitare le perdite d’acqua, quando il potenziale idrico del suolo è inferiore a quello delle radici (Martre et al., 2001). Considerando che nelle radici la conduttività idraulica del trasporto attraverso le strutture cellulari (perciò tramite le vie transmembrana e simplastica) è circa tre volte quella della via apoplastica (Siefritz et al., 2002), l’importanza del suddetto meccanismo risulta evidente. Non si può infine escludere che le acquaporine seguano speciali modelli d’espressione spaziali e temporali la cui attivazione, indotta da stress abiotici, si verifica solo in specifici tessuti e fasi di sviluppo (Aharon et al., 2003). Le acquaporine della vite vengono differentemente espresse e/o attivate in condizioni di stress idrico, come discusso più avanti. Meccanismi di tolleranza dello stress idrico Lo stress idrico limita la fotosintesi non soltanto attraverso la chiusura degli stomi, ma anche causando alterazioni metaboliche dell’apparato fotosintetizzante, tanto più evidenti quanto più lo stato di stress si protrae nel tempo (Escalona et al., 1999; Chaves, 2002). Nella vite la regolazione non stomatica della fotosintesi in condizioni di severo stress idrico è evidenziata da parecchi indizi. All’aumentare della carenza idrica, il corrispondente calo nei parametri fotosintetici (assimilazione netta di CO2, assimilazione in condizioni ottimali di luce e di CO2, tasso di trasporto elettronico, efficienza di carbossilazione) è infatti molto inferiore alla diminuzione di conduttanza 28 stomatica (Cifre et al., 2005). Inoltre, in condizioni colturali tipiche, lo stress idrico si associa spesso ad alte temperature ed irraggiamento, condizioni che esasperano fotorespirazione e fotoinibizione (Gamon e Pearcy, 1990 a, b). La prima, insieme a retroregolazione del fotosistema II e assimilazione fotosintetica di CO2, contrasta l’eccessiva fotoriduzione di O2, e perciò il danno ossidativo a membrane cellulari e apparato fotosintetico, causato dalle specie attive dell’ossigeno prodotte durante il ciclo perossidatico di Mehler-Asada, di cessione di elettroni all’ossigeno (Osmond et al., 1997; Asada, 1999). Efficienza ed efficacia del meccanismo fotorespirativo e perciò resistenza della pianta alle condizioni di stress, sembrano essere in V. vinifera strettamente dipendenti dal tipo di cultivar in esame (Guan et al., 2004). La seconda invece è conseguenza del danneggiamento dell’apparato enzimatico fotosintetico prodotto da un eccesso di fotoni e porta a una riduzione dell’efficienza fotochimica e perciò della capacità fotosintetica della pianta (Long et al., 1994). Per altro, data la particolare efficienza in V. vinifera di fotosintesi e fotorespirazione nel dissipare l’energia in eccesso (Medrano et al., 2002) e trattandosi di un meccanismo largamente studiato in condizioni controllate, perciò di ancor dubbia significatività per le piante in campo (Bertamini e Nedunchezhian, 2002), una stretta causalità e/o sinergia tra danni da stress idrico e fotoinibizione non è certa. A livello cellulare si innescano meccanismi di difesa per evitare la disidratazione cellulare, o per tollerarla. I primi sono alla base della regolazione osmotica, ovvero dell’accumulo di soluti compatibili, che non interferiscono col metabolismo cellulare, ma contribuiscono a mantenere un buon equilibrio osmotico in condizioni di stress (Bertamini et al., 2006). Nella vite, oltre gli zuccheri, è la prolina il più studiato di tali soluti (Keller, 2005, Wada et al., 2008). I meccanismi di tolleranza dello stato di disidratazione ruotano invece intorno alla biosintesi di soluti e/o proteine di protezione (ad es. deidrine, LEA LateEmbryogenesis-Abundant proteins) o di difesa (o detossificazione) dalle specie reattive dell’ossigeno. Tali meccanismi vengono esaminati in vite discutendone le vie biosintetiche nel paragrafo successivo, mentre qui di seguito riportiamo gli effetti metabolici di tali difese nell’acino d’uva. Effetti dello stress idrico sui principali metaboliti secondari della bacca. I primi lavori riguardanti gli effetti del regime idrico sulla qualità dell’uva risalgono agli anni ottanta del secolo scorso. All’epoca l’in- Meccanismi di resistenza a stress idrico della vite teresse era soprattutto focalizzato sullo studio dei parametri base della qualità dell’uva (contenuto zuccherino, acidità, pH) poi, via via, anche grazie all’affinarsi ed alla diffusione di tecniche analitiche più sofisticate ed efficaci, si sono approfonditi gli effetti dello stato idrico della pianta sui metaboliti secondari della bacca, polifenoli ed aromi in particolare. Visto che numerosi metaboliti secondari come i composti di natura fenolica, i carotenoidi, i terpeni, le metossipirazine e altri ancora sono di fatto molecole di protezione di funzioni metaboliche vitali della cellula, la cui concentrazione può variare a seguito di stress biotici e/o abiotici, lo studio delle loro variazioni diventa fondamentale per la valutazione di ciò che è definita come ‘qualità’ dell’uva, che ha necessariamente importanti ricadute applicative a livello di tecnologia della vinificazione e di ‘qualità’ del vino. Polifenoli. Alla fine degli anni ‘80, Matthews e Anderson (1988) in uno studio su Cabernet franc in California misero in evidenza gli effetti del deficit idrico sulla qualità dell’uva, distinguendo gli effetti imputabili all’applicazione di stress idrico in epoca anticipata (prima dell’invaiatura) rispetto a quelli dovuti all’applicazione dello stesso posticipatamente (dopo l’invaiatura). La concentrazione dei polifenoli delle bucce incrementava se la pianta era sottoposta a condizioni di stress idrico, indipendentemente dall’epoca in cui esso veniva applicato; ciò veniva messo in relazione con la diminuzione del volume delle bacche che si registrava in condizione di stress idrico e, quindi, ad un effetto concentrazione legato al decremento della fase solvente nell’acino. Gli stessi autori però rilevavano che, anche quando si esprimevano i polifenoli come quantità per superficie di buccia (e quindi si escludeva l’effetto concentrazione dovuto alla riduzione del volume dell’acino), si registrava comunque un incremento del quantitativo di polifenoli. Il deficit idrico influenzava anche il contenuto di antociani del mosto e del vino e la formazione del colore risultava più rapida durante le prime due settimane dopo l’invaiatura, soprattutto qualora le condizioni di stress idrico fossero applicate in epoca anticipata. Gli effetti dello stress idrico sull’accumulo dei metaboliti secondari della bacca, polifenoli totali e/o antociani, in particolare, furono descritti anche in molti altri lavori su vitigni quali Cabernet Sauvignon (Bravdo et al., 1985; Dry et al., 2001; Kennedy et al., 2002), Cabernet Franc (Matthews et al., 1990), Moscato di Alessandria (Pedreira dos Santos et al., 2007), Sangiovese (Poni et al., 2007). Ampia discussione venne intrapresa a proposito del fatto che il deficit idrico potesse alterare diretta- mente le numerose vie biosintetiche che portano all’accumulo dei diversi metaboliti secondari o se il loro accumulo fosse prevalentemente una conseguenza della riduzione della dimensione delle bacche. Maggiori elementi di chiarezza a proposito dell’influenza dello stress idrico sull’accumulo di alcune classi di metaboliti secondari, sulla dimensione degli acini e sulla loro interazione, vennero apportati da Roby e collaboratori (2004). In quell’esperienza, su piante di Cabernet Sauvignon innestate su 110 Richter e sottoposte a condizioni di eccesso di acqua (64 l/pianta/settimana), a condizioni di normalità (32l/pianta/settimana) ed a condizioni di stress (somministrazione di 32/l/pianta/settimana non prima di aver raggiunto -1,5 MPa di potenziale idrico fogliare a mezzogiorno), si rilevò la frequenza delle diverse classi di dimensioni degli acini e si effettuarono determinazioni del contenuto in tannini dei semi ed in tannini e antociani delle bucce per ciascuna classe di dimensione. Il contenuto in tannini dei semi, che aumentava con l’aumento delle dimensioni della bacca, del numero di semi e della massa totale di semi per bacca, risultava inferiore nelle bacche provenienti da piante mantenute in condizioni di stress idrico, rispetto alle altre due tesi; questo aspetto venne spiegato ammettendo l’accelerazione del tasso di degradazione dei tannini durante la maturazione. A conclusioni simili erano in precedenza pervenuti Ojeda e collaboratori (2002) nel caso di uve provenienti da piante di Syrah innestate su Fercal. Anche il contenuto di tannini e di antociani della buccia aumentava con l’aumentare delle dimensioni della bacca, ma la concentrazione di antociani diminuiva con l’aumentare delle dimensioni del frutto. Analizzando il contenuto di tali composti in bucce di bacche aventi la stessa dimensione si verificò che sia le loro quantità sia le loro concentrazioni erano maggiori nelle bacche provenienti da piante sottoposte a stress idrico rispetto ai controlli o alle piante irrigate con il volume di acqua superiore. Roby e collaboratori (2004) spiegarono l’incremento della concentrazione di antociani e proantocianidine della buccia ammettendo che lo stress idrico potesse influire sulla crescita delle cellule della buccia maggiormente di quanto non accadesse a carico delle cellule della polpa, il che portava all’incremento dei quantitativi dei soluti localizzati nella buccia, oltre che ipotizzare un possibile effetto diretto sulla biosintesi dei flavonoidi. Recenti ricerche su Cabernet Sauvignon innestato su 140R hanno dimostrato che l’espressione di alcuni enzimi legati alla via biosintetica dei fenilpropanoidi, risultava incrementata in condizioni di stress idrico sia se esso veniva applicato in epoca anticipata (dal- 29 Ferrandino et al. l’allegagione alla fine dell’invaiatura, 77 giorni dopo la fioritura), sia se esso veniva applicato più tardi dall’invaiatura (77 giorni dopo la fioritura) fino alla raccolta (Castellarin et al., 2007a). Anche il profilo degli antociani risultava influenzato da condizioni di stress idrico in quanto veniva favorito l’accumulo delle antocianine tri-sostituite (delfinina, petunina, malvina) rispetto alle di-sostituite (cianina e peonina). La maggior concentrazione di antociani per acino era strettamente legata all’incremento di espressione degli enzimi della biosintesi dei flavonoidi che si traduce in un reale incremento del loro accumulo e non ad un effetto concentrazione legato alla riduzione del peso della bacca. Lo stress idrico anticipato era in grado non solo di incrementare il quantitativo di antociani alla raccolta, ma anche di anticipare l’accumulo del colore nelle bacche. I meccanismi che sono stati ipotizzati per giustificare l’incremento e l’anticipo dell’accumulo di antociani sono complessi: si è ipotizzato che uno stress idrico prima dell’invaiatura, abbassando il turgore cellulare, possa incrementare l’afflusso di zuccheri e ABA floematici, aumentando il delta di pressione tra sorgenti e sink necessario per attivare i meccanismi di caricamento e scaricamento del floema. La maggior concentrazione di zuccheri a sua volta attiverebbe l’espressione dei trasportatori degli zuccheri e i geni legati al metabolismo dei flavonoidi (Castellarin et al., 2007a). Gli stessi autori su Merlot innestato su SO4 avevano rilevato che, in condizioni di stress idrico, molti geni legati alla biosintesi dei flavonoidi erano sovra-regolati, il che portava ad un significativo incremento del contenuto in antociani e ad un effetto sul loro profilo, non solo aumentando l’incidenza delle antocianine tririspetto alle di-sostituite, come già rilevato dagli stessi autori su Cabernet Sauvignon, ma anche favorendo l’accumulo delle forme maggiormente metilate (malvina e peonina) rispetto a quelle con un più basso o nullo livello di metilazione (Castellarin et al., 2007b). L’effetto del deficit idrico specificatamente riferito a flavonoidi non antociani è stato meno indagato. Un lieve incremento dell’espressione della leucoantocianidina-riduttasi (enzima chiave che apre la via della biosintesi delle catechine) è indotto da condizioni di deficit idrico anticipato: a questo incremento non è però corrisposto un significativo aumento della concentrazione in proantocianidine (Castellarin et al., 2007a) anche se, a livello di tendenza, alcuni gruppi di lavoro su Syrah (Ojeda et al., 2002) hanno rilevato che sia il deficit idrico anticipato che quello tardivo determinano un incremento del contenuto in proantocianidine rispetto ai controlli. Ancora minori sono 30 risultati gli effetti dello stress idrico sulla flavonolsintasi (FLS1) e quindi sull’accumulo dei flavonoli (Castellarin et al., 2007a). Sono poco delineate, al momento, le conoscenze relative all’effetto dello stress idrico sull’accumulo degli stilbeni, resveratrolo in particolare, il cui contenuto non è risultato influenzato dallo stress idrico in piante di Barbera innestate su 3309 C (Vezzulli et al., 2007). Composti aromatici. Attualmente i lavori relativi all’effetto dello stress idrico sulla quantità di composti aromatici e sul loro profilo non sono ancora molto numerosi. Qualche conoscenza in più si ha a proposito dell’effetto dello stress idrico sui carotenoidi per i quali la relativamente recente identificazione e caratterizzazione di una specifica carotenoide diossigenasi dell’uva, la cui attività è stata correlata in vivo con l’accumulo di 3-idrossi-ß-ionone, isoprenoide C-13, dal significativo impatto aromatico, ha definitivamente chiarito, anche in Vitis vinifera, l’origine dei C-13 norisoprenoidi da precursori carotenoidi (Mathieu et al., 2005). La mancanza di irrigazione su piante di Touriga nacional innestate su 196-17 causava un incremento significativo del contenuto in carotenoidi rispetto al trattamento irriguo, in condizioni di suolo con scarsa capacità di trattenuta idrica, mentre nel suolo con capacità di trattenuta superiore le differenze tra condizioni irrigue e condizioni non irrigue risultavano sfumate, pur essendo ancora evidenti (Oliveira et al., 2003). L’influenza dello stato idrico è stata valutata su piante di Cabernet Sauvignon sottoposte a partial root drying (PRD) e su piante testimoni normalmente irrigate su entrambi i lati del filare: l’influenza della riduzione dell’apporto idrico incomincia a verificarsi a partire da circa 10 e circa 30 giorni dall’invaiatura per la luteina e per il ß-carotene, rispettivamente. Anche la concentrazione dei C-13 norisoprenoidi, in particolare quella di ß-damascenone, ß-ionone e 1,1,6-trimetil-1,2-diidronaftalene (TDN), era significativamente maggiore nelle piante sottoposte a condizioni di PRD; ciò si verificava anche su base di contenuto per acino e quindi parrebbe un effetto che, similmente a quanto già chiarito per i polifenoli, non è solo il risultato di un alterato rapporto buccia/polpa ma, presumibilmente, è legato ad un incremento dell’attività enzimatica (Bindon et al., 2007). Una limitata disponibilità idrica incrementava il contenuto degli aromi glico-coniugati nei vini prodotti a partire da uve della cv Agiorgitiko innestata su 41B, in particolare nelle condizioni di minor disponibilità idrica si determinarono le maggiori concentrazioni di terpenil- Meccanismi di resistenza a stress idrico della vite glicosilati (Koundouras et al., 2006). Un comportamento simile è stato osservato su un altro vitigno, il Moscato di Alessandria su 1103 Paulsen (Pedreira dos Santos et al., 2007), caso in cui, in condizioni di moderata disponibilità idrica a seguito dell’applicazione di condizioni di PRD e di non-irrigazione, si rilevò un incremento della concentrazione del glicosil-glucosio (GG) che, nelle uve a bacca bianca, è essenzialmente ascrivibile alla presenza di metaboliti secondari glicosilati aromatici (Williams et al., 1995). L’effetto della ridotta disponibilità idrica è stato anche osservato a carico di alcuni aromi tiolici, derivati dall’S-cisteina, in Sauvignon blanc: Peyrot des Gachons e collaboratori (2005) hanno dimostrato che condizioni di ridotta disponibilità idrica accompagnate da una non limitata dotazione azotata favoriscono il massimo accumulo del 4MMP (4-mercapto-4-metilpentano-2-one), del 4MMPOH (4-mercapto-4-metilpentan-2-olo) e del 3MH (3-mercaptoesan-1-olo). È stato riportato che lo stress idrico ha favorito sia incrementi sia decrementi dell’accumulo dell’mRNA. Alcuni enzimi coinvolti nella sintesi dell’isopentenilpirofosfato attraverso la via metabolica non mevalonato-dipendente, hanno mostrato una significativa riduzione in condizioni di stress idrico; tra questi la 1deossi-D-xylulosio 5-fosfato sintasi e la (E)-ßocimene sintasi che catalizzano la sintesi di olefina monoterpenica, un composto con importanti implicazioni dal punto di vista del profumo e la zeaxantina epossidasi che porta alla formazione di xantofille. La β-carotene idrossilasi, responsabile dell’idrossilazione del carotene e che è necessaria per la sintesi delle xantofille, risultava significativamente indotta nella polpa a seguito di stress idrico. Anche 5 metil-transferasi dell’acido caffeico, coinvolte, almeno alcune, nella formazione di sostanze aromatiche mostravano incremento di mRNA nella buccia e nella polpa di bacche in stress idrico (Grimplet et al., 2007). In tabella 1 (a: polifenoli; b: composti aromatici) sono elencati in forma riassuntiva i risultati ottenuti per i metaboliti descritti. Risposte molecolari allo stress idrico In questi ultimi anni l’uso della genomica funzionale ha permesso di comprendere le risposte molecolari agli stress in maniera più completa rispetto alle altre tecniche molecolari tradizionali, osservando la contemporanea variazione di espressione, e l’eventuale correlazione, di migliaia di trascritti o centinaia di proteine, e non solo di pochi geni d’interesse. Oggi sono ormai disponibili chip che contengono l’intero genoma di una pianta; in un solo esperimento si possono quindi ricavare migliaia di informazioni. Esiste una quantità di studi molecolari di genomica funzionale condotti su piante sottoposte a condizioni di deficit idrico, molti dei quali hanno sfruttato la tecnologia microarray come strumento per l’analisi trascrittomica, quali quelli di Seki e collaboratori in arabidopsis (2002) o di Rabbani e collaboratori in riso (2003). Nel 2007 Cramer et al. si sono serviti di questa potente tecnologia informativa per indagare sulle risposte molecolari precoci e tardive della vite (cv Cabernet Sauvignon) a stress di tipo idrico e salino. L’elegante disegno sperimentale utilizzato ha permesso di separare le risposte dovute agli effetti dei due tipi di stress. Durante l’esperimento, le piante sottoposte a stress idrico non sono state irrigate, mentre quelle sottoposte a stress salino sono state irrigate con una soluzione di sali tale da portarle ad avere valori di potenziale idrico del fusto simili alle piante trattate con deficit di acqua. Al sedicesimo giorno di trattamento, tutte le piante stressate mostravano un valore basso di potenziale idrico del fusto rispetto al controllo normalmente irrigato, ma solo le piante in stress idrico apparivano avvizzite. Il lavoro molecolare e di caratterizzazione dei metaboliti eseguito in parallelo ha permesso di dare delle risposte a questo diverso comportamento e permette di sottolineare quanto sia importante una corretta integrazione di studi di tipo fisiologico, molecolare e metabolico per avere una visione globale del processo studiato. Entrambi i tipi di stress impongono cambiamenti osmotici nella pianta, ma quello salino, oltre ad un abbassamento del potenziale idrico, provoca un accumulo di ioni nella zona radicale. La compartimentalizzazione di questi ioni nel vacuolo delle cellule appare essere un vantaggio per le piante, che dispongono in questo modo di osmoliti “a basso costo”, ossia che non devono sintetizzare, per bilanciare gli equilibri osmotici. Al contrario le viti in stress idrico analizzate possiedono una maggior concentrazione di prolina, glucosio e acido malico che devono sintetizzare con dispendio di energia (Raven, 1985). È interessante notare come l’acido malico, secondo più abbondante acido organico in vite, mostra un notevole incremento in risposta allo stress idrico rispetto a quello salino (rispettivamente 473 e 182 % rispetto al controllo). A livello del profilo trascrittomico, questo studio sembra dimostrare come in vite la risposta allo stress idrico sia più immediata rispetto a quella allo stress salino, anche se per rilevare cambiamenti nell’espressione genica piuttosto importanti bisogna attendere almeno dieci giorni in entrambi i casi. Nei primi dieci giorni di stress, i meccanismi di elusione, di controllo 31 - 110 Richter 41B Cabernet Sauvignon Cabernet Sauvigonon Agiorgitiko (segue) Fercal Syrah Portinnesto Ganzin 32 Cabernet Franc Vitigno Eccesso idrico 64 l/settimana/pianta (H) Deficit: 32 l/settimana/pianta non prima di -1.5 MPa (L) Controlli: 32 l/settimana/pianta Diversa disponibilità idrica ambientale: pianura con CC ca 190 mm (P) collina con CC ca 70 mm (H) collina argillosa in altitudine (700 m slm) con elevata CC (A) 8 l/h /pianta per 8h (DI) senza apporti fino a -1.6 MPa (MI) 4 l/h /pianta per 8h (SI) Deficit forte prima della invaiatura (S1) Deficit debole prima della invaiatura (S2) Deficit forte dopo invaiatura (S3) Controllo (C) All’inv. (ED) Dopo inv. (LD) Deficit protratto (FD) Controlli (SP) Apporti continui (C) Gestione dell’acqua Campo Campo All’alba alla raccolta P = ca -0.50 MPa H = ca -0.85 MPa A = -0.15 MPa nel ‘97 -0.55 MPa nel ’98 Campo Vaso (70 L) Campo Condizioni sperimentali A mezzogiorno alla raccolta H = -1.16 MPa L = -1.59 MPa C = -1.36 MPa A mezzogiorno alla raccolta DI = -1.08 MPa MI = -1.58 MPa SI = -1.38 MPa All’alba nel corso della stagione S1, S2 = tra -0.6 e -1.0 MPa S3 = tra -0.4 e -1.0 MPa A mezzogiorno alla raccolta ED = -1.24 MPa LD = -1.64 MPa FD = -1.48 MPa SP = -1.35 MPa C = -1.32 MPa Valori potenziale idrico fogliare Matthews e Anderson, 1988 Bibliografia Incremento concentrazione Ojeda et al., antociani totali in, 2002 nell’ordine, S3, S2, S1 rispetto a C Accumulo più veloce e quantità superiori in ED, LD e C, nell’ordine Antociani Maggiori valori dell’indice di polifenoli totali in situazione di maggiore stress idrico (H) Incremento tannini della buccia in L Incremento concentrazione antociani in H, Koundouras et indipendentemente dalla al., 2006 quantità di produzione Incremento antociani in L Roby et al., 2004 MI alla raccolta incrementa Kennedy et al., la concentrazione Incremento contenuto in 2002 tannini in MI rispetto DI e (espressa in mg/g uva) SI Tannini della buccia: concentrazioni superiori in S2 e S3 rispetto a S1 e C Nessuna differenza nell’accumulo dei flavonoli Flavonoli: concentrazione maggiore in S1, S2, S3 rispetto a C In SP e C ca. 0.88 µM Aumento in ED, LD e FD (ca 1.15 µM) Polifenoli Tab. 1a - Variazioni del contenuto in polifenoli dell’acino in situazioni di stress idrico. Tab. 1a - Berry phenolic content upon water stress. Ferrandino et al. 140R SO4 1103P SO4 Merlot Moscato di Alessandria Sangiovese (clone 12T) Portinnesto Cabernet Sauvignon Vitigno Non irrigato (NI) 50 % evapotraspirazione reale (ETc ), (DI) 50 % ETc, su lati alterni (PRD) 100 % ETc (FI) ca 5 L/vaso/giorno per riportare alla capacità di campo (WW) ca 5L/vaso/giorno solo in 1 dei 2 vasi alternativamente (PRD) Irrigazioni di soccorso per evitare perdita di produzione nelle piante WS 2.5 L/m/h per mantenere il potenziale tra -0.2 e -0.6 MPa nei controlli Deficit da allegagione a invaiatura (ED) Deficit dalla fine dell’invaiatura (LD) Controllo (C) Gestione dell’acqua Condizioni sperimentali A mezzogiorno alla raccolta ED = fino a -1.4 MP ante invaiatura poi Campo simile a C; LD = simile a C ante invaiatura poi fino a -1.4 MPa; C = tra -0.9 e -1.2 MPa Potenziale del tralcio Piante in stress (WS) = fino a -1.4 MPa, nel 2004; = fino a -1.20 MPa nel Campo 2005 ma per tempi più prolungati in pre-invaiatura controllo (CT) = tra -0.2 e 0.6 MPa in entrambi gli anni All’alba in pre-raccolta NI = -0.64 MPa DI = -0.45 MPa Campo PRD = -0.40 MPa FI = -0.22 MPa Vaso (40 L) con All’alba alla raccolta apparato radicale WW = - 0.30 MPa diviso in due PRD = -0.55 MPa contenitori Valori potenziale idrico fogliare Incremento antociani totali in WS + 37 % nel 2004, +57 % nel 2005 Antociani Bibliografia - Aumento in NI e PRD, non imputabile, almeno in PRD, alla riduzione della quantità di produzione - Pedreira dos Santos et al., 2007 Incremento antociani totali Poni et al., 2007. (su base peso fresco) - Castellarin et al., Incremento % delle antocianine tri-sostituite in 2007b. WS Incremento del livello di mutilazione delle antocianine in WS Incremento concentrazione e contenuto antociani in Castellarin et al., deficit 2007a effetto non significativo incremento della sull’accumulo dei flavonoli percentuale di antocianine tri-idrossilate in ED Effetto limitato sull’accumulo delle proantocianidine Polifenoli Meccanismi di resistenza a stress idrico della vite 33 34 Moscato di Alessandria Cabernet Sauvignon Agiorgitiko Sauvignon Blanc Touriga Nacional Vitigno Diversa disponibilità idrica ambientale: suolo A = capacità volumetrica alta (irrigato = AI; non irrigato = ANI) Gestione dell’acqua 1103P Non irrigato (NI) 50 % evapotraspirazione reale (ETc ), (DI) 50 % ETc, su lati alterni (PRD) 100 % ETc (FI) suolo B = capacità volumetrica bassa (irrigato = BI; non irrigato = BNI) Diversa disponibilità idrica ambientale: Diversi capacità volumetrica di 67 mm per portinnesti 1.0 m di profondità (SG) a seconda capacità volumetrica di 39 mm per del vigneto 0.8 m di profondità (GS) capacità volumetrica di 93 mm per 1.4 m di profondità (LSB) Nessuna limitazione idrica (LHB) Diversa disponibilità idrica ambientale: pianura con capacità volumetrica 41B di 190 mm (P) collina con capacità volumetrica di 70 mm (H) collina argillosa in altitudine (700 m slm) con elevata capacità volumetrica (A) 1.19 ML/ha nel 2001-02 e 1.37 ML/ha nel 2002-03 (C) 0.84 ML/ha nel 2001-02 e 0.85 ML/ha nel 2002-03 (PRD) 196-17 Portinnesto Campo Campo Campo Condizioni sperimentali All’alba in pre-raccolta NI = -0.64 MPa DI = -0.45 MPa PRD = -0.40 MPa FI = -0.22 MPa Campo Varie misure durante i cicli di irrigazione ampiamente Campo discusse anche in funzione della conduttanza stomatica All’alba alla raccolta P = ca -0.50 MPa H = ca -0.85 MPa A = -0.15 MPa nel ‘97 -0.55 MPa nel ’98 All’alba: piante non in stress in LSB e LHB; a partire dal giorno giuliano 230: -0.5 MPa in GS, -1.0 MPa in SG - Valori potenziale idrico fogliare Aromi (liberi o in forma glico-coniugata) - Il contenuto in carotenoidi aumenta in PRD rispetto a C, più la luteina del β-carotene - Stress idrici severi sembrano limitare il loro accumulo I precursori aromatici coniugati dell’S-cisteina aumentano in condizioni di moderato stress idrico Peyrot des Gachon et al., 2005 Oliveira et al., 2003 Bibliografia Aumenta in modo netto il contenuto per bacca di alcuni C13-norisoprenoidi (β-damascenone, β-ionone e TDN) in condizioni di PRD Il contenuto di glicosilglucosio per bacca aumenta in nelle condizioni di maggior stress (NI e PRD) Pedreira dos Santos et al., 2007 Bindon et al., 2007 Concentrazioni maggiori di composti C6 (es. etanolo, esenolo), di fenoli volatili, Koundouras et di terpeni nelle condizioni al., 2006 di maggiore stress idrico (H); di C13-norisoprenoidi in un anno su due - Il contenuto in carotenoidi incrementa nelle condizioni di stress idrico, tanto più quanto minore è la capacità volumetrica del suolo (in B più che in A) Precursori d’aroma Tab. 1b - Variazioni del contenuto in aromi e loro precursori nell’acino in situazioni di stress idrico. Tab. 1b - Berry flavours and flavour precursors as affected by water stress. Ferrandino et al. Meccanismi di resistenza a stress idrico della vite idraulico e stomatico hanno probabilmente ritardato la maggior parte delle risposte metaboliche della pianta. Infatti i trascritti che hanno mostrato una variazione di espressione rispetto al controllo sono aumentati con l’intensificarsi degli stress e molti di tali trascritti variano in entrambi i tipi di stress. Questa ricerca ha rivelato inoltre come l’accrescimento vegetativo della vite sembri più sensibile allo stress idrico che ad un equivalente livello di stress salino. Questo rafforza la tesi che l’assorbimento del sale possa contribuire al riequilibrio osmotico, facilitando il richiamo di acqua e la crescita nei giovani germogli. È interessante notare come, nel caso di stress prolungati nel tempo, la vite mostri invece maggior adattabilità allo stress idrico e sia da sempre considerata una specie sensibile alla salinità (Hawker e Walker, 1978; Shani et al., 1993). Oggi possiamo finalmente comprendere come questa intolleranza sia probabilmente dovuta all’incapacità della pianta di tener testa all’alta concentrazione interna di ioni e alla conseguente tossicità nel lungo periodo (Munns, 2002). Se nel lavoro appena descritto Cramer e collaboratori indagano sulle risposte allo stress idrico a livello della pianta intera, un altro studio, eseguito sempre su Cabernet Sauvignon, con un approccio di tipo trascrittomico, servendosi della tecnologia microarray, sposta l’attenzione direttamente sull’acino (Grimplet et al., 2007). Tale ricerca, condotta su diversi tessuti dell’acino e su acini raccolti da piante normalmente irrigate o poste in condizioni di stress idrico, mette in luce come questo tipo di stress abbia profondi effetti sul profilo di espressione di geni soprattutto a livello di polpa e buccia. In questi tessuti il deficit idrico provoca l’aumento del livello di trascritti di diverse categorie funzionali, tra cui quelle associate alla biosintesi dei fenilpropanoidi, della lignina, delle proantocianidine così come dei metaboliti responsabili dell’aroma. Inoltre, come già discusso precedentemente, piante di vite (cv Cabernet Sauvignon e cv Merlot) cresciute in condizioni di stress idrico mostrano un incremento di espressione dei geni coinvolti nelle vie di biosintesi dei flavonoidi nell’acino (CHS, F3H, DFR, LDOX, F3’5’H, UFGT, GST, OMT) (Castellarin et al., 2007a, 2007b), con le importanti ricadute sulla qualità dell’uva di cui si è detto. Altrettanto interessanti sono i risultati di una ricerca che ha sfruttato un altro strumento della genomica funzionale, l’analisi proteomica, già utilizzata per individuare le variazioni enzimatiche nell’acino durante la maturazione (Giribaldi et al., 2007). In Chardonnay e Cabernet Sauvignon sono state indagate le differenze proteomiche di risposta allo stress idrico e salino (Vincent et al., 2007). Le pratiche di miglioramento genetico cercano da sempre di sfruttare variazioni genetiche tra cultivar per ottenere una varietà d’élite più performante. Nel caso della vite sono invece proprio le differenze tra le diverse cultivar a guidare le preferenze del consumatore per un particolare vino o una particolare uva da tavola; tali differenze vanno quindi mantenute. Lo studio effettuato dimostra come, a livello fisiologico, Chardonnay sembra essere più tollerante di Cabernet Sauvignon sia allo stress idrico che a quello salino. Fra le proteine maggiormente attivate dagli stress in quest’ultima cultivar si ritrovano proteine coinvolte nel macchinario di proteolisi delle cellule, risultato che sembra indicare una maggiore sofferenza fisiologica agli stress. Parallelamente, in Chardonnay risultano attivati enzimi, quali xiloglucano-endotransglicosilasi, che modificano la parete nella fase di crescita cellulare (Wu et al., 2005). La sovra-espressione di questi enzimi potrebbe essere correlata al miglior comportamento della cv Chardonnay per quel che riguarda l’accrescimento del fusto sotto stress. Risultato particolarmente interessante, l’analisi della varianza indica che è la differenza varietale la principale componente che influisce sulla variazione dell’espressione proteica (40% degli spot mostra variazione significativa in risposta alla cv contro il 15% che varia in risposta agli stress). Nei paragrafi successivi riepiloghiamo, divise in varie categorie funzionali, quelle che sono le principali risposte molecolari della vite allo stress idrico che emergono dagli studi presenti in letteratura. Effetti sul metabolismo dei carboidrati L’aumentata produzione di soluti cellulari, principalmente osmoliti protettori come zuccheri, ammine e zuccheri alcolici, è una delle prime risposte di difesa alla disidratazione e mira a mantenere inalterato il potenziale idrico cellulare e a limitare il più possibile la perdita di acqua (Bray, 1997). È risaputo inoltre che l’espressione di enzimi coinvolti nella degradazione di carboidrati complessi a zuccheri semplici aumenta in risposta a stress idrico, salino e freddo (Taji et al., 2002). In giovani apici vegetativi di Cabernet Sauvignon, quali quelli usati nel lavoro di Cramer e collaboratori già citato, l’aumento dei trascritti coinvolti nella glicolisi e nel metabolismo di composti osmoprotettori è una delle prime risposte allo stress idrico. Diversamente, in foglie mature di viti (cv Savatiano) sottoposte a stress idrico, si è osservato come il riequilibrio osmotico è largamente associato all’aumento del contenuto di ioni inorganici e non di carboidrati solubili o di aminoacidi (Patakas 35 Ferrandino et al. et al., 2002). Questa diversa risposta sembra essere associata all’età dell’organo vegetativo preso in considerazione. Patakas (2000) ha infatti dimostrato come, in normali condizioni, i carboidrati solubili rappresentino circa il 70% dei soluti osmoticamente attivi in giovani foglie di vite cv Savatiano. Nelle foglie mature, durante lo stress idrico, la concentrazione di tali carboidrati è ridotta forse perchè trasportati nei tessuti sink più giovani (Cramer et al., 2007); per questo motivo le foglie più mature si servirebbero degli ioni inorganici per gestire il riequilibrio osmotico. A livello dell’acino di Cabernet Sauvignon si è riscontrata una sottoregolazione dell’espressione di trasportatori di zucchero seme- e polpa-specifici e di una invertasi vacuolare polpa-specifica. Questo potrebbe suggerire un’ipotesi alternativa al caricamento di esosi nell’acino durante lo stress idrico, ossia che l’aumento dei gradi Brix possa essere dovuto ad un rimpicciolimento dell’acino (Grimplet et al., 2007). Effetti sul trasporto di soluti e ioni I trasportatori, presenti soprattutto sul plasmalemma e sul tonoplasto, hanno lo specifico compito di ripristinare la pressione osmotica in condizioni di stress imposte dall’ambiente esterno (Seki et al., 2002). In Cabernet Sauvignon lo stress idrico, come quello salino, provoca un incremento dei trascritti che codificano per una varietà di trasportatori di ioni, aminoacidi, nucleotidi e peptidi (Cramer et al., 2007). Si ritrova anche una pronunciata e precoce espressione di un trasportatore di lipidi. Trasportatori di questo tipo pare abbiano un ruolo nella protezione delle membrane cellulari dal danno osmotico e sembra possano mediare eventuali cambiamenti nella composizione dei fosfolipidi (Holmberg e Bülow, 1998). Un problema che le piante in stress idrico si trovano ad affrontare è la riduzione dell’attività fotosintetica che può portare a problemi di fotoinibizione in condizioni di luce normali. Per tali motivi, l’organismo tenta di reagire attivando la fotorespirazione e provvedendo a smaltire diversamente gli elettroni in eccesso; si spiega così l’incremento nei trascritti relativi ai geni coinvolti nella catena di trasporto di elettroni del fotosistema I e II (Cramer et al., 2007). In merito alla problematica dello stress idrico, le acquaporine, proteine canale finemente regolate che facilitano il trasporto dell’acqua, meritano particolare attenzione. Alcune acquaporine sono espresse costitutivamente mentre l’espressione di altre è regolata da differenti stimoli quali lo stadio di sviluppo, la luce, gli ormoni o da avverse condizioni ambientali quali deficit idrico, stress salino, basse temperature (Vera- 36 Estrella et al., 2004). Studi di espressione genica in varie specie vegetali mostrano una risposta variabile delle diverse isoforme di acquaporina allo stress idrico, con sotto- o sovra-regolazione dei geni (Yamada et al., 1997; Alexandersson et al., 2005; Secchi et al., 2007). Probabilmente per mantenere un corretto stato idrico in condizioni di stress abiotico, sono necessari sia l’incremento del trasporto dell’acqua in certi tessuti che la riduzione in altri (Jang et al., 2004). I risultati delle analisi trascrittomiche sopra descritte mettono in evidenza come diverse acquaporine risultino sotto-regolate sia in apice vegetativo che nella polpa e nella buccia di acini di Cabernet Sauvignon in stress idrico. Un altro lavoro prende invece in considerazione uno studio di espressione di sette geni di acquaporine in foglie e radici dell’ibrido Richter-110 (Vitis berlandieri x Vitis rupestris), portinnesto che mostra particolare vigore e resistenza allo stress idrico (Galmés et al., 2007). In foglia tutti i geni considerati mostrano una significativa sottoregolazione in condizioni di stress moderato; al contrario nelle piante fortemente stressate l’espressione risulta uguale o più alta rispetto al controllo, a seconda del particolare gene. Nelle radici non si osserva un trend generale nella variazione dei trascritti: PIP1;2, PIP2;1 e TIP2 risultano sovra-espressi in condizioni di stress moderato, ma in una settimana la loro espressione ritorna ai livelli del controllo. Solo l’espressione di una PIP2;2 risulta prolungata nel tempo. Una recente ricerca di Vandeleur et al. (2008) mette in relazione la diversa espressione di due acquaporine (VvPIP2;2 e VvPIP1;1) fortemente espresse in radice con la diversa strategia di difesa di due varietà di vite, Grenache e Chardonnay, nei confronti dello stress idrico. In generale le acquaporine radicali influiscono sulla via transcellulare e simplastica del flusso radiale dell’acqua in radice e, con la loro espressione regolata da vari fattori, condizionano la conduttanza idraulica di quest’organo. I risultati di questo studio mostrano come VvPIP2;2 sia caratterizzata da un’espressione costitutiva in radice, in entrambe le cultivar ed anche in stress idrico, mentre il livello del trascritto VvPIP1;1 aumenta durante lo stress idrico in Chardonnay ma non in Grenache. Questo si traduce in un contenimento della riduzione di conduttanza idraulica radicale in Chardonnay in condizioni di stress idrico, a causa dell’aumento del contributo transcellulare al trasporto radiale d’acqua in radice. Questo indicherebbe perché tale cultivar sia meno vulnerabile all’embolizzazione di Grenache (Alsina et al., 2007), riuscendo a mantenere differenze di potenziale più piccole fra suolo e xilema. Al contrario, la strategia adottata dalla cv Grenache sem- Meccanismi di resistenza a stress idrico della vite bra essere opposta; la mancata variazione nei livelli dei trascritti delle due più importanti acquaporine radicali si traduce in una conduttanza idraulica (soprattutto nella sua componente intracellulare) più bassa in condizioni di deficit idrico e quindi in una maggiore tolleranza alle condizioni di stress. Questa strategia è possibile solo grazie allo stretto controllo della regolazione stomatica che questa varietà possiede, riuscendo così a prevenire potenziali xilematici eccessivamente negativi (Schultz, 2003; Soar et al., 2006). Grenache sembra quindi avere un approccio allo stress idrico simile a quello delle piante del deserto, dove le acquaporine della radice vengono sottoregolate per prevenire la perdita di acqua nel suolo in stress idrico (North et al., 2004). Effetti sulla risposta agli stimoli ormonali L’acido abscissico (ABA) ricopre il ruolo di importante molecola segnale nei meccanismi di risposta a svariate condizioni di stress, come quelle provocate da deficit idrico (Wilkinson e Davies, 2002). In apici vegetativi di piante di Cabernet Sauvignon sottoposte a stress idrico, un enzima chiave regolatore della biosintesi dell’ acido abscissico (ABA), quale il 9-cis-epossicarotenoide diossigenasi (NCED), aumenta molto il suo livello di espressione rispetto al controllo, così come risulta incrementata l’espressione di 25 diversi trascritti correlati a quest’ormone (Cramer et al., 2007). Sappiamo che in foglie e radici l’ABA ricopre il ruolo di importante molecola segnale nei meccanismi di risposta a svariate condizioni di stress, come quelle provocate da deficit idrico (Stoll et al., 2000; Wilkinson e Davies, 2002). Tale ruolo potrebbe essere invece trascurabile nell’acino. In Merlot si è visto infatti come, a livello di trascritto, l’espressione di quattro geni correlati al metabolismo dell’ABA (NCED1, NCED2, rd22 e ACPK1) non risultino particolarmente indotti nell’esocarpo di acini in stress idrico (Castellarin et al., 2007b) mentre in acini di Cabernet Sauvignon risulta incrementata l’espressione di un gene relativo all’enzima NCED ma sotto-regolati geni rd22 che rispondono all’ABA e alla deidratazione (Grimplet et al., 2007). È ben noto invece come l’ABA rappresenti un importante segnale dell’inizio della maturazione degli acini, poiché la vite mostra un aumento della concentrazione di quest’ormone nelle bucce delle bacche appena prima dell’invaiatura (Coombe e Hale, 1973; Davies et al., 1997). Evidenze sull’importanza dell’ABA in questo processo sono state ottenute studiando gli effetti di applicazioni esogene di ormone sugli acini. Questi trattamenti favoriscono l’accumulo degli antociani e l’espressione dei geni che presiedono alla loro via biosintetica (Ban et al., 2003; Jeong et al., 2004). Come già discusso nei paragrafi precedenti, lo stress idrico porta ad un incremento di espressione dei geni coinvolti nelle vie di biosintesi di antociani e flavonoidi ma, alla luce di quanto detto e di quanto discusso soprattutto da Castellarin e collaboratori, non sembra esserci un rapporto causale tra stress idrico a livello di pianta intera, livelli di ABA nell’esocarpo dell’acino e regolazione trascrizionale degli antociani. Lo stress idrico potrebbe servirsi di vie di segnalazione alternative a quella dell’ABA o di modificazioni post-trascrizionali o di attività delle proteine per indurre l’aumento della biosintesi di antociani (Castellarin et al., 2007b). L’etilene sembra giocare un ruolo critico durante lo stress idrico, anche sullo sviluppo e la maturazione dell’acino. Enzimi quali S-adenosil-L-metionina sintetasi 1 (SAM) o 1-aminociclopropano-1-carbossilato (ACC) ossidasi vengono sovra-espressi sia nell’acino che nel tessuto vegetativo in seguito a questo tipo di stress (Cramer et al., 2007; Grimplet et al., 2007). Effetti sul metabolismo e sulle proprietà chimico-fisiche della parete cellulare Anche piccoli cambiamenti nello stato idrico della pianta possono avere effetti rapidi e significativi sulla crescita (Passioura e Munns, 2000). L’inibizione dell’espansione cellulare può risultare innanzitutto da un ridotto turgore cellulare. Infatti la crescita per distensione dipende innanzitutto da fattori chimico-fisici, ossia dall’equilibrio tra la pressione di turgore e la forza meccanica della parete che si oppone a cambiamenti di forma. Si è prima discusso come il rallentamento della crescita sia meno evidente in viti sottoposte a stress salino che riescono a gestire meglio la pressione di turgore, avendo a disposizione osmoliti “a basso costo”. Per sostenere la crescita è però necessario un processo metabolicamente attivo che controlli l’estensibilità della parete cellulare. Tale processo richiede un’acidificazione di parete dovuta alla aumentata attività delle pompe protoniche ATPasiche localizzate sulla membrana plasmatica, mediata dall’auxina. Il basso valore di pH rilassa i legami che tengono insieme i componenti di parete e nello stesso tempo attiva gli enzimi che portano alla sintesi di nuovo materiale. In piante in stress idrico, la riduzione dell’allungamento fogliare è correlata all’aumento di pH del succo xilematico, aumento che causa anche un incremento della concentrazione di ABA xilematico che agisce sulla conduttanza stomatica (Hartung et al., 1988; Bacon et al., 1998). Inoltre gli studi microarray effettuati su tessuti vegetativi di Cabernet Sauvignon in stress idrico 37 Ferrandino et al. mostrano una riduzione dei trascritti relativi a geni che codificano per enzimi di parete (poligalatturonasi, pectinmetilesterasi, espansine, xiloglucano-endotransglicosilasi (XET)) (Cramer et al., 2007). Una risposta simile si ritrova negli acini sottoposti a stress idrico, in cui si verifica anche una diminuzione dei livelli di trascritti relativi a proteine indotte o che rispondono all’auxina; questo porterebbe a ipotizzare un abbassamento della concentrazione di auxina e un conseguente minor contributo all’acidificazione di parete (Grimplet et al., 2007). Tutto questo si traduce in un rallentamento o un arresto della crescita in risposta allo stress idrico, anche se sono presenti differenze fra cultivar. La crescita in condizioni di stress sembra essere sostenuta meglio da Chardonnay rispetto a Cabernet Sauvignon; questa differenza potrebbe essere dovuta all’elevata quantità di xiloglucano-endotransglicosilasi (XET) osservata in Chardonnay rispetto all’altra varietà (Vincent et al., 2007). Effetti sul metabolismo energetico Come sopra accennato, lo stress idrico induce un calo dell’attività fotosintetica, in quanto, come attestato da diversi studi (Chaves, 2002), la chiusura degli stomi stimolata dai livelli endogeni di ABA, impedisce il normale assorbimento di CO2, limitando il funzionamento dei fotosistemi I e II. La RuBisCO attivasi è in grado di modulare la fotosintesi agendo sulla RuBisCO; in condizioni normali solo l’85% del pool di RuBisCO è attivato da quest’enzima in tabacco (Mott e Woodrow, 2000). Durante lo stress idrico in vite si osserva un rapido aumento del livello di trascritto di questo enzima chiave che porta ad un miglioramento dell’efficienza fotosintetica, incrementando la quantità di RuBisCO attivata. Effetti sulla regolazione dei fattori di trascrizione La risposta agli stress osmotici è regolata da un complesso network di fattori trascrizionali (Shinozaki e Yamaguchi-Shinozaki, 2000). Il profilo di espressione di circa 200 fattori di trascrizione, presenti sul chip utilizzato per l’analisi trascrittomica in apici vegetativi di Cabernet Sauvignon, è significativamente influenzato da entrambi i tipi di stress abiotici considerati, soprattutto ad un livello elevato di stress. Tra i geni indotti sono stati individuati fattori di trascrizione appartenenti alla famiglia NAC. I membri di questa numerosa famiglia mostrano svariate funzioni cellulari (Olsen et al., 2005) e sono implicati nell’intricato processo di trasduzione del segnale diretto dall’ABA. Il ruolo dei NAC sembra essere quello di aumentare la sensibilità della pianta alle concentrazioni endogene 38 di ABA, determinando di conseguenza una migliore tolleranza al danno osmotico (Fujita et al., 2004). Altre due importanti famiglie risultano attivate dallo stress idrico: quella dei fattori trascrizionali CBF/DREB, che giocano un ruolo importante anche nell’attivazione della risposta al freddo (Xiao et al., 2008) e quella denominata WRKY. L’espressione dei geni appartenenti a quest’ultima famiglia è localizzata nella buccia e nella polpa dell’acino e sembra essere coinvolta nella risposta a stress abiotici e di difesa ai patogeni. Nell’acino infatti, in seguito a stress, si osserva l’aumento di trascritti corrispondenti a chitinasi, taumatine, β-1,3-glucanasi. L’aumento di tali proteine correlate alla patogenesi (PR) potrebbe essere spiegato se si pensa che le vie di risposta a stress biotici e abiotici sono in parte sovrapponibili. Un’ipotesi che si può formulare, ma che necessita di evidenze sperimentali, è che lo stress idrico potrebbe aiutare a migliorare la resistenza a patogeni nell’acino (Grimplet et al., 2007). Sempre in quest’organo, infine, questo studio ha messo in evidenza come i fattori di trascrizione possano avere un’espressione tessutotrattamento-specifica: un gene MYB che mostra un profilo di espressione buccia-specifico in condizioni di buona disponibilità di acqua viene invece espresso specificamente nella polpa in condizioni di stress idrico. Deidrine Anche le deidrine, proteine che si accumulano nei tessuti vegetativi soggetti a vari tipi di stress abiotico e nei semi durante l’ultimo stadio di embriogenesi, vengono sovra-espresse durante il deficit idrico in vite. Recentemente due geni molto simili tra loro che codificano per deidrine, DHN1a e DHN1b, sono stati isolati in Vitis vinifera e in Vitis riparia, specie quest’ultima molto tollerante alle basse temperature (Xiao e Nassuth, 2006). DHN1b risulta essere espresso solo in Vitis vinifera e quindi non sembra contribuire alla maggiore tolleranza al freddo. Questo gene possiede 18pb in meno rispetto al DHN1a e forse un non corretto ripiegamento della proteina, dovuto agli aminoacidi mancanti, impedisce l’attività della deidrina o l’attivazione a basse temperature. In tabella 2 sono elencate in forma riassuntiva le risposte molecolari descritte. Adattamenti di genotipi diversi allo stress idrico Come descritto a riguardo dei differenti meccanismi discussi, un interessante adattamento della vite, caratterizzata da un’incredibile diversità varietale, riguarda la strategia di risposta al deficit idrico, varia- Meccanismi di resistenza a stress idrico della vite Gene o composto di biosintesi prolina, glucosio, malato RuBisCO attivasi, citocromi, xantofille chitinasi, taumatine, beta1,3-glucanasi fenilalanina ammonioliasi (PAL), stilbene sintasi, calcone sintasi, cinnamoil CoA-riduttasi invertasi vacuolare CHS, F3H, DFR, LDOX, F3’5’H, UFGT, GST, OMT enzimi che modificano la parete cellulare (es. XET xiloglucanoendotransglicosilasi ) proteasomi, ubiquitine, chaperones molecolari ioni inorganici acquaporine 9-cis-epossicarotenoide diossigenasi (NCED) S-adenosil-L-metionina sintetasi 1 (SAM) 1-aminociclopropano-1carbossilato (ACC) ossidasi trasportatori di zuccheri, ioni, aminoacidi, nucleotidi,lipidi NAC, CBF/DREB, WRKY, MYB deidrine Tab. 2 - Risposte molecolari allo stress idrico. Tab. 2 - Molecular responses to water stress condition. Funzione osmoliti geni coinvolti nella regolazione fotosintetica e nella prevenzione del danno foto-ossidativo proteine correlate alla patogenesi (PR) biosintesi dei fenilpropanoidi, della lignina, delle proantocianidine e dei metaboliti responsabili degli aromi scissione di zuccheri complessi enzimi coinvolti nella biosintesi di antocianine e flavonoidi Specie Vitis vinifera L coinvolgimento nella crescita cellulare enzima coinvolto nella biosintesi dell’ABA enzimi coinvolti nella biosintesi dell’etilene famiglie di fattori trascrizionali coinvolte nelle vie di risposta a stress abiotici e patogeni proteine accumulate in condizioni di stress; funzione non ben conosciuta Bibliografia Cabernet Sauvignon Cramer et al., 2007 Cabernet Sauvignon Grimplet et al., 2007 Cabernet Sauvignon Merlot Castellarin et al., 2007a Castellarin et al., 2007b Chardonnay Cabernet Sauvignon coinvolgimento nel catabolismo delle proteine osmoliti proteine trasportatrici di acqua Cultivar Cabernet Sauvignon Savatiano Cabernet Sauvignon Richter-110 (Vitis berlandieri x Vitis rupestris) Grenache Chardonnay Vincent et al., 2007 Grimplet et al., 2007 Cramer et al., 2007 Patakas et al., 2002 Grimplet et al., 2007 Cramer et al., 2007 Vandeleur et al., 2008 Galmés et al., 2007 Vitis vinifera L Cabernet Sauvignon Grimplet et al., 2007 Cramer et al., 2007 Castellarin et al., 2007b V. vinifera L, Vitis riparia Chardonnay Xiao et al., 2006a 39 Ferrandino et al. bile anche a livello intraspecifico (Vitis vinifera L) e non unicamente interspecifico (Schultz, 2003). In effetti, non sorprende che una pianta conosciuta e coltivata sin dall’antichità come la vite, con un areale di distribuzione vastissimo così come il numero di cultivar accertate (10-20.000), possa essere fenotipicamente molto eterogenea, ma è certamente peculiare il fatto che questa variabilità porti a tali differenze fisiologiche. Genericamente, Vitis vinifera L. è classificata come ecologicamente “pessimista”, per via della sua tendenza a ritardare le condizioni di stress rallentando traspirazione, crescita e metabolismi, sino alla scomparsa del fenomeno limitante; in realtà non è sempre così. Cultivar originarie di zone diverse, caratterizzate da condizioni climatiche distinte, mostrano comportamenti tanto peculiari da poter essere classificate come anisoidriche e isoidriche. Proprio a questa ampia varietà comportamentale fanno riferimento i risultati di Schultz (2003) relativi alla diversità intraspecifica di Vitis vinifera, che individua in Syrah e Grenache due rappresentanti di comportamenti fisiologici nettamente distinti, all’interno della medesima specie: anisoidrico e quasi isoidrico. Tali indicazioni sono emerse in seguito ad analisi degli scambi gassosi e del potenziale idrico in condizioni di siccità. Così che, se Grenache, originaria del bacino del Mediterraneo, tende a mantenere un potenziale fogliare pressoché costante durante il decorso della giornata e delle stagioni (comportamento isoidrico, o ecologicamente “pessimista”), Syrah, nativa della Valle del Reno, regola il potenziale idrico proporzionandolo, inversamente, al livello evaporativo dettato dall’ambiente e dalle stagioni (comportamento anisoidrico, o ecologicamente “ottimista”). Questa differenza comportamentale per i medesimi genotipi viene descritta e confermata anche a livello dei tessuti fogliari in una più recente pubblicazione di Soar et al. (2006), o descritta per altri vitigni, ad esempio Sangiovese, isoidrico a bassi livelli di stress, ma anisoidrico quando lo stress diventa più severo (Poni et al., 2007) e Chardonnay, anisoidrico (Vandeleur et al., 2008). Le acquaporine, per attività, composizione ed espressione, sembrano dare un importante contributo alle diverse risposte che le radici di Vitis vinifera possono dare allo stress idrico. Cultivar “ottimiste” (Chardonnay) reagiscono con un blando abbassamento della conduttanza idraulica radicale, mantenendo basso il gradiente di potenziale idrico tra lo xilema e il suolo; ciò potrebbe spiegare perché molte cultivar anisoidriche presentano anche una minor propensione agli embolismi. D’altro canto, cultivar “pessimiste” riducono l’espressione delle acquaporine in stress 40 idrico, e proprio per prevenire conseguenze di potenziali idrici eccessivamente negativi a livello xilematico, necessitano di un maggior controllo stomatico (Vandeleur et al., 2008) e di fenomeni efficienti del recupero dell’embolizzazione (Lovisolo et al., 2008a). La discriminazione isotopica del carbonio come strumento di screening dell’adattamento varietale allo stress idrico Il rapporto tra gli isotopi 13C e 12C nei tessuti vegetali è minore di quello atmosferico, ad indicare che la pianta discrimina a sfavore del 13C durante l’assimilazione fotosintetica. La diffusione della 13CO2 attraverso la rima stomatica è infatti inferiore a quella della 12 CO2 di un fattore 4,4‰. Inoltre, anche la ribulosio bisfosfato carbossilasi (RuBisCO) discrimina a favore della 12CO2 rispetto alla 13CO2 (secondo un fattore di ~27‰). In entrambi i casi, il processo discrimina l’isotopo pesante (Farquhar et al., 1989), quantitativamente meno presente nella miscela aria. Quando negli spazi intercellulari del mesofillo fogliare la concentrazione di CO2 diminuisce - e questo accade sia quando è maggiore l’assimilazione (A), che sottrae CO2 dall’apoplasto, sia quando è minore la conduttanza stomatica (gs), via d’ingresso della CO2 anche il tasso di discriminazione verso l’isotopo pesante diminuisce. Tale tasso viene comunemente espresso come ‰13C, che esprime il rapporto 13C/12C in relazione ad un rapporto isotopico standard (PeeDee Belemnite) (Craig, 1957). L’efficienza di uso dell’acqua (WUE, Water Use Efficiency) può essere espressa come rapporto tra A e gs o tra A e la traspirazione (E), che è funzione della gs e del deficit di pressione di vapore nell’aria. Sulla base di quanto detto, la WUE è maggiore se diminuisce la gs (cioè in presenza di chiusura stomatica) e/o se aumenta l’assimilazione (Pou et al., 2008). Chiusura stomatica ed assimilazione carbonica diminuiscono la concentrazione di CO2 intercellulare e di conseguenza la discriminazione verso la 13CO2. Sia la WUE che la regolazione stomatica sono quindi correlate al ‰13C. Per questo motivo il valore del ‰13C accumulato nei tessuti fogliari è indice dal regime stomatico (e fotosintetico) medio presente durante la vita della foglia. Durante la maturazione dell’acino, il saccarosio è floematicamente traslocato dalle foglie ai frutti e rapidamente convertito in glucosio e fruttosio (Davies e Robinson, 1996). Per questo motivo il rapporto trai due isotopi di carbonio negli zuccheri dell’acino maturo dipende dalla discriminazione isotopica avvenuta durante la fotosintesi nella foglia nel periodo Meccanismi di resistenza a stress idrico della vite della maturazione, come dimostrato da Di Marco et al. (1977). Partendo da questo presupposto, Gaudillère et al. (2002) hanno stabilito in 31 differenti genotipi una relazione tra il ‰13C nell’acino alla raccolta e lo stress idrico avvertito dalla pianta nell’estate del 1999 in un vigneto sperimentale a Ferrade, nel Bordolese. Ordinando i 31 genotipi a ‰ 13C decrescente, gli Autori hanno proposto un metodo per misurare la capacità di controllo stomatico dei differenti genotipi. Nel loro ranking, Riesling e Grenache superano il Syrah, dimostrando una maggior efficienza delle prime nel controllare stomaticamente lo stress idrico, come discusso dagli autori, o una migliore WUE, forse causata da una migliore assimilazione. In condizioni di stress idrico, si può quindi supporre che il δ ‰13C nella foglia o nell’acino sia indice del comportamento iso o anisoidrico dei differenti genotipi. Sviluppi di ricerca futuri Funzione delle acquaporine e trasduzione del segnale di acido abscissico (ABA) sono interconnesse durante le situazioni di stress idrico (Tyerman et al., 2002; Zhu et al., 2005). Tale regolazione appare strategica a livello di idraulica della radice (Vandeleur et al., 2008), di controllo dell’embolizzazione e del recupero degli embolismi (Lovisolo et al., 2008a), di regolazione dei flussi verso l’acino durante la maturazione (Foquet et al., 2008; Castellarin et al., 2007a), e più in generale dei meccanismi iso ed anisoidrici di risposta a stress idrico della vite. Oltre alla variabiltà intraspecifica di Vitis vinifera L, le relazioni idriche del portinnesto (per lo più ibridi di Vitis spp.) condizionano biosintesi e flussi da radice a foglia di ABA e ruolo delle acquaporine nella radice. In campo si dispone di innumerevoli combinazioni cultivar/portinnesto, le quali all’atto pratico possono presentare risposte assai peculiari a situazioni di stress idrico. Tali risposte potranno essere studiate in quest’ottica fisiologica, per poter prevedere e quindi esasperare o contenere le risposte della pianta, puntando ad ottimizzare i fenomeni di tolleranza della pianta. Questo nell’evidente prospettiva di migliorare gli aspetti del metabolismo della pianta, e soprattutto dell’acino, in tali situazioni. Ringraziamenti Gli autori ringraziano Andrea Schubert, nel laboratorio del quale hanno maturato l’esperienza nei diversi aspetti della fisiologia delle relazioni idriche della vite. Riassunto In questa review, affrontiamo i principali aspetti della resistenza della vite (Vitis vinifera L) a stress idrico, soffermandoci sulle risposte ecofisiologiche, fisiologiche e molecolari legate al metabolismo primario e secondario, soprattutto a livello di acino. Esaminiamo i meccanismi di elusione dello stress, relativi al controllo stomatico, al ruolo di segnale dell’acido abscissico, a quello del segnale idraulico (embolismi) e delle acquaporine. Descriviamo i diversi meccanismi di tolleranza, sia dal punto di vista dell’induzione e regolazione delle vie biosintetiche, sia dell’accumulo dei metaboliti derivati. In tutti gli aspetti esaminati, sottolineiamo le peculiarità varietali conosciute. Parole chiave: acquaporine, acido abscissico (ABA), polifenoli, aromi, analisi trascrittomica. Bibliografia AHARON R., SHAHAK Y., WININGER S., BENDOV R., KAPULNIK Y., G ALILI G., 2003. Overexpression of a plasma membrane aquaporin in transgenic tobacco improves plant vigor under favorable growth conditions but not under drought or salt stress. The Plant Cell 15: 439-447. A LEX A N D ER S S O N E., F R A Y S S E L., S J O V A LL -L A R SE N S., GUSTAVSSON S., FELLERT M., KARLSSON M., JOHANSON U., K JELLBOM P., 2005. Whole gene family expression and drought stress regulation of aquaporins. Plant Molecular Biology 59: 469-484. ALSINA M.M., DE HERRALDE F., ARANDA X., SAVÈ R., BIEL C., 2007. Water relations and vulnerability to embolism are not related: experiments with eight grapevine cultivars. Vitis 46 (1): 1-6. ASADA K., 1999. The water-water cycle in chloroplasts: scavenging of active oxygens and dissipation of excess photons. Annual Review of Plant Physiology and Plant Molecular Biology 50: 601-639. BACON M.A., WILKINSON S., DAVIES W.J., 1998. pH-regulated leaf cell expansion in droughted plants is abscisic acid dependent. Plant Physiology 118: 1507-1515. BAN T., ISHIMARU M., KOBAYASHI S., GOTO-YAMAMOTO S.N., HORIUCHI S., 2003. Abscisic acid and 2,4-dichlorophenoxyacetic acid affect the expression of anthocyanin biosynthetic pathway genes in ‘Kyoho’ grape berries. Journal of Horticoltural Science and Biotechnology 78: 586-89. BERTAMINI M., NEDUNCHEZHIAN N., 2002. Photoinhibition of photosynthesis in Vitis berlandieri and Vitis rupestris leaves under field conditions. Photosynthetica 40(4): 597-603. BERTAMINI M., ZULINI L., MUTHUCHELIAN K., NEDUNCHEZHIAN N., 2006. Effect of water deficit on photosynthetic and other physiological responses in grapevine (Vitis vinifera L. cv. Riesling) plants. Photosynthetica 44(1): 151-154. BINDON K.A., DRY P.R., LOVEYS B.R., 2007. Influence of plant water status on the production of C13-norisoprenoid precursors in Vitis vinifera L. cv Cabernet Sauvignon grape berries. Journal of Agricultural and Food Chemistry 55: 4493-4500. BRAVDO B., HEPNER Y., LOINGER S., COHEN S., TABACMAN H., 1985. Effect of irrigation and crop level on growth and wine quality of Cabernet Sauvignon. American Journal of Enology and Viticulture 36:132-139. 41 Ferrandino et al. BRAY E.A., 1997. Plant responses to water deficit. Trends in Plant Science 2: 48-54. CASTELLARIN S.D., MATTHEWS M.A., DI GASPERO G., GAMBETTA G.A., 2007a. Water deficits accelerate ripening and induce changes in gene expression regulating flavonoid biosynthesis in grape berries. Planta 227:101-112. C ASTELLARIN S.D., P FEIFFER A., S IVILOTTI P., D EGAN M., PETERLUNGER E., DI GASPERO G., 2007b. Transcriptional regulation of anthocyanin biosynthesis in ripening fruits of grapevine under seasonal water deficit. Plant, Cell and Environment 30 (11): 1381-1399. CHAVES M., 2002. Water stress in the regulation of photosynthesis in the field. Annals of Botany 89: 907-916. CIFRE J., BOTA J., ESCALONA J.M., MEDRANO H., FLEXAS J., 2005. Physiological tools for irrigation scheduling in grapevine (Vitis vinifera L). An open gate to improve water-use efficiency? Agriculture, Ecosystems and Environment 106: 159-170. COOMBE B.G., HALE C.R., 1973. The hormone content of ripening grape berries and the effects of growth substance treatments. Plant Physiology 51: 629-634. CRAIG H., 1957. Isotopic standards for carbon and oxygen and correlation factors for mass-spectrometric analysis of carbon dioxide. Geochimical Acta 12:133-149. CRAMER G.R., ERGUL A., GRIMPLET J. TILLET R.L., TATTERSAL A.R., BOHLMAN M.C., VINCENT D., SONDEREGGER J., EVANS J., OSBORNE C., QUILLICI D., SCHLAUCH K., SCHOOLEY D.A., CUSHMAN J.C., 2007. Water and salinity stress in grapevines: early and late changes in transcript and metabolite profiles. Functional Integrative Genomics 7: 111-134. DAVIES C., BOSS P.K., ROBINSON S.P., 1997. Treatment of grape berries, a nonclimateric fruit with a synthetic auxin, retards ripening and alters the expression of developmentally regulated genes. Plant Physiology 115: 1155-61. DAVIES C., ROBINSON S.P., 1996. Sugar accumulation in grape berries. Cloning of two putative vacuolar invertase cDNAs and their expression in grapevine tissues. Plant Physiology 111(1): 275–283. DI MARCO G., GREGO S., TRICOLI D., TURI B., 1997. Carbon isotope ratios ( 13 C/ 12 C) in fractions of field-grown grape. Physiologia Plantarum 41: 139-141. D RY P.R., L OVEYS B.R., M C C ARTHY M.G., S TOLL M., 2001. Strategic irrigation management in Australian vineyards. Journal international des Sciences de la Vigne et du Vin 35(3): 29-139. DRY P.R., LOVEYS B.R., 1999. Grapevine shoot growth and stomatal conductance are reduced when part of the root system is dried. Vitis 38: 151-156. ESCALONA J.M., FLEXAS J., MEDRANO H., 1999. Stomatal and non-stomatal limitations of photosynthesis under water stress in field-grown grapevines. Australian Journal of Plant Physiology 26: 421-433. FARQUHAR G.D., EHLERINGER J.R., HUBICK K.T, 1989. Carbon isotope discrimination and photosynthesis. Annual Review of Plant Physiology and Plant Molecular Biology 40: 503-537. FLEXAS J., BOTA J., LORETO F., CORNIC G., SHARKEY T.D., 2004. Diffusive and metabolic limitations to photosynthesis under drought and salinity in C3 plants. Plant Biology 6: 1-11. FOUQUET R., LEON C., OLLAT N., BARRIEU F., 2008. Identification of grapevine aquaporins and expression analysis in developing berries. Plant Cell Reports 27(9): 1541-1550. F UJITA M., F UJITA Y., M ARUYAMA K., S EKI M., H IRATSU K., O HME -T AKAGI M., T RAN L.S., Y AMAGUCHI -S HINOZAKI K., SHINOZAKI K., 2004. A dehydration-induced NAC protein, RD26, is involved in a novel ABA-dependent stress-signalling pathway. Plant Journal 39: 863-876. G ALMÉS J., P OU A., A LSINA M.M., T OMÀS M., M EDRANO H., FLEXAS J., 2007. Aquaporin expression in response to different water stress intensities and recovery in Richter-110 (Vitis 42 sp.): relationship with ecophysiological status. Planta 226: 671-681. GAMON J.A., PEARCY R.W., 1990a. Photoinhibition in Vitis californica: interactive effect of sunlight, temperature and water status. Plant Cell and Environment 13: 267-275. GAMON J.A., PEARCY R.W., 1990b. Photoinhibition in Vitis californica. The role of temperature during high-light treatment. Plant Physiology 92: 487-494. GAUDILLÈRE J.P., VAN LEEUWEN C., OLLAT N., 2002. Carbon isotope composition of sugars in grapevine, an integrated indicator of vineyard water status. Journal of Experimental Botany 53(369): 757-763. GIRIBALDI M., PERUGINI I., SAUVAGE S-X., SCHUBERT A., 2007. Analysis of protein changes during grape berry ripening by 2DE and MALDI-TOF. Proteomics 7 (17): 3154–3170. GOMEZ-DEL-CAMPO M., RUIZ C., BAEZA P., LISSARRAGUE J.R., 2003. Drought adaptation strategies of four grapevine cultivars (Vitis vinifera L.): Modification of the properties of the leaf area. Journal international des Sciences de la Vigne et du Vin 37 (3): 131-143. G RIMPLET J., D ELUC L.G., T ILLETT R.L., W HEATLEY M.D., SCHLAUCH K.A., CRAMER G.R., CUSKMAN J.C., 2007. Tissuespecific mRNA expression profiling in grape berry tissues. BMC Genomics 8 (187). GUAN X.Q., ZHAO S.J., LI D.Q., SHU H.R., 2004. Photoprotective function of photorespiration in several grapevine cultivars under drought stress. Photosynthetica 42(1): 31-36. HARTUNG W., RADIN J.W., HENDRIX D.L., 1988. Abscisic acid movement into the apoplastic solution of water-stressed cotton leaves: role of apoplastic pH. Plant Physiology 86: 908913. HAWKER J.S., WALKER R.R., 1978. The effect of sodium chloride on the growth and fruiting of Cabernet Sauvignon vines. American Journal of Enology and Viticulture 29:172-176. HOLMBERG N., BULOW L., 1998. Improving stress tolerance in plants by gene transfer. Trends in Plant Science 3: 61-66. JANG J.Y., KIM D.G., KIM Y.O., KIM J.S., KANG H., 2004. An expression analysis of a gene family encoding plasma membrane aquaporins in response to abiotic stresses in Arabidopsis thaliana. Plant Molecular Biology 54: 713-725. JEONG S.T., GOTO -Y AMAMOTO N., KOBAYASHI S., ESAKA M., 2004. Effects of plant hormones and shading on the accumulation of anthocyanins and the expression of anthocyanin biosynthetic genes in grape berry skins. Plant Science 167: 247-52. KALDENHOFF R., RIBAS CARBO M., FLEXAS SANS J., LOVISOLO C., H ECKWOLF M., U EHLEIN N., 2008. Aquaporins and Plant Water Balance. Plant, Cell and Environment 31 (5): 658-666. KELLER M., 2005. Deficit Irrigation and Vine Mineral Nutrition. American Journal of Enology and Viticulture 56 (3): 267-283. KENNEDY J.A., MATTHEWS M.A., WATERHOUSE A.L., 2002. Effect of maturity and vine water status on grape skins and wine flavonoids. American Journal of Enology and Viticulture 53: 268-274. KOUNDOURAS S., MARINOS V., GKOULIOTI A., KOTSERIDIS Y., VAN LEEUWEN C., 2006. Influence of vineyard location and vine water status on fruit maturation of nonirrigated cv Agiorgitiko (Vitis vinifera L.) effects on wine phenolic and aroma components. Journal of Agricultural and Food Chemistry 54: 5077-5086. KRAMER P.J., BOYER J.S., 1995. Water relations of plants and soils. Academic Press (San Diego). LEVITT J., 1972. Responses of plants to environmental stresses. Academic Press (New York). L O N G S.P., H U M P H R I ES S., F A LK O W S K I P.G., 1994: Photoinhibition of photosynthesis in nature. Annual Review of Plant Physiology and Plant Molecular Biology 45: 633662. Meccanismi di resistenza a stress idrico della vite LOVISOLO C., HARTUNG W., SCHUBERT A., 2002. Whole-plant hydraulic conductance and root-to-shoot flow of abscisic acid are independently affected by water stress in grapevines. Functional Plant Biology 29: 1349-1356. LOVISOLO C., SCHUBERT A., 1998. Effects of water stress on vessel size and xylem hydraulic conductivity in Vitis vinifera L. Journal of Experimental Botany 49 (321): 693-700. LOVISOLO C., SCHUBERT A., 2006. Mercury hinders recovery of shoot hydraulic conductivity during grapevine rehydration: evidence from a whole-plant approach. New Phytologist 172 (3): 469-478. LOVISOLO C., PERRONE I., HARTUNG W., SCHUBERT A., 2008a. An abscisic acid-related reduced transpiration promotes gradual embolism repair when grapevines are rehydrated after drought. New Phytologist 180 (3): 642-651. LOVISOLO C., TRAMONTINI S., FLEXAS J., SCHUBERT A., 2008b. Mercurial inhibition of root hydraulic conductance in Vitis spp. rootstocks under water stress. Environmental and Experimental Botany 63: 178-182. MARTRE P., NORTH G.B., NOBEL P.S., 2001. Hydraulic conductance and mercury-sensitive water transport of roots of Opuntia acanthocarpa in relation to soil drying and rewetting. Plant Physiology 126: 352-362. MATHIEU S., TERRIE N., PROCUREUR J., BIGEY F., GUNATA Z., 2005. A carotenoid cleavage dioxygenase from Vitis vinifera L. functional characterization and expression during grape berry development in relation to C13-norisoprenoid accumulation. Journal of Experimental Botany 56: 2721-2731. MATTHEWS M.A., ANDERSON M.M., 1988. Fruit ripening in Vitis vinifera L.: responses to seasonal water deficits. American Journal of Enology and Viticulture 39 (4): 313-320. M ATTHEWS M.A., I SHII R., A NDERSON M.M., O’M AHONY M., 1990. Dependence of wine sensory attributes on vine water status. Journal of the Science of Food and Agriculture, 51: 321-335. MAUREL C., VERDOUCQ L., LUU D-T, SANTONI V., 2008. Plant aquaporins: membrane channels with multiple integrated functions. Annual Review of Plant Biology 59: 595-624. MEDRANO H., BOTA J., ABADIA A., SAMPOL B., ESCALONA J.M., FLEXAS J., 2002. Effects of drought on light-energy dissipation mechanisms in high-light-acclimated, field-grown grapevines. Functional Plant Biology 29(10): 1197-1207. MEDRANO H., ESCALONA J.M., CIFRE J., BOTA J., FLEXAS J., 2003. A ten-year study on the physiology of two Spanish grapevine cultivars under field conditions: effects of water availability from leaf photosynthesis to grape yield and quality. Functional Plant Biology 30: 607-619. MOTT K.A., WOODROW I.E., 2000. Modelling the role of Rubisco activase in limiting non-steady-state photosynthesis. Journal of Experimental Botany 51: 399-406. M UNNS R., 2002. Comparative physiology of salt and water stress. Plant Cell and Environment 25: 239-250. NORTH G.B., MARTRE P., NOBEL P.S., 2004. Aquaporins account for variations in hydraulic conductance for metabolically active root regions of Agave desertii in wet dry and rewetted soil. Plant Cell and Environment 27: 219-228. OJEDA H., ANDARY C., KRAEVA E., CARBONNEAU A., DELOIRE A., 2002. Influence of pre- and postveraison water deficit on synthesis and concentration of skin phenolic compounds during berry growth of Vitis vinifera cv Shiraz. American Journal of Enology and Viticulture 53(4): 261-267. OLIVEIRA C., SILVA FERREIRA A.C., MENDES PINTO M., HOGG T., ALVES F., GUEDES DE PINHO P., 2003. Carotenoid compounds in grapes and their relationship to plant water status. Journal of Agriculture and Food Chemistry 51:5967-5971. OLSEN A.N., ERNST H.A., LEGGIO L.L., SKRIVER K., 2005. NAC transcription factors: structurally distinct, functionally diverse. Trends in Plant Science 10: 79-87. OSMOND B., BADGER M., MAXWELL K., BJORKMAN O., LEEGOOD R., 1997. Too many photons: photorespiration, photoinhibition and photooxidation. Trends in Plant Science 2(4): 119-121. PALLIOTTI A., SILVESTRONI O., PETOUMENOU D., VIGNAROLI S., BERRIOS J.G., 2008. Evaluation of low-energy demand adaptive mechanisms in Sangiovese grapevine during drought. Journal international des Sciences de la Vigne et du Vin 42 (1): 41-47. PASSIOURA J.B., MUNNS R., 2000. Rapid environmental changes that affect leaf water status induce transient surges or pauses in leaf expansion rate. Australian Journal of Plant Physiology 27: 941-948. PATAKAS A., 2000. Changes in the solutes contributing to osmotic potential during leaf ontogeny in grapevine leaves. American Journal of Enology and Viticulture 51: 223-226. PATAKAS A., NIKOLAU N., ZIOZIOU E., RADOGLOU K., NOITSAKIS B., 2002. The role of organic solute and ion accumulation in osmotic adjustment in drought-stressed grapevines. Plant Science 163: 361-367. PATAKAS A., NOITSAKIS B., 1997. Cell wall elasticity as a mechanism to maintain favorable water relations during leaf ontogeny in grapevines. American Journal of Enology and Viticulture 48(3): 352-356. PATAKAS A., NOITSAKIS B., 1999. Osmotic adjustment and partitioning of turgor responses to drought in grapevines leaves. American Journal of Enology and Viticulture 50 (1): 76-80. P EDREIRA DOS S ANTOS T., L OPES C.M., R ODRIGUES M.L., DE SOUZA C.R., RICARDO-DA-SILVA J.M., MAROCO J.P., PEREIRA J.S., CHAVES M.M., 2007. Effect of deficit irrigation strategies on cluster microclimate for improving composition of Moscatel field-grown grapevines. Scientia Horticulturae 112: 321-330. PEYROT DES GACHONS C., VAN LEEUWEN C., TOMINAGA T, SOYER J.P., GAUDILLÈRE J.P., DUBOURDIEU D., 2005. Influence of water and nitrogen deficit on fruit ripening and aroma potential of Vitis vinifera L cv Sauvignon blanc in filed conditions. Journal of the Science of Food and Agriculture 85: 73-85. P O N I S., B ER N I ZZO N I F., C I V A R D I S., 2007. Response of ‘Sangiovese’ grapevines to partial root-zone drying: gasexchange, growth and grape composition. Scientia Horticulturae 114: 96-103. POU A., FLEXAS J., ALSINA M.M., BOTA J., CARAMBULA C., DE HERRALDE F., GALMÉS J., LOVISOLO C., JIMÉNEZ M., RIBASC ARBO M., R USJAN D., S ECCHI F., T OMAS M., Z SÓFI Z., MEDRANO H., 2008. Adjustments of water-use efficiency by stomatal regulation during drought and recovery in the drought-adapted Vitis hybrid Richter-110 (V. berlandieri x V.rupestris). Physiologia plantarum 134 (2): 313 – 323. QUINTERO J.M., FOURNIER J.M., BENLLOCH M., 1999. Water transport in sunflower root systems: effects of ABA, Ca 2+ status and HgCl2. Journal of Experimental Botany 50: 1607-1612. RABBANI M.A., MARUYAMA K., HIRISHI A., KHAN M.A., KATSURA K., I TO Y., Y O S H I W A R A K., S EK I M., S H I N O Z AKI K., YAMAGUCHI-SHINOZAKI K., 2003. Monitoring the expression profiles of rice genes under cold, drought and high-salinity stresses and abscisic acid application using cDNA microarray and RNA gel-blot analyses. Plant Physiology 133: 1755-1767. RAVEN J.A., 1985. Regulation of pH and generation of osmolarity in vascular plants: a cost-benefit analysis in relation to efficiency of use of energy, nitrogen and water. New Phytologist 101: 25-77. ROBY G., HABERSTON J.F., ADAMS D.A., MATTHEWS M.A., 2004. Berry size and vine water deficits as factors in winegrape composition: anthocyanins and tannins. Australian Journal of Grape and Wine Research 10: 100-107. RODRIGUES M.L., SANTOS T.P., RODRIGUES A.P., DE SOUZA C.R., LOPES C.M., MAROCO J.P., PEREIRA J.S., CHAVES M.M., 2008. Hydraulic and chemical signalling in the regulation of sto- 43 Ferrandino et al. matal conductance and plant water use in field grapevines growing under deficit irrigation. Functional Plant Biology 35: 565-579. SCHREINER R.P., TARARA J.M., SMITHYMAN R.P., 2007. Deficit irrigation promotes arbuscular colonization of fine roots by mycorrhizal fungi in grapevines (Vitis vinifera L.) in an arid climate. Mycorrhiza 17: 551-562. S CHULTZ H.R., 2003. Differences in hydraulic architecture account for near isohydric and anisohydric behaviours of two field-grown Vitis vinifera L. cultivars during drought. Plant Cell and Environment 26: 1393-1405. SECCHI F., LOVISOLO C., UEHLEIN N., KALDENHOFF R., SCHUBERT A., 2007. Isolation and functional characterization of three aquaporins from olive (Olea europaea L.). Planta 225: 381392. SEKI M., NARUSAKA M., ISHIDA J., NANJO T., FUJITA M., OONO Y., KAMIYA A., NAKAJIMA M., ENJU A., SAKURAI T., SATOU M., AKIYAMA K., TAJI T., YAMAGUCHI-SHINOZAKI K., CARNINCI P., KAWAI J., HAYASHIZAKI Y., SHINOZAKI K., 2002. Monitoring the expression profiles of 7000 Arabidopsis genes under drought, cold and high-salinity stresses using a full-length cDNA microarray. Plant Cell 31: 279-292. SHANI U., WAISEL Y., ESHEL A., XUE S., ZIV G., 1993. Responses to salinity of grapevine plants with split root systems. New Phytologist 124: 695-701. S HINOZAKI K., Y AMAGUCHI -S HINOZAKI K., 2000. Molecular responses to dehydration and low temperature: differences and cross-talk between two stress signalling pathways. Current Opinion in Plant Biology 3: 217-223. S I E F RITZ F., T Y REE M.T., L OVI S OL O C., S CHUBER T A., KALDENHOFF R., 2002. PIP1 plasma membrane aquaporins in tobacco: from cellular effects to function in plants. The Plant Cell 14: 869-876. SOAR C.J., LOVEYS, B.R., 2007. The effect of changing patterns in soil-moisture availability on grapevine root distribution, and viticultural implications for converting full-cover irrigation into a point-source irrigation system. Australian Journal of Grape and Wine Research 13 (1): 2-13. SOAR C.J., SPEIRS J., MAFFEI S.M., PENROSE A.B., MCCARTHY M.G., LOVEYS B.R., 2006. Grape vine varieties Shiraz and Grenache differ in their stomatal response to VPD: apparent links with ABA physiology and gene expression in leaf tissue. Australian Journal of Grape and Wine Research (12):2-12. STEUDLE E., 2000. Water uptake by plant roots: an integration of views. Plant and Soil 226: 45-56. STOLL M., LOVEYS B., DRY P., 2000. Ormonal changes induced by partial rootzone drying of irrigated grapevine. Journal of Experimental Botany 51: 1627-1634. TAJI T., OHSUMI C., IUCHI S., SEKI M., KASUGA M., KOBAYASHI M., Y AMA GU CH I -S HI NOZ AKI K., S HI NOZ AKI K., 2002. Important roles of drought- and cold-inducible genes for galactinol synthase in stress tolerance in Arabidopsis thaliana. The Plant Journal 29: 417-426. TARDIEU F., 2003. Virtual plants: modelling as a tool for the genomics of tolerance to water deficit. Trends in Plant Science 8 (1): 9-14. TARDIEU F., SIMONNEAU T., 1998. Variability among species of stomatal control under fluctuating soil water status and evaporative demand: modelling isohydric and anisohydric behaviours. Journal of Experimental Botany 49: 419-432. T OUMI I., G ARGOURI M., N OUAIRI I., M OSCHOU P.N., S ALEM F NAYOU A., M LIKI A., Z ARROUK M., G HORBEL A., 2008. 44 Water stress induced changes in the leaf lipid composition of four grapevine genotypes with different drought tolerance. Biologia Plantarum 52 (1): 161-164. TYERMAN S.D., NIEMIETZ C.M., BRAMLEY H., 2002. Plant aquaporins: multifunctional water and solute channels with expanding roles. Plant, Cell and Environment 25: 173-194. V ANDELEUR R.K., M AYO G., S HELDEN M.C., G ILLIHAM M., KAISER B.N., TYERMAN S.D., 2008. The role of PIP aquaporins in water transport through roots: diurnal and drought stress responses reveal different strategies between isohydric and anisohydric cultivars of grapevine. Plant Physiology Preview November 5, 2008; 10.1104/pp.108.128645. VERA-ESTRELLA R., BARKLA B.J., BOHNERT H.J., PANTOIA O., 2004. Novel regulation of aquaporins during osmotic stress. Plant Physiology 135: 2318-2329. VERSLUES P.E., AGARWAL M., KATIYAR-AGARWAL S., ZHU J. AND ZHU J.K., 2006. Methods and concepts in quantifying resistance to drought, salt and freezing, abiotic stresses that affect plant water status. The Plant Journal 45: 523-539. V EZZULLI S., C IVARDI S., F ERRARI F., B AVARESCO L., 2007. Methyl jasmonate treatment as a trigger of resveratrol synthesis in cultivated grapevine. American Journal of Enology and Viticulture 58(4): 530-533. VINCENT D., ERGUL A., BOHLMAN M.C., TATTERSALE E.A.R., TILLETT R.L., WHEATLEY M.D., WOOLSEY R., QUILICI D.R., J OETS J., S CHLAUCH K., S CHOLLEY D.A., C USHMAN J.C., CRAMER G.R., 2007. Proteomic analysis reveals differences between Vitis vinifera L. cv Chardonnay and cv Cabernet Sauvignon and their responses to water deficit and salinity. Journal of Experimental Botany 58: 1873-1892. WADA H., SHACKEL K.A, MATTHEWS M.A., 2008. Fruit ripening in Vitis vinifera: apoplastic solute accumulation accounts for pre-veraison turgor loss in berries. Planta 227: 1351-1361. W ILKINSON S., D AVIES W.J., 2002. ABA-based chemical signalling: the co-ordination of responses to stress in plants. Plant Cell and Environment 25: 195-210. WILLIAMS P.J., CYNCAR W., FRANCIS I.L., GRAY J.D., ILAND P.G., COOMBE B.G., 1995. Quantification of glycosides in grapes, juices and wines through a determination of glycosyl-glucose (G-G). Journal of Agriculture and Food Chemistry 43: 121128. WU Y., JEONG B.R., FRY S.C., BOYER J.S., 2005. Change in XET activities, cell wall extensibility and hypocotyls elongation of soybean seedlings at low water potential. Planta 220: 593601. XIAO H., NASSUTH A., 2006. Stress- and development-induced expression of spliced and unspliced transcripts from two highly similar dehydrin 1 genes in V. riparia and V. vinifera. Plant Cell Reports 25: 968-977. XIAO H., TATTERSALE E.A.R., SIDDIQUA M.K., CRAMER G.R., NASSUTH A., 2008. CBF4 is a unique member of the CBF transcription factor family of Vitis vinifera and Vitis riparia. Plant Cell and Environment 31: 1-10. Y AMADA S., K OMORI T., M YERS P.N., K UWATA S., K UBO T., IMASEKI H., 1997. Expression of plasma membrane water channel genes under water stress in Nicotiana excelsior. Plant and Cell Physiology 38:1226-1231. Z HU C., S CHRAUT D., H ARTUNG W., S CHÄFFNER A.R., 2005. Differential responses of maize MIP genes to salt stress and ABA. Journal of Experimental Botany 56 (421): 2971-2981. ZIMMERMANN M.H., 1983. Xylem structure and the ascent of sap. Springer Verlag (Berlin).
Scarica