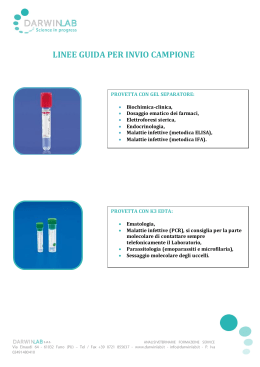
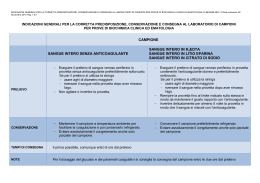
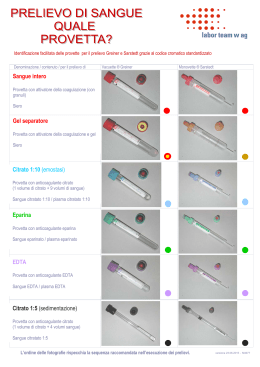
PRELIEVO EMATICO Il prelievo di sangue per ematologia e per test biochimici di routine o più sofisticati deve essere eseguito per venipuntura. Questʼultima dovrebbe essere eseguita in maniera meno traumatica possibile e abbastanza rapidamente e il campione altrettanto rapidamente trasferito nella provetta più appropriata al tipo di test da eseguire. Un prelievo traumatico o lento può attivare le piastrine e determinare la formazione di microtrombi nel campione. Tali microtrombi non sono visibili a occhio nudo ma possono interferire con le analisi ematologiche. Il trauma da prelievo può anche danneggiare le membrane eritrocitarie e causare emolisi. A meno che non si usi un sistema vacutainer per il prelievo, lʼago con cui questo viene effettuato, deve essere rimosso dal corpo della siringa prima di trasferire, con delicatezza, il sangue nella provetta, per evitare di danneggiare le cellule e per minimizzare lʼemolisi. Se, invece, si usano provette vacutainer, una volta che lʼago ha perforato il tappo della provetta, il sangue va lasciato defluire in essa senza esercitare ulteriori pressioni sul pistone della siringa. Se è necessario suddividere un singolo campione in differenti provette, è buona norma trasferire dapprima il sangue in una provetta vuota (da siero) e poi riempire quelle con anticoagulante, in modo da prevenire possibili contaminazioni del siero da parte di acido etilendiamino tetraacetico (EDTA), che interferirebbe con molte analisi. La contaminazione con EDTA, infatti, determina un aumento della concentrazione di potassio e una diminuzione della concentrazione di calcio e magnesio e dellʼattività della creatin-kinasi (CK) e della fosfatasi alcalina (ALP). Le provette vanno riempite esattamente con il volume di sangue indicato sulla provetta stessa e agitate capovolgendole alcune volte con delicatezza così da permettere unʼadeguata miscelazione del sangue con lʼanticoagulante (EDTA, sodio citrato, litio eparina o altro anticoagulante) che è già stato predosato in provetta dalla ditta produttrice. Eʼ anche importante raccogliere una quantità di sangue adeguata alle analisi che si devono eseguire, tenendo presente che il volume del plasma o del siero corrisponde a circa il 50-60% del volume totale del sangue prelevato. EMATOLOGIA Per le analisi ematologiche di routine, lʼanticoagulante dʼelezione è il sale di sodio o di potassio dellʼEDTA. Tra i vari anticoagulanti è quello che induce il minor numero di artefatti per quanto riguarda la morfologia delle cellule del sangue della gran parte dei mammiferi, anche se non è utilizzabile per campioni di sangue di specie aviarie o dei rettili in cui è necessaria la litio-eparina. Una scarsa quantità di sangue rispetto allʼanticoagulante ne causa la diluizione, abbassando le conte cellulari; al contrario, scarse quantità di EDTA rispetto al volume del campione porteranno alla formazione di coaguli. Coaguli di piccole dimensioni, che possono sfuggire a unʼosservazione macroscopica, possono alterare i parametri misurati dagli apparecchi automatici, con particolare riferimento alle conte piastriniche e leucocitarie. ESAMI BIOCHIMICI I test biochimici possono essere effettuati sia su siero, sia su plasma, anche se il siero è preferibile poiché riduce la probabilità di formazione di microcoaguli di fibrina e quindi i rischi di interferenza con lʼautocampionamento dellʼapparecchio. I sali di eparine (di sodio, ammonio o litio) legano e inibiscono la trombina, prevenendo la formazione di coaguli; il sangue deve quindi essere trattato rapidamente per ottenere il plasma, che può essere usato per molti test ormonali o biochimici di routine. Il plasma ottenuto da sangue intero conservato come tale o il plasma di campioni centrifugati ma non immediatamente separati contiene spesso piccoli coaguli che possono interferire con le procedure di analisi. Se è necessario utilizzare siero, bisogna usare provette vuote o contenenti gel separatori. Il sangue dovrebbe essere tenuto a temperatura ambiente fino a che non si forma il coagulo, solitamente circa 15 minuti nei piccoli animali, prima di essere centrifugato. Se la formazione del coagulo non è completa o la centrifugazione non adeguata in termini di velocità e tempo, possono formarsi coaguli di fibrina che possono creare problemi durante lʼanalisi. I coaguli, di qualunque dimensione essi siano, possono causare errori sia nelle prove ematologiche, sia in quelle biochimiche, nellʼemogasanalisi e nei test di coagulazione. La formazione di coaguli deve essere quindi evitata in ogni modo. Quando vengono utilizzate provette con gel separatori, non è necessario effettuare ulteriori manipolazioni del campione: dopo centrifugazione il gel separa le cellule e la loro continua attività metabolica, dal siero o dal plasma. La gran parte degli analiti non vengono disturbati dalla presenza di questa sostanza, ma le provette contenenti gel non possono essere usate quando si voglia effettuare il monitoraggio terapeutico di numerosi farmaci. Se, invece, si usano provette prive di gel, il siero o il plasma devono essere immediatamente rimossi con cautela dalla provetta e trasferiti quanto più rapidamente possibile in nuove provette (di plastica). Per evitare possibili errori nellʼidentificazione del campione, subito dopo essere state riempite tutte le provette devono essere contrassegnate con il nome dellʼanimale. Se i campioni destinati al dosaggio della glicemia devono essere conservati a lungo o spediti al laboratorio, il sangue dovrebbe essere posto in provette contenenti fluoruro/ossalato o disodio EDTA (KF+Na2 EDTA), che inibisce lʼenzima enolasi e, dopo centrifugazione, previene lʼossidazione del glucosio. Il sodio citrato lega il calcio e il plasma citrato è quindi usato per i test di coagulazione. Per questo tipo di esami è necessario osservare accuratamente il rapporto dellʼanticoagulante con il sangue, che dovrebbe essere 1:9 (1 parte di anticoagulante e 9 parti di sangue). Il sangue va quindi mescolato allʼanticoagulante invertendo delicatamente la provetta più volte, si procede il più presto possibile alla centrifugazione (comunque non più tardi di 2 ore dal prelievo) e si separa il plasma surnatante per trasferirlo in una provetta in plastica. Il campione così ottenuto va conservato congelato (-20°C) fino al momento dellʼinvio al laboratorio e trasportato in opportuni contenitori termici. MOMENTO DEL CAMPIONAMENTO Lo stato fisiologico può influenzare le caratteristiche del campione e, quindi, il momento del campionamento può essere molto importante, soprattutto per alcuni test. • Lʼesercizio, lʼeccitamento o la paura possono alterare alcuni parametri ematologici e determinare un aumento dei neutrofili e una diminuzione dei linfociti. Queste alterazioni sono comunemente rilevabili nei gatti giovani stressati dalle procedure di prelievo. • Anche lʼiperglicemia può essere un riscontro comune nei gatti, ancora una volta come conseguenza dello stress da prelievo. • La disidratazione può determinare aumenti dellʼematocrito. • Lʼassunzione di cibo può alterare numerosi parametri biochimici, in particolare colesterolo, trigliceridi e glucosio. A meno che non siano specificamente richiesti test post prandiali (es.: determinazione degli acidi biliari) è meglio sottoporre a prelievo solo animali che siano a digiuno da almeno 12 ore. In alcuni animali per eliminare lʼeffetto post-prandiale possono essere necessarie anche 24 ore di digiuno. • Per alcuni ormoni sono conosciute variazioni circadiane. In questi casi può essere opportuno standardizzare lʼora di prelievo, soprattutto se si devono poi confrontare i risultati di campionamenti sequenziali. Se i campioni devono essere destinati al monitoraggio di terapie farmacologiche, è importante standardizzare il momento del prelievo in modo che corrisponda al picco e al minimo livello di concentrazione ematica: questi momenti devono essere accuratamente registrati. Test particolari, come i test di tolleranza al glucosio e di stimolazione ormonale devono essere eseguiti secondo precisi protocolli che identificano i dosaggi da somministrare, i tempi di somministrazione e di prelievo. Anche in questo caso tutte le tempistiche vanno rigorosamente rispettate e riportate sulle provette. MANIPOLAZIONE DEL CAMPIONE Una volta che il campione è stato posto nelle apposite provette, deve essere processato il più rapidamente possibile. In caso di esami ematologici, è sempre buona norma fare uno o più strisci di sangue al momento del campionamento e farli asciugare rapidamente allʼaria. Sebbene lʼEDTA preservi bene la forma delle cellule, dopo qualche ora si cominciano ad apprezzare alterazioni morfologiche, soprattutto a carico dei leucociti. Prima della spedizione e/o dellʼanalisi i campioni vanno conservati in frigorifero. Gli strisci di sangue e gli strisci citologici non devono essere refrigerati né posti a contatto con vapori di formalina. I campioni di sangue per separare plasma o siero devono essere maneggiati con cautela per evitare di provocare emolisi e, dopo centrifugazione, per plasma o siero sono previsti il trasferimento nelle apposite provette e la conservazione alla temperatura più indicata (refrigerazione o congelamento) a seconda dellʼanalisi da eseguire. INVIO DEI CAMPIONI AL LABORATORIO Lʼinvio dei campioni con modalità inappropiate può essere causa di numerosi errori di laboratorio e, in casi estremi, può determinare la non accettazione del campione da parte del laboratorio stesso. In generale bisogna inviare un quantitativo adeguato di sangue, che va posto nella provetta appositamente richiesta dal laboratorio per quel determinato esame, e bisogna indicare chiaramente sulla provetta i dati identificativi del paziente. Insieme al campione va sempre inviato un modulo di accompagnamento (il modello è possibile scaricarlo dal sitoweb) dove vanno indicati gli esami richiesti, lʼidentificazione del paziente (nome, numero id, specie, età, razza e sesso) e un breve riassunto dellʼanamnesi e dei dati clinici, comprese le informazioni relative alle terapie farmacologiche eseguite o ai prodotti trasfusionali somministrati. I campioni dovrebbero essere inviati al laboratorio per mezzo di un corriere espresso o di un servizio postale efficiente e dovrebbe giungere in laboratorio nel più breve tempo possibile, in modo da evitare artefatti da conservazione prolungata.
Scaricare