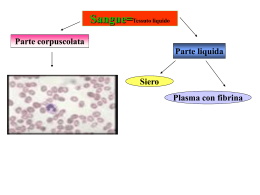
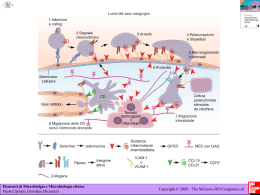
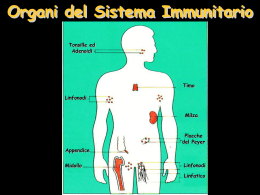
1 Capitolo 3. Cellule e tessuti del sistema immunitario adattativo Le cellule del sistema immunitario adattativo sono normalmente presenti come cellule circolanti nel sangue e nella linfa, come aggregati negli organi linfoidi e come cellule sparse praticamente in ogni tessuto. Le caratteristiche salienti di questo sistema sono • Presenza di tessuti specializzati, detti organi linfoidi periferici, che concentrano gli antigeni in ingresso. Gli antigeni vengono trasportati qui dalle APC per il riconoscimento da parte dei linfociti. • I linfociti naive migrano attraverso gli organi linfoidi periferici dove riconoscono gli antigeni e iniziano le risposte immunitarie. Linfociti effettori e della memoria si sviluppano dalla progenie dei linfociti naive stimolati in questo modo. • Linfociti effettori e della memoria circolano nel sangue verso i siti di ingresso antigenico dove vengono efficacemente trattenuti. 1.1 1.1.1 Cellule del sistema immunitario adattativo Linfociti I linfociti sono le uniche cellule in grado di riconoscere e distinguere i vari determinanti antigenici e sono per questo le uniche responsabili della specificità e della memoria del sistema. A dimostrazione del ruolo linfocitario: • Si può ottenere immunità protettiva per trasferimento da individui immuni a individui suscettibili di linfociti e loro derivati. • Alcune immunodeficienze, sia congenite che acquisite, sono associate a riduzione linfocitaria. • La stimolazione in vitro dei linfociti produce reazioni simili a quelle in vivo. • I recettori specifici per gli antigeni sono prodotti dai linfociti e da nessun’altra cellula. I linfociti consistono di diverse famiglie differenti in funzionalità e in prodotti proteici, tuttavia molto simili dal punto di vista morfologico. I linfociti B, le cellule che producono anticorpi, sono così chiamati perchè negli uccelli maturano nella borsa di Fabrizio. Nei mammiferi i primi stadi di maturazione di queste cellule si svolgono invece nel midollo osseo. I linfociti T sono così chiamati per via dei loro precursori che originano nel midollo ma migrano e maturano nel timo. I linfociti B e T consistono poi di sottogruppi con funzioni e caratteristiche fenotipiche distinte. I maggiori gruppi dei B sono le cellule B follicolari, le cellule B marginali e le cellule B-1; per i linfociti T i maggiori sottogruppi sono i linfociti T-Helper e i linfociti T-Citotossici cui recentemente si sono aggiunti i linfociti T CD4+ regolatori. I linfociti B e T hanno recettori antigenici distribuiti in modo clonale, esistono cioè molti cloni di queste cellule con diverse specificità. I geni che codificano i recettori sono formati per ricombinazione di segmenti di DNA durante la maturazione: essendo questo un evento in parte random il numero di combinazioni generabile è nell’ordine dei milioni. Alcuni sottogruppi, ad esempio le cellule B-1, sono limitati nell’uso dei loro segmenti di DNA e quindi il loro repertorio è molto limitato. Le proteine di membrana espresse dalle varie popolazioni linfocitarie possono essere usate per distinguere le varie classi. Ad esempio molti linfociti T-Helper presentano la molecola CD4 mentre molti dei T-Citotossici presenta la molecola CD8. La nomenclatura dei markers linfocitari usa il numero CD, dove CD sta per Cluster di Differenziazione. 1 Classe Linfociti T αβ CD4+ helper CD8+ citotox Regolatori Linfociti T γδ Linfociti B Cellule NK Cellule NK-T Funzione Recettore/specificità Markers Attivazione macrofagi Differenziazione linfociti B Uccisione diretta di cellule infette e tumorali Regolazione/tolleranza Helper e citotossica Produzione Ig Citotossicità diretta Regolazione TCR αβ Complessi peptide-MHCII TCR αβ Complessi peptide-MHCI TCR αβ TCR αβ Ig Rec. attivanti e inibitori TCR αβ per lipidi-CD1 CD3+ , CD4+ , CD8− CD3+ , CD4− , CD8+ CD3+ , CD4+ , CD25+ CD3+ , altri CD variabili Recettori Fc, MHCII, CD19 e 21 CD16+ CD16+ , CD3+ Sviluppo e attivazione dei linfociti I linfociti, come ogni cellula del sangue dopo la nascita, originano da cellule staminali nel midollo osseo. Tutte le popolazioni vanno poi incontro ad una complessa maturazione durante la quale esprimono i recettori antigenici e acquisiscono le giuste caratteristiche morfofunzionali. I linfociti B maturano in parte nel midollo osseo, entrano in circolo, popolano gli organi linfoidi periferici e completano li la loro maturazione. I linfociti T maturano completamente nel timo ed entrano poi in circolo per popolare anch’essi gli organi linfoidi periferici. Le cellule B e T mature sono dette linfociti naive. A seguito di attivazione antigenica, i linfociti vanno poi incontro a successive modifiche fenotipiche e funzionali. L’attivazione dei linfociti è composta di una serie di step della quale il primo è la sintesi di nuove proteine, tra le quali recettori per le citochine e citochine, passo richiesto per i cambiamenti successivi. Le cellule naive vanno incontro a proliferazione in un processo detto espansione clonale: il numero di cellule T specifiche può aumentare di 5·105 mentre quello di cellule B di 5·103 . In associazione all’espansione clonale si ha anche il differenziamento in cellule effettrici, la cui funzione è eliminare l’antigene. Alcuni linfociti stimolati si differenziano in cellule della memoria, la cui funzione è invece mediare la risposta secondaria a esposizioni successive allo stesso antigene. Le caratteristiche fondamentali delle varie fasi linfocitarie sono: • Linfociti naive. I linfociti naive sono linfociti T o B maturi che non hanno mai incontrato un antigene: questa condizione può durare al massimo tre mesi prima di attivare l’apoptosi. Questi linfociti sono difficili da riconoscere morfologicamente ma in generale sono abbastanza piccoli. Il loro ciclo cellulare è bloccato in fase G0 e si sbloccherà solo a seguito di stimolazione. La sopravvivenza dei linfociti naive dipende dall’attività dei recettori antigenici, probabilmente stimolati da auto antigeni, e dalle citochine. Probabilmente i naive riconoscono debolmente vari antigeni self in modo da garantirsi una sopravvivenza a livello basale. Le citochine sono fondamentali e i naive esprimono recettori in modo costituitivo: fondamentale è in particolare IL-7 e il fattore attivante le cellule B (BAFF). • Linfociti effettori. A seguito di attivazione i linfociti naive diventano più grandi, proliferano e prendono il nome di linfoblasti. Alcune di queste cellule differenziano poi in linfociti effettori, tra i quali si inseriscono i linfociti T-Helper, i linfociti T-Citotossici e le cellule B secernenti anticorpi. Le cellule helper, solitamente CD4+ , esprimono in superficie molecole come CD40L e secernono citochine che interagiscono con macrofagi e linfociti B. Sia le cellule effettrici CD4+ che le CD8+ presentano proteine che ne indicano la recente attivazione, tra cui CD25 e molecole MHC-II. Dato importante è che la maggior parte dei linfociti T effettori ha vita breve e non si rinnova. Molte delle cellule B secernenti anticorpi sono riconoscibili morfologicamente come plasmacellule: si tratta di cellule con citoplasma ricco e con un RE sviluppato. Si stima che in queste cellule metà dell’RNA messaggero sia dedicato agli anticorpi. • Cellule della memoria. Le cellule della memoria possono sopravvivere per anni dopo l’eliminazione dell’antigene e possono essere identificate dalla loro espressione di proteine superficiali. I linfociti B della memoria esprimono certe classi di Ig di membrana, tipo IgG, IgE o IgA, mentre le cellule B naive esprimono solo IgM e IgD. Inoltre nell’uomo la maggior parte dei linfociti T naive esprime un’isoforma della proteina superficiale CD45 di 200kD mentre le cellule della memoria la esprimono di 180kD in quanto soggetta a splicing. Le cellule della memoria sono eterogenee; 2 alcune, dette cellule T della memoria centrali, migrano preferenzialmente nei linfonodi, altre, dette cellule della memoria effettrici, circolano nel sangue o risiedono nelle mucose. 1.1.2 APC Una APC è una cellula che presenta gli antigeni ai linfociti T. Le principali APC sono le cellule dendritiche. Un tipo specializzato di APC, detto cellula dendritica follicolare, presenta gli antigeni ai linfociti B durante fasi particolari delle risposte umorali. Le APC collegano le risposte innate alle risposte adattative, e fanno parte dunque di entrambi i sistemi. Cellule dendritiche Le cellule dendritiche derivano da precursori midollari e si trovano in molti organi, dove catturano gli antigeni estranei e li trasportano agli organi linfoidi periferici. Le cellule dendritiche presentano diversi recettori superficiali, tra i quali i TLR, che riconoscono i PAMPs e trasducono segnali di attivazione intracellulari. Una volta attivate queste cellule diventano mobili e migrano ai tessuti linfodi periferici, dove presentano l’antigene ai linfociti T. Fagociti mononucleati I macrofagi contenenti microbi ne presentano gli antigeni alle cellule T differenziate effettrici, le quali attivano poi i macrofagi per uccidere i microbi stessi. Questo processo è il più importante meccanismo di immunità cellulo mediata nei confronti dei microbi intracellulari. La funzione dei fagociti mononucleati è la fagocitosi e la produzione delle citochine che reclutano e attivano altre cellule nell’ambito della risposta innata; in ambito adattativo i macrofagi hanno ruolo nella digestione ad esempio dei patogeni opsonizzati. Cellule dendritiche follicolari Le FDC sono presenti nei follicoli linfatici di linfonodi, milza e tessuti linfoidi delle mucose e non sono derivate da precursori midollari. Le FDC intrappolano gli antigeni in complesso con gli anticorpi o i prodotti del complemento e li presentano per il riconoscimento da parte dei linfociti B. 1.2 Anatomia e funzioni dei tessuti linfoidi Nei mammiferi adulti i tessuti linfoidi primari, cioè generativi, sono il midollo osseo e il timo; i tessuti linfoidi secondari sono invece i linfonodi, la milza, il sistema immunitario cutaneo e quello delle mucose. Aggregati poco definiti di linfociti si trovano poi nel connettivo e in quasi ogni altro organo ad eccezione del SNC. 1.2.1 Midollo osseo 3 Il midollo osseo è l’unica sede di ematopoiesi nell’adulto; gravi danni a questo tessuto o forte richiesta di nuove cellule ematiche causano il reclutamento di milza e fegato come sede di ematopoiesi extramidollare. Tutte le cellule ematiche originano da una comune cellula staminale ematopoietica, che si differenzia poi lungo particolari linee. Le cellule staminali mancano dei marker delle cellule differenziate, ed esprimono invece due proteine dette CD34 e Sca-1 (Stem Cell Antigen -1). La proliferazione e la maturazione dei vari precursori cellulari nel midollo sono stimolate dalle citochine. Le citochine ematopoietiche vengono prodotte dalle cellule stromali e dai macrofagi del midollo, creando così un ambiente locale ematopoietico. 1.2.2 Timo Il timo è la sede di maturazione delle cellule T e ha parenchima diviso in corticale e midollare. La corticale appare come una densa regione fatta di linfociti T, mentre la midollare è meno densamente popolata. I linfociti nel timo, detti anche timociti, sono linfociti T a vari stadi di maturazione; in generale le cellule più immature sono verso la corticale, e le più pronte sono verso la midollare. 1.2.3 Linfonodi e sistema linfatico Il fluido interstiziale riassorbito, la linfa, scorre lungo i vasi linfatici i quali drenano nei seni sottocapsulari dei linfonodi. I vasi linfatici efferenti dei vari linfonodi si congiungono poi per terminare nel dotto toracico che scarica la linfa nella vena cava superiore, riconsegnando al flusso ematico. Il volume di linfa prodotta al giorno è circa due litri. Le cellule dendritiche catturano gli antigeni microbici ed entrano nei vasi linfatici (altri antigeni entrano invece in forma libera); i linfonodi agiscono da filtro e sondano la linfa: tutti gli antigeni e le citochine infiammatorie raggiungono dunque questi tessuti. Giunte nei linfonodi, le cellule dendritiche presentano gli antigeni ai linfociti T naive per iniziare le risposte immunitarie adattative. Ogni linfonodo è avvolto da una capsula fibrosa perforata da parecchi vasi linfatici in arrivo, che svuotano la loro linfa nel seno sottocapsulare. Oltre il seno la corteccia esterna presenta aggregati di cellule detti follicoli, alcuni dei quali contenenti un’area centrale detta centro germinativo. I follicoli privi di centro germinale sono detti primari, quelli dotati sono detti secondari. I follicoli sono zone costituite da linfociti B; i follicoli primari contengono principalmente linfociti B naive, quindi maturi, mentre i centri germinali sono sedi di sviluppo che appaiono in seguito a stimolazione antigenica. I linfociti T sono collocati principalmente in profondità, nei cordoni paracorticali. Il 70% di questi è CD4+ mentre i CD8+ sono più rari anche se le proporzioni possono variare molto durante le infezioni. La segregazione anatomica delle diverse tipologie di linfociti è dipendente da citochine. I linfociti T e B naive vengono consegnati al nodo attraverso un’arteria, in particolare entrano nel tessuto attraverso vasi specializzati detti venule ad endotelio alto. I linfociti T naive esprimono il recettore CCR7 che lega le chemochine CCL19 e CCL21 prodotte nelle regioni delle cellule T. Le cellule dendritiche esprimono anch’esse CCR7 e per questo migrano nella stessa regione delle cellule T. I linfociti B naive esprimono invece il recettore CXCR5 che riconosce la chemochina CXCL13, prodotta esclusivamente nei follicoli. La segregazione anatomica garantisce che ogni popolazione sia in contatto con la corretta APC: cellule dendritiche per i T, FDC per i B. A seguito di stimolazione antigenica i linfociti B e T perdono i loro confini anatomici e diventano liberi di migrare reciprocamente. 1.2.4 Milza La milza, organo di 150g nell’adulto, appare suddivisa in polpa bianca e polpa rossa. Le regioni ricche in linfociti dell’organo sono la polpa bianca e si presentano organizzate intorno ad un’arteriola centrale. L’arteria centrale è circondata da un manicotto di linfociti, quasi tutti T, che forma la guaina linfoide periarteriolare. Numerosi piccoli rami dell’arteriola centrale passano attraverso le guaine e drenano in un seno vascolare detto seno marginale. Oltre il seno marginale esiste una regione distinta, detta zona marginale, che forma il limite della polpa bianca ed è costituita da linfociti B e macrofagi specializzati. La segregazione dei linfociti T nelle guaine e dei B nei follicoli e nelle zone marginali è un processo dipendente da citochine e chemochine come nel caso dei linfonodi: CXCR5/CXCL13 per i B, CCR7/CCL19-CCL21 per i T. 4 La milza è anche un importante organo per la filtrazione del sangue. Rami arteriolari dell’arteria splenica terminano in una vasta rete di sinusoidi al cui interno sono presenti molti eritrociti, macrofagi e cellule dendritiche oltre a linfociti e plasmacellule: è questa la polpa rossa. La polpa rossa purifica il sangue dai microbi e dai globuli rossi danneggiati. La milza è la principale sede di digestione dei microbi opsonizzati: individui che ne sono privi sono quindi particolarmente suscettibili a infezioni da preumococco e meningococco, batteri per i quali l’opsonizzazione è la principale via di eliminazione. 1.2.5 Sistema immunitario cutaneo Le principali popolazioni cellulari dell’epidermide sono cheratinociti, melanociti, cellule del Langerhans epidermiche e cellule T intraepiteliali. Le cellule del Langerhans sono le cellule dendritiche immature del sistema immunitario cutaneo: formano una sorta di rete continua capace di catturare antigeni. Quando queste cellule incontrano un antigene diventano mobili, iniziano ad esprimere il recettore CCR7 e seguono le chemochine fino ad arrivare ai linfonodi. 1.2.6 Sistema immunitario mucosale Nella mucosa del tratto GI i linfociti sono reperibili in tre regioni principali: lo strato epiteliale, nella lamina propria come elementi sparsi o nella lamina propria in gruppi organizzati come le placche del Peyer. La maggior parte di quelli epiteliali è di tipo T, quasi tutti CD8+ . La lamina propria intestinale contiene una popolazione mista di cellule che include linfociti T per la maggior parte CD4+ con fenotipo di cellula attiva; esiste anche un grande numero di linfociti B attivati e plasmacellule, ma anche macrofagi, cellule dendritiche, eosinofili e mastociti. In aggiunta ai linfociti sparsi esistono queste regioni organizzate tra le quali le più importanti sono le placche del Peyer. Le regioni centrali di questi follicoli sono ricche in cellule B e spesso contengono centri germinali; le placche del Peyer presentano inoltre alcune cellule T CD4+ . Follicoli simili alle placche sono frequenti nell’appendice e in buona parte dei tratti GI e respiratori. Le tonsille faringee sono infine follicoli linfoidi analoghi alle placche. 1.3 Vie e meccanismi di homing e ricircolo linfocitario I linfociti naive si muovono dalla circolazione ai linfonodi e viceversa per parecchie volte, finchè non incontrano l’antigene che sono in grado di riconoscere. Questo ricircolo linfocitario permette al piccolo numero di linfociti naive di cercare il loro specifico antigene attraverso il corpo. Alcuni linfociti attivati migreranno poi verso particolari tessuti, come ad esempio la pelle o l’intestino: questo processo di migrazione selettiva è detto homing. I meccanismi di migrazione linfocitaria sono simili a quelli di migrazione degli altri leucociti ai siti infiammatori. Le molecole di adesione espresse sui linfociti sono spesso dette recettori homing e i loro ligandi espressi dalle cellule endoteliali sono detti adressine. Le chemochine coinvolte nel traffico linfocitario sono prodotte in maniera costituiva dagli organi linfatici secondari e in maniera inducibile ai siti di infezione. Il meccanismo di homing è estremamente efficente, e il flusso netto di linfociti attraverso i linfonodi è pari a 25 · 109 unità giornaliere. Un’infiammazione periferica è in grado di generare un significativo calo nell’afflusso linfocitario ai linfonodi e un contemporaneo aumento di quello ai siti infiammatori: questo meccanismo transiente coinvolge gli interferoni alfa e beta. 1.3.1 Homing dal sangue ai linfonodi dei linfociti T I linfociti T naive migrano nello stroma dei linfonodi attraverso venule postcapillari modificate dette ad endotelio alto, le quali esprimono molecole di adesione e chemochine particolari. La sequenza di eventi è sempre la stessa per qualsiasi passaggio, in particolare: 1. Il rolling è in questo caso mediato dalla selectina-L che lega una adressina (PNAd, Peripheral Node Addressin) sul’endotelio delle venule ad endotelio alto. 2. L’adesione stabile è mediata dalle integrine LFA-1 e VLA-4. 5 3. L’affinità delle integrine è aumentata dalle chemochine CCL19 e CCL21, delle quali in particolare la prima è costitutivamente espressa dalle venule ad endotelio alto. Per entrambe queste molecole il recettore è CCR7. Le cellule naive andate incontro ad homing ma che non hanno incontrato l’antigene ritornano al flusso sanguigno in un processo dipendente da un chemoattrattore detto sfingosina 1-fosfato (S1P); questa molecola è concentrata nel sangue e nei linfonodi rispetto ai tessuti. S1P lega un recettore (S1P1) accoppiato a proteina G specifico e i segnali che si generano stimolano il movimento delle cellule T naive lungo il gradiente S1P, quindi al di fuori del parenchima nodale. I linfociti T naive circolanti esprimono poco il recettore per S1P in quanto essendo la molecola concentrata nel sangue si ha internalizzazione del recettore. Quando un naive entra nel linfonodo servono poi ore per ripristinare il recettore e quindi si ha tempo di interagire con le APC. A seguito dell’attivazione il linfocita riduce l’espressione di S1P1 e rimane nel linfonodo per alcuni giorni, il tempo di differenziarsi; a differenziazione avvenuta S1P1 torna ad essere espresso e la cellula lascia il linfonodo in direzione dei tessuti periferici. La migrazione delle cellule T naive nella milza è meno regolata, e il trasferimento è guidato da fattori passivi piuttosto che dal coinvolgimento di selectine, integrine o chemochine. Pur essendo una migrazione meno efficiente, il numero di linfociti di passaggio per la milza è enorme: almeno metà del totale attraversa l’organo ogni giorno. 1.3.2 Migrazione ai siti infiammatori Un aspetto fondamentale della differenziazione dei naive in effettori è il cambiamento dei recettori per le chemochine e delle molecole di adesione: questo ne cambia il comportamento migratorio. L’espressione delle molecole coinvolte nell’homing delle cellule naive cala subito dopo l’attivazione antigenica: le cellule effettrici in questo modo non sono più costrette a stare nel linfonodo. L’uscita dal nodo è guidata anche dalla via di S1P e del suo recettore S1P1. Le cellule effettrici esprimono molecole di adesione e recettori per chemochine che legano molecole tipicamente presenti sulle cellule endoteliali ai siti infiammatori. Alcune cellule effettrici hanno propensione per tessuti particolari, e la selettività è acquisita nel processo di differenziazione. In questo modo il sistema adattativo dirige cellule specializzate alle loro sedi preferenziali in modo da gestire infezioni di tipo particolare. Ad esempio le cellule effettrici della pelle esprimono il ligando CLA-1 per la selectina E, e i recettori CCR4 e CCR10 per le chemochine CCL17 e CCL27, tutte molecole tipiche della cute infiammata. 1.3.3 Migrazione delle cellule della memoria Sono state definite due tipologie di cellule della memoria: centrali ed effettrici. Le cellule centrali tipicamente migrano agli organi linfoidi secondari mentre le effettrici ai tessuti periferici. In generale le cellule dirette ai tessuti periferici rispondono a stimolazione antigenica con una rapida produzione di citochine mentre quelle dirette ai tessuti linfoidi secondari tendono a proliferare di più e a fornire funzioni di supporto alle cellule B. 1.3.4 Homing dei linfociti B I linfociti B immaturi abbandonano il midollo e entrano nella milza dove maturano come cellule B follicolari o cellule B marginali. Quando le cellule B follicolari maturano queste migrano nella polpa bianca in risposta ad una chemochina, CXCL13, che lega il recettore CXCR5 e alle chemochine CCL19 e CCL21 che legano il recettore CCR7. Quando la maturazione è completa nella polpa bianca i linfociti B naive rientrano in circolo e si dirigono ai linfonodi. L’homing dei B naive ai linfonodi coinvolge molecole già viste: la selectina-L, CCR7, LFA1 (che lega PNAd), CCL19, CCL21 e ICAM-1. In aggiunta i naive esprimono il recettore CXCR4 che lega la chemochina CXCL12. Una volta entrati nello stroma degli organi linfoidi secondari i linfociti B migrano nei follicoli grazie alla chemochina CXCL13 (ma nel caso delle placche del Peyer la molecola è CXCR5). 6
Scaricare