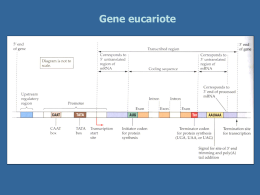
Nei sistemi modello approcci di modificazione genetica che producono o sequenze genetiche alterate o espressione genetica alterata fenotipo alterato. Correlazione tra fenotipo alterato, o a livello cellulare, o di un embrione precoce, o di un organismo intero, con cambiamenti di un gene specifico indizi sul funzionamento normale di un gene. Nei sistemi modello sono stati usati due tipi di analisi: Genetica classica o in avanti (fenotipo gene); Genetica inversa (gene fenotipo). Organismo modello: topo. Cellule umane in coltura (HeLA e HEK293). Inattivazione genica selettiva (knock-out genico). Tecnologia antisenso (know-down). Si progettano RNA od oligonucleotidi che hanno una sequenza complementare a quella dei trascritti di RNA prodotti da un gene di interesse. Ibridandosi con i trascritti senso, i costrutti antisenso bloccano l’espressione genica (knock-down genico). La tecnologia antisenso è stata sviluppata negli anni ’80: RNA antisenso; Oligodesossinucleotidi antisenso (più stabili); Morfolino oligonucleotidi antisenso. E’ il metodo principale per valutare la funzione di un gene nelle cellule di mammifero in coltura. Sfrutta una via metabolica naturale delle cellule nella quale la formazione di un dsRNA induce un’inattivazione genica specifica. RISC: RNA-incuced silencing complex Alterare direttamente un gene endogeno Modificazione del gene Gene mutato: per cambiare un aa, o motivi, o scambiare domini, ecc. A livello del DNA: know-out genico cambiamento della linea germinale. Inattivazione del gene A livello del RNA: know-down genico. Inattivazione del gene A livello proteico: blocco della proteina legandosi ad altre molecole x eliminare la funzione Dominanti negativi aptameri Intracorpi Inattivazione del gene A livello del RNA knock-down genico Interferenza dell’RNA (iRNA) Oligonucleotidi morfolino antisenso Inattivazione del gene A livello del DNA knock-out genico Knock-out casuali del gene: matagenesi casuale usando mutageni chimici Knock-out genico mirato: inattivazione di un gene predeterminato Aggiungere una copia di un gene esogeno Espressione del transgene Sovra-espressione: accoppiandolo ad un promotore forte Espressione ectopica: in cellule non usuali od in tempi diversi I modelli animali sono molto preziosi per aiutarci a capire la funzione di un determinato gene e i processi che portano ad una malattia, permettendo dettagliate analisi fisiologiche, o biomolecolari, e cellulari di una patologia. Sono anche fondamentali per studiare l’effetto di farmici o nuove terapie cliniche prima di passare alla sperimentazione sull’uomo. Primati non umani, altri mammiferi (topi, ratti), altri vertebrati (polli, rane, pesce zebrafish), ed invertebrati (C. elegans, D. melanogaster). I roditori, in quanto mammiferi, sono abbastanza simili all’uomo sotto l’aspetto fisiologico, biochimico e genetico, ed hanno dei grossi vantaggi pratici. Organismo transgenico: organismo che porta materiale genetico trasferito che è stato inserito in un sito casuale del suo genoma (acquisizione di funzione). Gene targeting: la sostituzione o la mutazione di un gene fornisce il mezzo per creare ceppi di organismi “knockout” con mutazioni praticamente in qualunque gene. La clonazione: la produzione di animali geneticamente identici mediante trasferimento del nucleo di una cellula somatica adulta in un uovo non fecondato. Metodo di introduzione del DNA Cellula Risultato ricevente Uso comune nell’analisi di espressione genica Tecnologia Transgenica Microiniezione nel pronucleo Uovo fecondato Integrazione casuale del transgene Analisi di guadagno di funzione Gene targeting Ricombinazione Embrione omologa in cellule allo stato staminali embrionali di blastocisti Interruzione o mutazione del gene bersaglio Analisi di perdita di funzione Clonazione mediante trasferimento nucleare Trasferimento dell’intero nucleo Individuo geneticament e identico al nucleo donatore Analisi della riprogrammazione del genoma Uovo non fecondato enucleato I transgeni possono essere inseriti nella linea germinale per trasferimento genico diretto nello zigote, nei gameti o nelle cellule embrionali o somatiche. Tre passaggi principali per creare topi transgenici: 1. Microiniezione di DNA nel pronucleo di un uovo fecondato di topo. 2. Impianto dell’embrione microiniettato in una madre surrogata. Analisi dei cuccioli della prima e successive generazioni per stabilire l’integrazione stabile e l’espressione del transgene. Espressione inducibile di un transgene Espressione del transgene regolata dal sistema inducibile della tetraciclina XX Sistema di induzione che agisce a livello post-trascrizionale, ovvero direttamente sul controllo dell’attività della proteina di interesse. Sistema di induzione rapido. Regolazione post-trascrizionale del recettore degli estrogeni. targeting: 1990 Mario Capecchi topi omozigoti per la perdita del protoncogene int-1 con gravi anomalie dello sviluppo del cervello e del cervelletto. I cambiamenti mirati sono introdotti nella sequenza della regione codificante o degli elementi regolatori a monte del gene. Sistemi di espressione inducibile e condizionale per il gene bersaglio. Gene Dobbiamo conoscere la sequenza completa del DNA del gene di interesse. Si suddivide in cinque fasi principali: 1. costruzione del vettore di targeting; 2. gene targeting in cellule staminali embrionali (ES); 3. selezione delle cellule in cui il gene targeting ha avuto successo; 4. introduzione delle cellule ES modificate in embrioni di topo ed impianto di in una madre surrogata; 5.analisi ed incrocio dei topi chimerici. Topo knockout (neo: neomicina fosfotransferasi; tk: timidina kinasi di herpesvirus) Topi knockin: espressione di transgeni o modificazione del gene di interesse. Questo approccio è usato spesso per la mutagenesi sito-specifica in vivo. L’allele knockin sostituisce la regione codificante dell’allele endogeno mentre sono mantenuti gli elementi di regolazione endogeni. Topi knockdown: inattivazione o modificazione dei livelli di espressione di un gene, modificando gli elementi regolatori cisagenti. Si possono creare sostituzioni o delezioni di singole basi. La regione codificante del gene è intatta, quella endogena. I geni knockout possono determinare letalità embrionale necessità di mutazione condizionale del gene bersaglio. DNA ricombinasi sito-specifiche famiglia Int delle ricombinasi uno dei membri più noti è la ricombinasi Cre del batteriofago P1. Cre riconosce specificamente un sito di 34 bp nel genoma del P1, lox, e catalizza la ricombinazione reciproca tra coppie di siti lox. Knockout genetico condizionale La clonazione si divide in quattro passaggi: 1. preparazione delle cellule donatrici; 2. enucleazione delle uova non fecondate; 3. trasferimento nucleare mediante fusione cellulare; 4. impianto dell’embrione in una madre surrogata ed analisi dei cloni. Il trasferimento nucleare somatico è inefficiente Clonazione per ottenere cellule staminali Le terapie basate su cellule staminali permettono di trasformare il potenziale dei trapianti. Cellule staminali embrionali. Cellule staminali da tessuto adulto. Terapia cellulare eterologa e autologa. Riprogrammazione nucleare pluripotenza indotta in cellule somatiche.
Scaricare