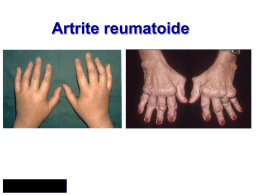
Rassegne Vol. 95, N. 9, Settembre 2004 Le artropatie infiammatorie nell’età senile Nicolò Pipitone, Costantino Pitzalis Riassunto. Le artriti dell’anziano rappresentano un gruppo eterogeneo di patologie, che comprendono sia forme tipiche dell’età senile (quale ad esempio la poliartrite subacuta edematosa benigna dell’anziano) sia affezioni rinvenibili anche in altre fascie d’età (ad esempio, l’artrite reumatoide e le artropatie sieronegative); queste ultime, peraltro, possono manifestarsi nell’anziano con caratteristiche peculiari, parzialmente distinte da quelle repertabili nell’adulto. Pertanto, una conoscenza puntuale di tali quadri morbosi e delle loro manifestazioni specifiche è indispensabile per poter porre una corretta diagnosi. Anche il trattamento del paziente anziano differisce da quello del paziente adulto per diversi aspetti importanti: in particolare, l’anziano presenta una maggiore suscettibilità agli effetti collaterali da farmaci, sia per una serie di alterazioni metaboliche, inclusa la ridotta funzionalità dell’emuntorio renale, sia per la politerapia cui è di frequente sottoposto. Stante il progressivo incremento relativo della popolazione anziana nel mondo occidentale, è auspicabile che i capisaldi di diagnostica e terapia delle artriti senili possano essere patrimonio di tutti i medici, al di là del gruppo ristretto degli specialisti reumatologi. Parole chiave. Anziano, artrite, polimialgia reumatica. Summary. Arthritides in the elderly. The arthritides of the elderly comprise a fairly heterogeneous group of diseases. They include conditions that affect exclusively or predominantly the elderly (such as, for instance, remitting seronegative symmetric synovitis with pitting edema) and conditions affecting any age group, but which can present with peculiar features in the elderly, like rheumatoid arthritis and the seronegative arthropathies. Therefore, in order to arrive at a correct diagnosis, a knowledge of the specific features of these disorders is required. In addition, the treatment of elderly patients differs from that of other age groups in that elderly subjects appear to have an increased susceptibility to adverse reactions. This susceptibility is related both to the different metabolism of aged subjects, including the impairment of the renal function, and to the multiple therapies that such subjects often receive. In view of the ever increasing elderly population in the western world, all physicians, over and beyond the limited circle of rheumatologists, should be knowlegeable about the principles of diagnosing and treating senile arthritis. Key words. Arthritis, elderly, polymyalgia rheumatica. Introduzione Gli anziani rappresentano una quota sempre più considerevole della popolazione globale: secondo recenti stime dell’Organizzazione Mondiale della Sanità, nel 2000 i soggetti di età pari o superiore a 60 anni raggiungevano la cifra di 600 milioni e le proiezioni sono di 1,2 miliardi per il 2025 1. Le patologie reumatiche dell’anziano costituiscono un capitolo vasto, che si può schematicamente suddividere in quattro gruppi principali. Il primo gruppo comprende le affezioni ad esordio quasi esclusivamente senile (patologie reumatiche dell’anziano in senso stretto), quali ad esempio la polimialgia reumatica e l’arterite temporale di Horton; il secondo gruppo è costituito da patologie che correlano con l’età, quali l’osteoporosi e l’osteoartrosi; il terzo gruppo include alcune patologie reumatiche che si manifestano nell’anziano con caratteristiche peculiari, parzialmente distinte da quelle repertabili nell’adulto, quali il lupus eritematoso sistemico (LES) e l’artrite reumatoide (AR) ad esordio tardivo, mentre nel quarto gruppo rientrano le forme morbose ad età di insorgenza variabile, protraentesi oltre l’età adulta (tabella 1). Weston Education Center, King’s College Hospital and Rheumatology Unit, Guy’s Campus, GKT School of Medicine, London. Pervenuto il 20 ottobre 2003. N. Pipitone, C. Pitzalis: Le artropatie infiammatorie nell’età senile Tabella 1. - Classificazione clinica delle affezioni reumatiche dell’anziano. 1. Patologie ad esordio quasi esclusivamente senile, ad esempio polimialgia reumatica ed arterite temporale di Horton 2. Patologie la cui incidenza aumenta con l’età, quali l’osteoporosi e l’osteoartrosi 3. Patologie che si manifestano nell’anziano con caratteristiche parzialmente distinte da quelle repertabili nell’adulto, quali il lupus eritematoso sistemico (LES) e l’artrite reumatoide (AR) ad esordio tardivo 4. Patologie ad età di insorgenza variabile protraentesi oltre l’età adulta (ad esempio, la spondilite anchilosante) Questa breve disamina riassuntiva delle patologie reumatiche dell’età senile rende ragione di alcune difficoltà che si incontrano nell’iter diagnostico nell’anziano: da un canto, infatti, è necessario tener presente patologie che non si osservano in altre fasce d’età e, dall’altro, patologie condivise anche dalla popolazione adulta si possono presentare con un quadro sensibilmente diverso da quello “classico”, meglio noto. La diagnostica differenziale riconosce inoltre un ulteriore motivo di difficoltà nella associazione, tutt’altro che infrequente, di patologie plurime nell’anziano, cosa che ovviamente contribuisce a rendere arduo il riconoscimento precoce di nuove condizioni morbose. Se a tutto ciò si aggiunge il fisiologico “declino” di svariate funzioni biologiche caratteristico dell’età senile, apparirà giustificato il considerare la popolazione anziana affetta da patologie reumatiche come una popolazione sui generis che, analogamente a quella pediatrica, necessita di un approccio diagnostico (nonché terapeutico) mirato. In questo articolo, pertanto, tratteremo innanzitutto del paziente geriatrico in quanto tale, evidenziandone in breve le alterazioni patofisiologiche più significative. Successivamente, tratteremo delle principali artropatie infiammatorie che si osservano nell’età senile, considerando sia quelle pressocché esclusive di quest’ultima, sia quelle che si manifestano con un quadro clinico peculiare nell’anziano, giacché sono proprio queste forme a porre i maggiori problemi di diagnosi differenziale. Il paziente anziano: alterazioni funzionali legate all’invecchiamento Come già accennato, un parziale declino di svariate funzioni biologiche è da considerare come fisiologico nell’anziano; dal punto di vista reumatologico, le alterazioni più importanti sono quelle che concernono la farmacocinetica, da un canto, e l’efficienza del sistema immune, dall’altro. Di norma, l’assorbimento dei farmaci è poco influenzato dall’invecchiamento, giacché esso avviene spesso per semplice diffusione passiva 2. Al contrario, la biodistribuzione dei farmaci risulta essere non di rado alterata, sia per riduzione dell’albumina plasmatica (con conseguente incre- 433 mento della frazione libera di alcuni farmaci, quali ad esempio i farmaci anti-infiammatori non-steroidei [FANS]), sia per aumento della quota di tessuto adiposo rispetto a quello muscolare. In particolare, la riduzione della componente idrica a favore di quella adiposa comporta un aumento del volume di distribuzione dei farmaci lipofilici e quindi una ridotta concentrazione plasmatica di quest’ultimi, mentre l’opposto vale per i farmaci idrofili come il paracetamolo 2. Alterazioni più importanti ai fini della farmacocinetica sono quelle in grado di interferire con l’eliminazione dei farmaci. A livello epatico, si osserva una riduzione dei fenomeni ossidativi, coniugativi e di glicuronazione, ma in genere tali alterazioni non si traducono in effetti clinici apprezzabili stante la notevole riserva funzionale del fegato 3. Al contrario, il declino della funzione renale, sotteso da diversi processi (soprattutto ridotto flusso ematico e rallentata filtrazione glomerulare, ma anche alterazioni della secrezione tubulare), ha non di rado implicazioni clinico-terapeutiche di rilievo per diverse ragioni 2. Innanzitutto, come è facilmente intuibile, la compromissione dell’emuntorio renale inficia parzialmente la capacità dell’organismo di eliminare i farmaci (ovvero i loro metaboliti) escreti prevalentemente per via renale, che pertanto andranno somministrati a dosaggi opportunamente ridotti in base ai valori della creatinina sierica o, meglio, della clearance della creatinina urinaria, onde evitare fenomeni di accumulo e di tossicità. In secondo luogo, alcuni farmaci possono compromettere ulteriormente una funzionalità renale già alterata, con effetti potenzialmente gravi (scompenso renale): ad esempio, i FANS possono comportare un’ipoafflusso ematico a livello renale tramite l’inibizione della sintesi di prostaglandine vasodilatatrici 4. In terzo luogo, alcuni farmaci (quali ad esempio gli uricosurici) non sono efficaci in pazienti con alterata funzionalità renale. In quarto luogo, va rammentato che il paziente geriatrico è quasi sempre pluritrattato, per cui sono possibili fenomeni di interazione farmacologica: ad esempio, i FANS possono interferire con i farmaci antiipertensivi e con i diuretici, antagonizzandone parzialmente l’efficacia, sebbene l’entità di tale interazione sia stata probabilmente sovrastimata in passato 5. Infine, va tenuto presente che negli anziani si ha una aumentata incidenza di effetti collaterali da farmaci: un esempio è la tossicità neurologica da FANS (in particolare indometacina) anche a dosi ridotte, quali cefalea, vertigini e sonnolenza 3. Analogamente ai meccanismi biochimici deputati alla metabolizzazione ed escrezione dei farmaci, anche il sistema neuroendocrino va incontro nell’anziano ad un processo di senescenza, le cui alterazioni principali sono a carico dell’asse ipotalamo-ipofisi-surrenalico e della funzionalità tiroidea. In particolare, si ha una ridotta increzione di alcuni ormoni, quali il deidroepiandrosterone (DHEA) e l’androstenedione (ASD) che avrebbero potenzialità antiflogistiche. 434 Recenti Progressi in Medicina, 95, 9, 2004 Ad esempio, è stato dimostrato che il DHEA è in grado di inibire la secrezione della citokina proinfiammatoria IL-6, la cui concentrazione sierica è più elevata negli anziani rispetto ai soggetti adulti anche in assenza di patologie flogistiche 6. Per quanto concerne il cortisolo endogeno, i dati della letteratura sono più conflittuali, ma sembra che in media i soggetti anziani, pur presentando una normale increzione basale, non siano in grado di montare una risposta ormonale cortisolemica adeguata a seguito di stimoli infiammatori . Pertanto, è verosimile che tale lieve insufficienza surrenalica subclinica possa spiegare non solo la maggiore suscettibilità di questi pazienti a stimoli flogogeni (quali le infezioni), ma anche la più lenta risoluzione dei processi infiammatori. Analogamente, un deficit relativo della funzionalità tiroidea non è infrequente nell’età senile, e la prevalenza dell’ipotiroidismo aumenta con l’avanzare dell’età 8-10. L’ipotiroidismo può, a sua volta, determinare quadri clinici di algie e rigidità muscolare che possono mimare patologie infiammatorie quali la polimialgia reumatica, mentre è discusso se l’incidenza di manifestazioni articolari flogistiche sia aumentata nei pazienti ipotiroidei 11. Oltre al sistema endocrino, anche il sistema immunocompetente presenta nell’età senile fenomeni involutivi, caratterizzati dalla progressiva involuzione del timo 12 e dalla conseguente riduzione della concentrazione degli ormoni timici circolanti 13, insieme a svariate alterazioni funzionali e della conta cellulare 14. In particolare, i soggetti anziani presentano un deficit funzionale della branca cellulare del sistema immunocompetente, specialmente delle T-cellule, con ridotta capacità di generare cellule naive e con decremento della ratio CD4/CD8; si reputa che tale deficit sia responsabile, almeno in parte, della aumentata suscettibilità alle infezioni 15 e alle neoplasie, tipica 12 degli anziani. Una riduzione della funzionalità si osserva anche a carico delle cellule NK (anch’esse coinvolte nelle risposte antitumorali) ma, a differenza dei T linfociti, il numero globale delle cellule NK non appare ridotto, e può anzi andare incontro ad un incremento 16. Infine, sono state osservate diverse anomalie funzionali delle cellule dello stipite fagocitico, concernenti sia la chemiotassi e la fagocitosi che i processi di attivazione linfocitaria; nel complesso, tali alterazioni comporterebbero una significativa riduzione della capacità dell’organismo di combattere le infezioni 17,18. Per quanto concerne invece la branca umorale del sistema immune, i linfociti B presentano una attivazione policlonale con produzione di numerosi autoanticorpi, generalmente a basso titolo 19. Tuttavia, tali autoanticorpi non esplicano, per lo più, un ruolo patogenetico; ne è riprova il fatto che sebbene la prevalenza del fattore reumatoide (FR) aumenti progressivamente con l’età, tale incremento non si accompagna ad una aumentata suscettibilità a sviluppare l’artrite reumatoide 20. Pertanto, la presenza di autoanticorpi sierici (FR, anticorpi antinucleo [ANA], etc.) nel soggetto anziano non deve indurre di per sé a porre corrivamente diagnosi di artrite reumatoide o connettivite in assenza di un quadro clinico che giustifichi tali diagnosi. Analogamente, il riscontro di una velocità di eritrosedimentazione (VES) elevata nell’anziano non è spesso, di per sé, indicativa di una patologia flogistica sottostante, in quanto i valori della VES correlano, grosso modo, con l’età: nei casi dubbi, è utile il dosaggio della proteina C-reattiva, che è un indice di flogosi più specifico della VES. In conclusione, emerge che più fattori concorrerebbero a inficiare la resistenza dell’organismo alle infezioni: da un canto una ridotta capacità del sistema immune a montare una risposta adeguata, e dall’altro quella del sistema neuroendocrino a circoscrivere e limitare la conseguente risposta infiammatoria. Queste alterazioni potrebbero, nel complesso, contribuire a spiegare almeno in parte la patogenesi di alcune reumopatie dell’anziano quali la polimialgia reumatica, per la quale si ipotizza appunto che un movente infettivo, non debellato adeguatamente dal sistema immune, determini una risposta flogistica; quest’ultima, a sua volta, tenderebbe a protrarsi nel tempo per il deficit degli ormoni corticosurrenalici, normalmente deputati a limitare la flogosi dopo la risposta iniziale allo stimolo offensivo. Nel seguito, si descriveranno le caratteristiche cliniche e laboratoristiche delle principali artropatie infiammatorie dell’anziano, con l’intento di agevolarne la diagnosi e consentirne la differenziazione da altre forme che possano mimarne le manifestazioni. Patologie con espressività artritica nell’anziano ARTROPATIE INFIAMMATORIE RINVENIBILI IN DIVERSE FASCIE D’ETÀ: MANIFESTAZIONI CLINICHE NELL’ANZIANO Per definizione, l’artrite reumatoide dell’anziano (“EORA”, elderly-onset rheumatoid arthritis) è un’artrite ad insorgenza in soggetti di età superiore ai 60 anni che soddisfa i criteri classificativi dell’artrite reumatoide (AR) elaborati dall’ American Rheumatism Association/American College of Rheumatology 21,22. Inizialmente l’EORA venne considerata sovrapponibile all’AR dell’adulto per tipo e gravità di manifestazioni cliniche 23, ma successivamente vennero evidenziate una serie di caratteristiche differenziali che portarono ad inquadrare l’EORA come una entità patologica a se stante 24-27. In effetti, l’EORA presenta diverse peculiarità rispetto all’AR dell’adulto: la ratio uomo/donna è più equilibrata (secondo un recente studio italiano sarebbe pari a 1.6:1 rispetto a quella di 4.4:1 dell’AR classica 27), l’esordio acuto di malattia e l’interessamento del cingolo scapolare (quadro “similpolimialgico”) sono più frequenti, mentre l’impegno delle piccole articolazioni di mani e piedi è di riscontro più raro, pur restando relativamente comune 24. N. Pipitone, C. Pitzalis: Le artropatie infiammatorie nell’età senile I pazienti con EORA manifestano più spesso degli adulti sintomi sistemici quali febbre, calo ponderale e astenia, mentre risultano meno frequentemente sieropositivi per il fattore reumatoide, presentano in media una minore compromissione funzionale e sviluppano più di rado noduli reumatoidi sottocutanei ed erosioni articolari 28. La scarsa erosività non è semplicemente riconducibile, come si potrebbe ipotizzare, ad una ridotta durata di malattia nei pazienti con EORA e quindi all’osservazione della patologia articolare in uno stadio precoce pre-erosivo, giacché, a parità di durata di malattia, l’EORA risulta comunque meno erosiva dell’AR classica 25. Diverse ipotesi sono state avanzate per spiegare la minore erosività e la prognosi più favorevole in termini di funzionalità articolare dell’EORA. È possibile che il decorso più benigno dell’EORA sia riconducibile all’inclusione di un numero di pazienti con manifestazioni cliniche simil-polimialgiche, giacché in questo sottogruppo (analogamente a quanto si osserva nella PMR classica) l’artrite ha assai di rado un’evoluzione destruente 24. Tuttavia, ciò risponde solo parzialmente a verità, giacché è stato dimostrato che l’artrite dell’EORA resta comunque meno erosiva di quella dell’AR classica, anche se si escludono dalla valutazione i pazienti con quadro clinico similpolimialgico 24. Una seconda ipotesi si basa sul dato epidemiologico che nella AR dell’adulto, almeno nelle popolazioni caucasiche di origine nordeuropea, la presenza del fattore di istocompatibilità HLA-DR4 e la sieropositività per il fattore reumatoide si associano ad una prognosi più grave 29,30. Entrambi questi fattori di rischio, fra loro correlati 31, sono rappresentati nell’EORA meno frequentemente rispetto all’AR classica, e ciò potrebbe contribuire a rendere ragione della prognosi migliore della prima 21,32,33. Va però rilevato che anche nella popolazione italiana (nella quale l’associazione tra fattore di istocompatibilità HLA-DR4 e gravità di prognosi nella AR è più labile che nelle popolazioni nord-europee) 34, l’EORA risulta meno invalidante dell’AR, per cui si deve ammettere che anche altri fattori possano concorrere a determinare la gravità di malattia 35. Una terza ipotesi si basa sull’assunto (già menzionato in precedenza) che i processi di immunoed endocrinosenescenza, con la conseguente aumentata suscettibilità a diversi stimoli flogogeni, tra cui le infezioni, possano avere un ruolo patogenetico nel determinismo di alcune reumopatie flogistiche dell’età senile 36. Nella AR, in genere si ipotizza che più fattori, quali traumi o svariati agenti infettivi, siano in grado di indurre un danno dei tessuti articolari; ciò, a sua volta, comporterebbe lo “smascheramento” di antigeni artritogenici ed il successivo innesco di una risposta immunoflogistica locale 37. I glucocorticoidi endogeni ed il DHEA sono normalmente deputati, fra le altre funzioni, al contenimento della risposta immunoflogistica nell’organismo. Pertanto, un deficit relativo di tali ormoni, come si riscontra nell’età senile, potrebbe esitare nello sviluppo e perpetua- 435 zione di una reazione infiammatoria articolare a seguito di stimoli flogogeni anche lievi 38,39 e, di converso, la malattia risulterebbe sovente più agevolmente controllabile con il semplice trattamento corticosteroideo a dosaggi bassi 40. Infine, in maniera del tutto simile all’AR, anche nell’EORA gli estrogeni potrebbero svolgere un ruolo “favorente” nell’induzione della patologia, poiché la prevalenza dell’EORA risulta più elevata in soggetti che fanno uso, o hanno fatto uso in passato, di terapia sostitutiva estroprogestinica 41. Le ipotesi citate non sono mutualmente esclusive ed anzi è verosimile che i momenti patogenetici discussi possano giocare tutti un ruolo, variabile a seconda dei diversi soggetti, nella patogenesi della malattia. Sulla scorta di tali elementi, è possibile ipotizzare che l’EORA rappresenti, più che una patologia ben definita, una sindrome accorpante diversi subset, incluso un quadro similpolimialgico, un quadro polisinovitico poco o punto erosivo, ed una forma poliarticolare destruente. Solo quest’ultima forma sarebbe sovrapponibile all’AR dell’adulto stricto sensu; gli altri quadri clinici sarebbero espressione di una reazione sinovitica a stimoli flogistici, non sufficientemente controllata per una insufficiente risposta corticosurrenalica. Le brevi considerazioni di ordine patogenetico su riassunte spiegano, almeno in parte, come l’EORA sia caratterizzata da un decorso clinico più benigno dell’AR classica. Al tempo stesso, però, stante la ridotta “riserva funzionale” del soggetto anziano, l’esito della patologia può essere ugualmente invalidante se non si interviene tempestivamente con misure terapeutiche farmacologiche e riabilitative 25. I farmaci antiinfiammatori non-steroidei (FANS) sono utili per il controllo sintomatologico, ma vanno utilizzati con cautela per i ben noti rischi di gastrolesività e possibile compromissione della funzionalità renale. Tra i FANS andrebbero privilegiati quelli con ridotto potenziale gastrolesivo, quali il nabumetone o l’etodolac (eventualmente in associazione con un inibitore della pompa protonica); in alternativa, sono stati proposti l’associazione misoprostol-diclofenac o i nuovi inibitori selettivi dell’enzima COX-2, quali il celecoxib e rofecoxib. Va tuttavia rammentato che l’anziano è particolarmente predisposto agli effetti nefrotossici dei FANS e che non è stata dimostrata una migliore maneggevolezza in tal riguardo per gli inibitori selettivi della COX-2: pertanto, la loro somministrazione andrà effettuata con la stessa cautela che si impone con i FANS di più vecchia data 42. I cortisonici a basse dosi (in genere 5-7,5 mg/die, in un’unica somministrazione mattutina) sono particolarmente indicati per la loro efficacia nell’EORA, da soli od in associazione ai FANS, ma il loro uso prolungato, a dosaggi superiori ai 6 mg al dì di prednisolone-equivalente, impone l’instaurazione di un trattamento concomitante anti-osteopenizzante con derivati della vitamina D ovvero con bifosfonati. 436 Recenti Progressi in Medicina, 95, 9, 2004 Un indubbio vantaggio dei cortisonici a basse dosi rispetto ai FANS è rappresentato comunque dagli scarsi effetti gastrolesivi e nefrotossici, nonché dalla possibilità di somministrazione anche prolungata senza che sia necessario effettuare controlli ematici periodici. L’idrossiclorochina è generalmente ben tollerata, anche se di limitata efficacia, per cui andrebbe riservata alle forme di artrite di medio impegno non sufficientemente controllate dai FANS e/o dagli steroidi a basso dosaggio. Come nei pazienti adulti, è necessario eseguire controlli annuali dell’acuità visiva e ricercare accuratamente sintomi indicativi di patologia oftalmica; in presenza di anomalie soggettive od oggettive, si imporrà un esame del fundus oculare per evidenziare eventuali segni di tossicità a carico della retina. Le forme più aggressive di artrite possono giovarsi dell’impiego del metotrexato a basse dosi (57,5 mg a settimana, preferibilmente per via intramuscolare, associato ad acido folico, 5 mg per os da assumere a qualche giorno di distanza dopo l’iniezione di metotrexato) ovvero dei sali d’oro iniettabili, o ancora della salazopirina. Tutti i suddetti farmaci si sono dimostrati efficaci nell’EORA e non presentano, in genere, una maggiore incidenza di effetti collaterali nel paziente anziano rispetto all’adulto, purché i soggetti geriatrici non soffrano di epatopatia, nefropatia o altra grave patologia sistemica concomitante 43,44. Per esempio, è stato dimostrato che il rischio di sviluppare effetti collaterali da metotrexato nei pazienti anziani con funzionalità renale preservata è virtualmente sovrapponibile a quello dell’adulto sano, laddove il rischio è significativamente più elevato nei soggetti anziani con deficit della funzionalità renale; perciò, in presenza di valori elevati di creatinina, il dosaggio del metotrexato andrà opportunamente corretto 45,46. Oltre alla “fisiologica” riduzione della funzionalità renale ed epatica, i pazienti anziani sono spesso affetti da patologie multiple e quindi politrattati: ciò impone un oculato monitoraggio del paziente (aumentato rischio di effetti collaterali da farmaci) e una particolare cura nell’evitare interazioni farmacologiche potenzialmente rischiose. I trattamenti fisioterapico-riabilitativi (esercizi di mobilizzazione attiva e passiva per evitare contratture articolari; splint per prevenzione e correzione di deformità) rappresentano un sussidio collaterale fondamentale, più che un’alternativa, al trattamento farmacologico e andrebbero instaurati precocemente 47,48. La terapia chirurgica (protesi articolari, artrodesi, interventi di ricostruzione tendinea e di correzione di deformità), contrariamente a quanto ritenuto in passato, non è controindicata nell’anziano e può risultare determinante in alcuni casi nel garantire una adeguata funzionalità e una buona qualità di vita 49. La diagnosi differenziale dell’EORA dovrà contemplare la polimialgia reumatica (v. infra) e le altre forme di patologie infiammatorie articolari ad insorgenza senile, quali la RS3PE (v. infra), le artriti sieronegative dell’anziano (o entesoartriti del- l’anziano), le artriti microcristalline (gotta, pseudogotta, artrite da cristalli di idrossiapatite) e le artriti paraneoplastiche. Le spondiloartriti sieronegative (SSN) dell’anziano (o “entesoartriti” secondo la nuova classificazione della Società Italiana di Reumatologia) comprendono l’artrite psoriasica, le artriti reattive, la spondilite anchilosante e le forme indifferenziate. Tutte queste forme (in particolare le artriti reattive e la spondilite anchilosante) sono di rara insorgenza nell’anziano, anche se sono stati descritti diversi casi di SSN ad esordio senile con caratteristiche cliniche peculiari. Analogamente a quanto si osserva nell’EORA, le SSN dell’anziano si associano più di frequente a sintomi sistemici (febbre, astenia, calo ponderale), nonché spesso, anche se non invariabilmente, a valori della VES particolarmente elevati; inoltre, l’impegno articolare periferico risulta in genere più spiccato che nell’adulto con interessamento frequente delle caviglia, ginocchia e polsi 50. Un ulteriore dato differenziale rispetto alle SSN dell’adulto è rappresentato dalla presenza di edemi acrali che, talora, configurano il quadro diagnostico di una RS3PE vera e propria (v. oltre) 50. La diagnosi differenziale rispetto all’EORA si baserà sul diverso “pattern” di interessamento articolare, sulla presenza di periostite all’esame radiologico o scintigrafico, sulla coesistenza di entesopatie multiple (dimostrabili clinicamente o mediante ecografia) ed eventualmente delle manifestazioni extra-articolari associate alle SSN, quali l’irite o la psoriasi cutanea. In rari casi, una neoplasia occulta o clinicamente manifesta (specialmente il carcinoma broncogeno nell’uomo e quello mammario nella donna) possono essere causa di una poliartrite. Queste forme paraneoplastiche esordiscono in genere acutamente, tendono a risparmiare le piccole articolazioni ma, a differenza dell’EORA, sono sovente monoarticolari (con predilezione del ginocchio) ed asimmetriche, anche se sono state descritte forme poliarticolari simmetriche 51,53. Gli indici di flogosi sono elevati e il fattore reumatoide è di regola negativo (anche se il 10% degli anziani presenta una positività aspecifica per il fattore reumatoide), mentre l’esame del liquido sinoviale rivela una modica presenza di cellule della flogosi; l’esame radiografico è negativo. In genere, non è necessario eseguire uno screening indiscriminato nel paziente anziano con una poliartrite, tuttavia è buona norma restare vigilanti ed avviare indagini più approfondite in presenza di sintomi e segni sistemici (febbre, anoressia, perdita di peso, diaforesi notturna atipica) ovvero localizzati ad un apparato (tosse persistente, dolore toracico, alterazioni della motilità intestinale, etc.). Anche nel caso delle artriti microcristalline, in genere, il dépistage rispetto all’EORA non pone particolari difficoltà, giacché le prime sono in genere caratterizzate da episodi monoartritici recidivanti piuttosto che da una polisinovite; in particolare, nel caso della gotta, l’artrite tende ad interessare preferenzialmente la prima articolazione metatarsofalangea, la caviglia ed il ginocchio, mentre nella pseudogotta si localizza per lo più al ginocchio ed ai polsi 54,55. N. Pipitone, C. Pitzalis: Le artropatie infiammatorie nell’età senile L’artrite da cristalli di idrossiapatite predilige invece le scapolo-omerali e, talora, le anche; l’evoluzione clinica è relativamente indolente dal punto di vista sintomatologico nelle fasi iniziali, ma non sono rare lesioni radiologiche destruenti 56-57. Va tuttavia tenuto presente che la pseudogotta può anche manifestarsi in forma poliarticolare simmetrica (cosiddetta forma “similreumatoide”), mentre in soggetti anziani, specialmente sotto trattamento con diuretici, la gotta può esordire come, od evolvere in, una poliartrite interessante tipicamente le articolazioni già affette da processi artrosici, quali le articolazioni interfalangee distali e prossimali. La diagnosi differenziale si avvarrà, nei casi dubbi, del supporto iconografico (tipiche calcificazioni meniscali e del ligamento triangolare del carpo e, talora, calcificazioni lineari della cartilagine ialina nella pseudogotta; quadro nei limiti della norma in caso di gotta acuta, ovvero lesioni abarticolari “ad alabarda” e tofi nella gotta tofacea), degli esami di laboratorio (elevati valori di acido urico nella gotta, anche se l’acido urico può essere nella norma in corso di attacchi acuti) e soprattutto, ove possibile, dell’esame del liquido sinoviale a mezzo della microscopia ottica a luce polarizzata, che evidenzierà i tipici cristalli di acido urico o, rispettivamente, di pirofosfato. POLIMIALGIA REUMATICA La polimialgia reumatica (PMR) è una patologia paradigmatica dell’età senile, manifestandosi pressocché esclusivamente dopo i 50 anni e, sovente, in età più avanzata. L’esordio è spesso acuto ed i pazienti sono talora in grado di rammentare il giorno esatto di insorgenza dei sintomi, rappresentati da algie di tipo infiammatorio del cingolo scapolare e/o pelvico, associati talora ad una modesta componente sinovitica periferica 58. La rigidità mattutina è di regola superiore ai 30 minuti; si possono associare sintomi sistemici, quali spossatezza, febbre e malessere generale . In circa il 10% dei soggetti, la PMR è complicata dall’arterite temporale di Horton, caratterizzata istologicamente da flogosi delle arterie temporali e, clinicamente, da cefalea temporale e ipersensibilità dello scalpo alla pressione; può concomitare interessamento delle arterie oftalmiche, con disturbi visivi varianti da riduzione dell’acuità ad amaurosi irreversibile 59-61. Gli indici di flogosi (VES, proteina C-reattiva) sono elevati nella grande maggioranza (≥90%) dei pazienti polimialgici; l’esame emocromocitometrico può evidenziare una neutrofilia ed una anemia normocromica. In circa un quarto dei casi, i test di funzionalità epatica (in particolare la fosfatasi alcalina e le γ-GT) sono alterati e sono state descritte aneddoticamente anomalie della funzionalità tiroidea 58. L’esame delle sottopopolazioni linfocitarie dimostra frequentemente una riduzione della conta delle cellule CD8+ circolanti, ma tale dato non è in realtà caratterizzante la PMR, giacché una ridotta conta 437 dei linfociti CD8+ è stata osservata anche nell’EORA e nella AR dell’adulto 62. Dal punto di vista anatomo-patologico, studi artroscopici hanno evidenziato una sinovite delle articolazioni gleno-omerali nella maggior parte (83%) dei pazienti con PMR 63, mentre studi di imaging (ecografia e RMN) hanno dimostrato che pressocché tutti i pazienti con PMR presentano un interessamento flogistico delle borse sottoacromio-deltoidea e deltoidea 64. L’interessamento preferenziale della PMR per le borse sierose potrebbe, fra l’altro, spiegare la predilezione di questa patologia per il cingolo scapolare e pelvico 45,65, contraddistinti per l’appunto da una ricca presenza di borse di clivaggio. In genere, la PMR tende a “spegnersi” in un arco di tempo di circa due anni, ma il decorso può essere talora più protratto. La terapia si avvale fondamentalmente dell’impiego dei farmaci corticosteroidei a dosi medio-basse, con una dose iniziale di 15-20 mg/die di prednisone-equivalente a scalare. Il metotrexato, ad una dose media di 7,515 mg/settimana, ovvero l’azatioprina (100-150 mg/die) sono stati proposti per ottenere un risparmio dei cortisonici nelle forme persistenti, in quelle ribelli ai cortisonici alle dosi suindicate, ovvero in tutti i pazienti in cui l’uso dei corticosteroidi è problematico (p. es. nei soggetti diabetici). La diagnosi differenziale delle algie interessanti il cingolo scapolare è potenzialmente vasta 66 (tabella 2) e va posta in particolare nei confronti dell’EORA ad esordio similpolimialgico; a favore della diagnosi di PMR depongono un impegno limitato delle articolazioni periferiche (transeunte e nonerosivo) e la drammatica risposta ai cortisonici a dosi medio-basse 67. Tuttavia, sono stati descritti casi ad esordio tipicamente polimialgico che sono poi evoluti in franca EORA 68 e, di rado, casi di neoplasie esordite con quadro polimialgico, ragion per cui è essenziale seguire accuratamente i pazienti nel tempo. La capsulite adesiva delle scapolo-omerali può mimare la PMR, in quanto inizialmente tale forma si presenta con dolore infiammatorio e solo successivamente si ha la tipica limitazione della motilità articolare; tuttavia, la capsulite adesiva è in genere unilaterale e comunque non si associa ad elevati indici di flogosi. Tabella 2. - Patologie che possono determinare algie del cingolo scapolare nell’anziano. • • • • • • • • • Polimialgia reumatica Artrite reumatoide ad insorgenza senile Capsulite adesiva bilaterale Sindrome della cuffia dei rotatori bilaterale Ipotiroidismo Fibromialgia Cervicobrachialgie Morbo di Parkinson Polimiosite 438 Recenti Progressi in Medicina, 95, 9, 2004 Meno frequentemente, una sindrome bilaterale della cuffia dei rotatori può mimare clinicamente la PMR, ma nel primo caso l’esordio in genere è monolaterale (anche se può divenire bilaterale nel corso del tempo), i sintomi sono, almeno all’inizio, prevalentemente meccanici (il dolore insorge con i movimenti della spalla, specialmente abduzione e rotazione, e si attenua con il riposo) e gli indici di flogosi sono nella norma, a meno che non siano elevati per altre cause. L’ipotiroidismo si associa non di rado a mialgie prossimali diffuse e può presentarsi con dolori alle spalle ed altri gruppi muscolari associati a rigidità muscolare 69. La diagnosi, tuttavia, non è in genere difficile perché le algie da ipotiroidismo sono generalmente diurne e aggravate dall’esercizio fisico, laddove il dolore in corso di PMR è di tipo infiammatorio; la conferma diagnostica è agevolmente ottenibile con i test della funzionalità tiroidea. Anche il dolore fibromialgico è per lo più agevolmente differenziabile da quello della PMR, in quanto è tipicamente aggravato dallo stress e dal freddo; inoltre, l’esame obiettivo evidenzierà in caso di fibromialgia i tipici “tender point”, mentre gli indici di infiammazione non sono alterati nella fibromialgia primaria. Un’altra patologia di frequente riscontro nel paziente geriatrico, la cervicalgia (in particolare la cervicalgia con impegno C4-C5), può talora comportare algie irradiate alle spalle, sovente riproducibili con le opportune manovre semeiologiche del rachide cervicale. Più di rado, un morbo di Parkinson precoce misconosciuto può essere diagnosticato erroneamente come PMR sulla base della spiccata rigidità muscolare, quando il cingolo scapolare e/o pelvico siano particolarmente interessati. Infine, la polimiosite può mimare la PMR quando sia presente una componente di spiccata dolenzia muscolare, ma le algie muscolari in questo caso saranno indotte dall’esercizio fisico e non si reperterà una significativa rigidità mattutina articolare; inoltre, la polimiosite comporta un elevato grado di astenia muscolare, laddove nella PMR tale manifestazione è di lieve entità e rappresenta semplicemente una reazione antalgica dell’organismo. Gli indici di flogosi possono essere elevati in entrambi le patologie, ma in genere i valori della VES e PCR sono significativamente più alti nella PMR, mentre valore discriminante avranno gli enzimi muscolari (in particolare la creatina fosfokinasi), che risulteranno nella norma nella PMR e aumentati in corso di miosite. Una ulteriore conferma della diagnosi di polimiosite è ottenibile a mezzo di studi elettromiografici, risonanza magnetica dei muscoli affetti ed, eventualmente, biopsia muscolare. L’etiologia della PMR resta ignota, anche se la subitaneità dell’esordio, la ciclicità stagionale con più elevata incidenza della patologia nel periodo compreso tra gennaio e maggio 70 e la documentazione, sia pure aneddotica, dell’insorgenza simultanea in soggetti conviventi 71,72 farebbero ipotizzare un primum movens virale 73, che agirebbe scate- nando una risposta immunoflogistica in soggetti predisposti. In tal senso, un possibile candidato eziologico potrebbe essere rappresentato dal virus parainfluenzale, giacché i pazienti con PMR presentano più frequentemente dei controlli sani anticorpi sierici diretti contro tale virus 70. Inoltre, analogamente a quanto proposto per l’EORA, eventuali fattori predisponenti potrebbero essere un deficit relativo della produzione del cortisolo endogeno e del DHEA deputati, fra le altre funzioni, a limitare la risposta flogistica e, di converso, una sintesi eccessiva di citokine pro-infiammatorie, quali l’interleukina-6. In tal senso, di recente è stato dimostrato che i livelli sierici di IL-6 sono particolarmente elevati nei pazienti con PMR 74,75; il trattamento cortisonico si dimostra efficace nel ridurre i livelli di IL-6 circolante. Poiché l’IL-6 è una delle principali citokine responsabili dell’induzione della sintesi a livello epatico delle proteine della fase acuta (VES, PCR, aptoglobina, alfa-1-antitripsina, ceruloplasmina e ferritina), ciò spiegherebbe gli elevati valori di VES e PCR che, come già accennato, caratterizzano tipicamente la PMR. POLIARTRITE SUBACUTA EDEMATOSA BENIGNA DELL’ANZIANO Dalle forme artritiche dell’anziano è stata di recente enucleata una forma di sinovite definita «remitting seronegative symmetric synovitis with pitting edema» (RS3PE) nella letteratura nordamericana 76 e ribattezzata “poliartrite subacuta edematosa benigna dell’anziano” dagli autori francesi 77. Come le designazioni succitate suggeriscono, si tratta di una polisinovite simmetrica, nonerosiva, tipica del soggetto anziano, associata ad edema acrale improntabile 76. La prevalenza del sesso maschile è cospicua e varia a seconda delle casistiche dal 70% allo 80% circa; i soggetti affetti sono in grande maggioranza di discendenza caucasica. Anche fattori genetici sono stati implicati nella patogenesi della patologia, come dimostrato dalla prevalenza, significativamente più elevata rispetto ai controlli sani, della molecola B7 del complesso maggiore di istocompatibilità 76,78. L’insorgenza della RS3PE è spesso improvvisa, ed il quadro clinico è rapidamente dominato dall’edema periferico, quasi sempre bilaterale e simmetrico, risalente fino ai polsi ed alle caviglie 78. La sinovite, anch’essa periferica, predilige le piccole articolazioni di mani e piedi, ma anche le caviglie ed i polsi; in genere è clinicamente poco appariscente, anche perché mascherata dalla componente edematosa. In una significativa percentuale di casi, si osserva l’interessamento delle scapolo-omerali (6/13), mentre il rachide è tipicamente risparmiato. I sintomi sistemici, quali febbre e calo ponderale, sono di rado eclatanti, anche se un modico rialzo termico (intorno a 38º) è riscontrabile in un numero significativo di pazienti. La radiologia tradizionale è in genere muta, ed in particolare non si repertano pinzamento articolare od erosioni, a riprova della benignità di tale artrite 76. N. Pipitone, C. Pitzalis: Le artropatie infiammatorie nell’età senile Viceversa, l’esame iconografico condotto con tecniche di risonanza magnetica nucleare (RMN) dimostra una notevole compromissione flogistico-edematosa dei tendini delle dita, il cui correlato clinico è rappresentato appunto dall’edema improntabile, anche se nella pratica clinica la RMN non è indicata non solo per i costi elevati, ma anche perché il quadro clinico in genere è di per sé diagnostico 79. Un edema acrale si può talora riscontrare anche nei pazienti con AR e, meno frequentemente, con PsA, ma in questi casi l’edema è secondario ad un drenaggio linfatico compromesso, come dimostrabile con tecniche linfoscintigrafiche, anziché ad edema tendineo; inoltre, l’edema acrale associato ad AR e PsA non è responsivo al trattamento cortisonico. L’evoluzione della RS3PE è quasi sempre benigna: le manifestazioni cliniche rispondono al trattamento con FANS o con corticosteroidi a basse dosi 80, e sono documentati anche casi di remissione spontanea. In genere, l’edema scompare entro circa un mese dall’esordio, mentre le manifestazioni articolari si spengono entro 6-12 mesi; tuttavia, le contratture in flessione delle dita e dei polsi possono talora persistere indefinitamente. Le recidive sono molto rare. Stante la benignità della RS3PE, non è indicato un trattamento con farmaci di fondo e la terapia medica è sintomatica; in genere, il trattamento di scelta è rappresentato dai corticosteroidi a basse dosi fino a completa risoluzione della patologia. Il quadro clinico su descritto rappresenta quello di più frequente riscontro nella pratica clinica; sono però descritti rari casi di RS3PE secondari ad altre patologie, quali l’amiloidosi AL, la sarcoidosi acuta e tutta una congerie di neoplasie emolinfoproliferative e solide, tra cui il carcinoma ovarico 47,81-84. Tali forme secondarie sono in genere contraddistinte clinicamente dalla presenza di manifestazioni cliniche riconducibili alla patologia sottostante, da una maggiore compromissione dello stato generale (nel caso delle forme paraneoplastiche) e da una scarsa risposta al trattamento corticosteroideo; viceversa, l’eradicazione della patologia scatenante determina una risoluzione della RS3PE 85. In altri casi, invece, si possono repertare le caratteristiche tipiche della RS3PE in pazienti affetti da altre reumopatie flogistiche, come la PMR, l’EORA, le spondiloatriti sieronegative inclusa l’artrite psoriasica, le connettiviti e alcune vasculiti 83,86-90. Pertanto, attualmente la RS3PE viene considerata una sindrome piuttosto che una patologia a sé stante 81; in particolare, sono state descritte forme “overlap” tra PMR e RS3PE che non differivano sostanzialmente per caratteristiche demografiche ed immunologiche. Ciò farebbe ipotizzare che anche la RS3PE possa riconoscere moventi etiopatogenetici simili a quelli descritti a proposito della PMR, quantunque gli studi in merito siano tuttora scarsi per la relativa rarità della malattia. Conclusioni Le artriti dell’anziano su descritte rappresentano un gruppo di patologie che, pur essendo distinguibili clinicamente, presentano una serie di carat- 439 teristiche comuni dal punto di vista etiopatogenetico e terapeutico. In particolare, la buona risposta al trattamento corticosteroideo a basse dosi farebbe ipotizzare un deficit relativo dei glucocorticoidi e/o di altri ormoni corticosurrenalici anti-infiammatori come cofattore patogenetico. Clinicamente, vi sono importanti embricamenti fra le diverse forme, embricamenti che rendono talora difficoltoso il processo di diagnostica differenziale. Il riconoscimento precoce di tali patologie, un accurato dépistage che consenta l’esclusione di forme morbose con caratteristiche cliniche simili, e – ove richiesto – l’individuazione di eventuali forme secondarie (in particolare paraneoplastiche) sono momenti fondamentali nella diagnosi e quindi nell’impostazione di un trattamento appropriato, che dovrà tener conto della funzionalità epato-renale dell’anziano, non di rado ridotta o compromessa, nonché delle possibili interazioni farmacologiche che si possono determinare in soggetti quasi sempre politrattati. Bibliografia 1. WHO. http://www.who.int/hpr/ageing/index.htm. 2001. 2. Morgan J, Furst DE. Implications of drug therapy in the elderly. Clin Rheum Dis 1986; 12: 227-44. 3. Sack, K. E. L’uso dei FANS in età avanzata. Geriatrics 1990; 7: 56-66. 4. Menkes, C. J. Renal and hepatic effects of NSAIDs in the elderly. Scandinavian Journal of Rheumatology 1989; suppl. 83: 11-13. 5. Schaeverbeke T, Vernhes JP, Bannwarth B, Dehais J. Is remitting seronegative symmetrical synovitis with pitting oedema (RS3PE syndrome) associated with HLA-A2? [letter]. British Journal of Rheumatology 1995; 34: 889-90. 6. Straub RH, Konecna L, Hrach S, Rothe G, Kreutz M, Scholmerich J, Falk W, Lang B. Serum dehydroepiandrosterone (DHEA) and DHEA sulfate are negatively correlated with serum interleukin-6 (IL6), and DHEA inhibits IL-6 secretion from mononuclear cells in man in vitro: possible link between endocrinosenescence and immunosenescence. J Clin Endocrinol Metab 1998; 83: 2012-17. 7. Kamilaris TC, DeBold CR, Pavlou SN, Island DP, Hoursanidis A, Orth DN. Effect of altered thyroid hormone levels on hypothalamic-pituitary-adrenal function. J Clin Endocrinol Metab 1997; 65: 994-9. 8. Espinoza LR, Jara LJ, Silveira LH, Martinez-Osuna P, Zwolinska JB, Kneer, C, Aguilar JL. Anticardiolipin antibodies in polymyalgia rheumatica-giant cell arteritis: association with severe vascular complications. American Journal of Medicine 1991; 90: 474-8. 9. Chiovato L, Mariotti S, Pinchera A. Thyroid diseases in the elderly. Baillières Clinical Endocrinology & Metabolism 1997; 11: 251-70. 10. Bagchi N, Brown TR, Parish RF. Thyroid dysfunction in adults over age 55 years. A study in an urban US community. Archives of Internal Medicine 1990; 150: 785-7. 11. Bland JH, Frymoyer JW. Rheumatic syndromes of myxedema. New England Journal of Medicine 1970; 282: 1171-4. 12. Hobbs MV, Ernst DN. T cell differentiation and cytokine expression in late life. Dev Comp Immunol 1997; 21: 461-70. 440 Recenti Progressi in Medicina, 95, 9, 2004 13. Fabris N, Mocchegiani E, Amadio L, Zannotti M, Licastro F, Franceschi C. Thymic hormone deficiency in normal ageing and Down’s syndrome: is there a primary failure of the thymus? Lancet 1984; i: 983-6. 14. Pozzilli P, Visalli N, Cavallo MG, Beales P, Negri M, Ghirlanda G, Papa V, Andreani D. Normalization of the CD4/CD8 lymphocyte ratio and increased B lymphocytes in long standing diabetic patients following therapy with thymopentin. Diabetes Res 1987; 6: 51-6. 15. Pawelec G, Adibzadeh M, Rehbein A, Hahnel K, Wagner W, Engel A. In vitro senescence models for human T lymphocytes. Vaccine 2000; 18: 1666-74. 16. Solana R, Mariani E. NK and NK/T cells in human senescence. Vaccine 2000; 18: 1613-20. 17. Polignano A, Tortorella C, Venezia A, Jirillo E, Antonaci S. Age-associated changes of neutrophil responsiveness in a human healthy elderly population. Cytobios 1994; 80: 145-53. 18. Tortorella C, Ottolenghi A, Pugliese P, Jirillo E, Antonaci S. Relationship between respiratory burst and adhesiveness capacity in elderly polymorphonuclear cells. Mechanisms of Ageing & Development 1993; 69: 53-63. 19. Diaz-Jauanen E, Strickland RG, Williams RC. Studies of human lymphocytes in the newborn and the aged. American Journal of Medicine 1975; 58: 620-8. 20. Symmons DP, Barrett EM, Bankhead CR, Scott DG, Silman AJ. The incidence of rheumatoid arthritis in the United Kingdom: results from the Norfolk Arthritis Register. Br J Rheumatol 1994; 33: 735-9. 21. van Schaardenburg D, Breedveld FC. Elderly-onset rheumatoid arthritis. Seminars in Arthritis & Rheumatism 1994; 23: 367-78. 22. Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS, Healey LA, Kaplan SR, Liang MH, Luthra HS. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum 1988; 31: 315-24. 23. R.S.Cecil, W.H.Krammerer. Arthritis in the aged. American Journal of Medicine 1951; 13: 439-45. 24. Deal CL, Meenan RF, Goldenberg DL, Anderson JJ, Sack B, Pastan RS, Cohen AS. The clinical features of elderly-onset rheumatoid arthritis. A comparison with younger-onset disease of similar duration. Arthritis & Rheumatism 1985; 28: 987-94. 25. Terkeltaub R, Esdaile J, Decary F, Tannenbaum H. A clinical study of older age rheumatoid arthritis with comparison to a younger onset group. Journal of Rheumatology 1983; 10: 418-24. 26. Moesmann G. Clinical features in subacute rheumatoid arthritis in old age. Acta Rheumatologica Scandinavica 1968; 14: 285-97. 27. Bajocchi G, La Corte R, Locaputo A, Govoni M, Trotta F. Elderly onset rheumatoid arthritis: clinical aspects. Clinical & Experimental Rheumatology 2000; 18: S49-50. 28. Caroit M. Polyarthritis in the elderly. Zeitschrift für Gerontologie 1993; 26: 13-6. 29. Kaltenhauser S, Wagner U, Schuster E, Wassmuth R, Arnold S, Seidel W, Troltzsch M, Loeffler M, Hantzschel H. Immunogenetic markers and seropositivity predict radiological progression in early rheumatoid arthritis independent of disease activity. Journal of Rheumatology 2001; 28: 735-44. 30. van Zeben D, Hazes JM, Zwinderman AH, Cats A, Schreuder GM, D’Amaro J, Breedveld FC. Association of HLA-DR4 with a more progressive disease course in patients with rheumatoid arthritis. Results of a follow-up study. Arthritis & Rheumatism 1991; 34: 822-30. 31. Meretey K, Gomor B, Gorgenyi F, Gyody E, Petranyi GG. Study of autoantibodies, natural antibodies and IgE level in four families with rheumatoid arthritis. Zeitschrift für Rheumatologie 1987; 46: 189-95. 32. Healey LA. Rheumatoid arthritis in the elderly. Clinics in Rheumatic Diseases 1986; 12: 173-9. 33. Terkeltaub R, Decary F, Esdaile J. An immunogenetic study of older age onset rheumatoid arthritis. Journal of Rheumatology 1984; 11: 147-9. 34. Ferraccioli G, Savi M. Association between DR antigens, rheumatoid arthritis with and without extraarticular features and systemic lupus erythematosus in Northern Italy. Journal of Rheumatology 1988; 15: 51-3. 35. Salvarani C, Macchioni P, Mantovani W, Portioli I. Polymyalgia rheumatica and seronegative rheumatoid arthritis: some considerations based on a northern Italian population. Journal of Rheumatology 1993; 20: 756-7. 36. Straub RH, Miller LE, Schölmerich J, Zietz B. Cytokines and hormones as possible links between endocrino-senescence and immuno-senescence. Journal of Neuroimmunology 2000; 109: 10-5. 37. Pitzalis C, Pipitone N, Pipitone V, Fioravanti A, Marcolongo R. L’artrite reumatoide: recenti acquisizioni e nuovi concetti patogenetici. Recenti Progressi in Medicina 2001; 92: 217-22. 38. Chikanza IC, Petrou P, Kingsley G, Chrousos G, Panayi, GS. Defective hypothalamic response to immune and inflammatory stimuli in patients with rheumatoid arthritis. Arthritis & Rheumatism 1992; 35: 1281-8. 39. Jefferies WM. The etiology of rheumatoid arthritis. Medical Hypotheses 1998; 51: 111-4. 40. Jefferies WM. Mild adrenocortical deficiency, chronic allergies, autoimmune disorders and the chronic fatigue syndrome: a continuation of the cortisone story. Medical Hypotheses 1994; 42: 183-9. 41. Merlino LA, Cerhan JR, Criswell LA, et al. Female reproductive factors and the risk of elderly onset rheumatoid arthritis. ACR 64th Meeting Poster [110]. 2000. 42. Perazella MA. COX-2 inhibitors and the kidney. Hosp Pract (Off Ed) 2001; 36: 43-6. 43. Taggart AJ, McDermott B, Delargy M, Elborn S, Forbes J, Roberts SD, Ahnfelt NO. The pharmacokinetics of sulphasalazine in young and elderly patients with rheumatoid arthritis. Scandinavian Journal of Rheumatology 1987; (suppl) 64: 29-36. 44. Kean WF, Bellamy N, Brooks PM. Gold therapy in the elderly rheumatoid arthritis patient. Arthritis & Rheumatism 1983; 26: 705-11. 45. Bressolle F, Bologna C, Kinowski JM, Arcos B, Sany J, Combe B. Total and free methotrexate pharmacokinetics in elderly patients with rheumatoid arthritis. A comparison with young patients. Journal of Rheumatology 1997; 24: 1903-9. 46. Tett SE, Triggs EJ. Use of methotrexate in older patients. A risk-benefit assessment. Drugs & Aging 1996; 9: 458-71. 47. Sibilia J, Friess S, Schaeverbeke T, Maloisel F, Bertin P, Goichot B, Kuntz JL. Remitting seronegative symmetrical synovitis with pitting edema (RS3PE): a form of paraneoplastic polyarthritis? Journal of Rheumatology 1999; 26: 115-20. 48. Isturiz Abadia A, Bartolome Resano R, Olcoz Flamarique FJ, del Cazo Cativiela J. Benign edematous benign (RS3PE) in a an elderly person. Revista Clinica Espanola 1998; 198: 712. N. Pipitone, C. Pitzalis: Le artropatie infiammatorie nell’età senile 49. Tada Y, Sato H, Yoshizawa S, Kimura H, Kitamura M, Kusaba T, Nagasawa, K. Remitting seronegative symmetrical synovitis with pitting edema associated with gastric carcinoma. Journal of Rheumatology 1997; 24: 974-5. 50. Caplanne D, Tubach F, Le Parc JM. Late onset spondylarthropathy: clinical and biological comparison with early onset patients. Annals of the Rheumatic Diseases 1997; 56: 176-9. 51. Schreckenberg C, Asch PH, Sibilia J, Walter S, Lipsker D, Heid E, Grosshans E. Interstitial granulomatous dermatitis and paraneoplastic rheumatoid polyarthritis disclosing cancer of the lung. Ann Dermatol Venereol 1998; 125: 585-8. 52. Pines A, Kaplinsky N, Olchovsky D, Frankl O. Rheumatoid arthritis-like syndrome: a presenting symptom of malignancy. Report of 3 cases and review of the literature. Eur J Rheumatol Inflamm 1984; 7: 51-5. 53. Zvaifler N. Cancer and other miscellaneous arthropathies. In: Klippel JH, Dieppe PA (eds). Rheumatology. London: Mosby 1998: 28.1-28.6. 54. Rozenberg S, Koeger AC, Bourgeois P. Annales de Radiologie 1992; 35: 396-401. 55. Bridges AJ, Hickman PL. RS3PE syndrome and polymyalgia rheumatica: distinguishing features. Journal of Rheumatology 1991; 18: 1764-5. 56. Dieppe PA, Doherty M, Macfarlane DG, Hutton CW, Bradfield JW, Watt I. Apatite associated destructive arthritis. British Journal of Rheumatology 1984; 23: 84-91. 57. S.DeSeze, A.Babault, S.Random. L’epaule senile hemorrhagique. L’Actualité Rheumatologique. Paris: Expansion Scientifique Française 1968: 107-15. 58. Hazleman BL. Polymyalgia rheumatica and giant cell arteritis. In: Klippel JH, Dieppe PA (eds). Rheumatology. London: Mosby 1998: 7.21.1-7.21.8. 59. Myklebust G, Gran JT. A prospective study of 287 patients with polymyalgia rheumatica and temporal arteritis: clinical and laboratory manifestations at onset of disease and at the time of diagnosis. British Journal of Rheumatology 1996; 35: 1161-8. 60. Bahlas S, Ramos-Remus C, Davis P. Clinical outcome of 149 patients with polymyalgia rheumatica and giant cell arteritis. Journal of Rheumatology 1998; 25: 99-104. 61. Hunder GG. Clinical features of GCA/PMR. Clinical & Experimental Rheumatology 2000; 18: S6-8. 62. Boiardi L, Salvarani C, Macchioni P, Casadei MM, Mancini R, Beltrandi E, Portioli I. CD8 lymphocyte subsets in active polymyalgia rheumatica: comparison with elderly-onset and adult rheumatoid arthritis and influence of prednisone therapy. British Journal of Rheumatology 1996; 35: 642-8. 63. Meliconi R, Pulsatelli L, Uguccioni M, Salvarani C, Macchioni P, Melchiorri C, Focherini MC, Frizziero L, Facchini A. Leukocyte infiltration in synovial tissue from the shoulder of patients with polymyalgia rheumatica. Quantitative analysis and influence of corticosteroid treatment. Arthritis & Rheumatism 1996; 39: 1199-207. 64. Cantini F, Salvarani C, Olivieri I, Niccoli L, Macchioni P, Boiardi L, Mastrorosato M, Ciancio G, Padula A, Bozza A, Rubini F. Inflamed shoulder structures in polymyalgia rheumatica with normal erythrocyte sedimentation rate. Arthritis & Rheumatism 2001; 44: 1155-9. 65. Pavlica P, Barozzi L, Salvarani C, Cantini F, Olivieri, I. Magnetic resonance imaging in the diagnosis of PMR. Clinical & Experimental Rheumatology 2000; 18: S38-9. 441 66. Gonzalez-Gay MA, Garcia-Porrua C, Salvarani C, Olivieri, I, Hunder GG. Polymyalgia manifestations in different conditions mimicking polymyalgia rheumatica. Clinical & Experimental Rheumatology 2000; 18: 755-9. 67. Glennas A, Kvien TK, Andrup O, Karstensen B, Munthe E. Recent onset arthritis in the elderly: a 5 year longitudinal observational study. Journal of Rheumatology 2000; 27: 101-8. 68. Dimant J. Rheumatoid arthritis in the elderly, presenting as polymyalgia rheumatica. Journal of the American Geriatrics Society 1979; 27: 183-5. 69. Wilke WS, Sheeler LR, Makarowski WS. Hypothyroidism with presenting symptoms of fibrositis. Journal of Rheumatology 1981; 8: 626-31. 70. Pullman-Mooar S, Gordon GV. Is there seasonal variation in the onset of symptoms for polymyalgia rheumatica and giant cell arteritis? A community based study. ACR 64th Meeting Poster [202] 2000. 71. Faerk KK. Simultaneous occurrence of polymyalgia rheumatica in a married couple. Journal of Internal Medicine 1992; 231: 621-2. 72. Kyle MV, Hazleman BL, King RH. Polymyalgia rheumatica/giant cell arteritis in husband and wife. Clinical Rheumatology 1984; 3: 395-6. 73. Uddhammar A, Boman J, Juto P, Rantapaa Dahlqvist S. Antibodies against Chlamydia pneumoniae, cytomegalovirus, enteroviruses and respiratory syncytial virus in patients with polymyalgia rheumatica. Clinical & Experimental Rheumatology 1997; 15: 299-302. 74. Dasgupta B, Panayi GS. Interleukin-6 in serum of patients with polymyalgia rheumatica and giant cell arteritis. British Journal of Rheumatology 1990; 29: 456-8. 75. Straub RH, Gluck T, Cutolo M, Georgi J, Helmke K, Scholmerich J, Vaith P, Lang B. The adrenal steroid status in relation to inflammatory cytokines (interleukin-6 and tumour necrosis factor) in polymyalgia rheumatica. Rheumatology (Oxford) 2000; 39: 624-31. 76. McCarty DJ, O’Duffy JD, Pearson L, Hunter JB. Remitting seronegative symmetrical synovitis with pitting edema. RS3PE syndrome. JAMA 1985; 254: 2763-7. 77. Chaouat D, Perier JY, Le Parc JM, Belange G. Subacute edematous polyarthritis in the elderly. 9 cases. Presse Médicale 1990; 19: 1705-8. 78. Finnell JA, Cuesta IA. Remitting seronegative symmetrical synovitis with pitting edema (RS3PE) syndrome: a review of the literature and a report of three case. Journal of Foot & Ankle Surgery 2000; 39: 189-93. 79. Cantini F, Salvarani C, Olivieri I, Barozzi L, Macchioni L, Niccoli L, Padula A, Pavlica P, Boiardi L. Remitting seronegative symmetrical synovitis with pitting oedema (RS3PE) syndrome: a prospective follow up and magnetic resonance imaging study. Annals of the Rheumatic Diseases 1999; 58: 230-6. 80. Cobeta Garcia JC, Martinez Burgui J. RS3PE syndrome or benign edematous polysynovitis in the elderly. Study of 8 cases. Revista Clinica Espanola 1999; 199: 785-9. 81. Olive A, del Blanco J, Pons M, Vaquero M, Tena X. The clinical spectrum of remitting seronegative symmetrical synovitis with pitting edema. The Catalan Group for the Study of RS3PE. Journal of Rheumatology 1997; 24: 333-6. 82. Ethiopia A, Bell D. Gastric carcinoma in association with remitting seronegative symmetrical synovitis with pitting edema. Journal of Rheumatology 1999; 26: 1203-4. 442 Recenti Progressi in Medicina, 95, 9, 2004 83. Berthier S, Toussirot E, Wendling D. Acute benign edematous polyarthritis in the elderly (or RA3PE syndrome). Clinical course a propos of 13 cases. Presse Médicale 1998; 27: 1718-22. 84. Vinci M, Malaguarnera L, Pistone G. RS3PE and ovarian cancer. Annals of the Rheumatic Diseases 2001; 60: 429-31. 85. Cantini F, Salvarani C, Olivieri I. Paraneoplastic remitting seronegative symmetrical synovitis with pitting edema. Clinical & Experimental Rheumatology 1999; 17: 741-4. 86. Schaeverbeke T, Fatout E, Marce S, Vernhes JP, Halle O, Antoine JF, Lequen L, Bannwarth B, Dehais J. Remitting seronegative symmetrical synovitis with pitting oedema: disease or syndrome? Annals of the Rheumatic Diseases 1995; 54: 681-4. Indirizzo per la corrispondenza: Dott. Nicolò Pipitone Arcispedale Santa Maria Nuova U.O. di Reumatologia Salita 6, Piano 3 Viale Risorgimento, 80 42100 Reggio Emilia E-mail: [email protected] 87. Billey T, Navaux F, Lassoued S. Remitting seronegative symmetrical synovitis with pitting edema (RS3PE) as the first manifestation of periarteritis nodosa. Report of a case. Revue du Rhumatisme 1995; 62: 53-4. 88. Koeger AC, Karmochkine M, Chaibi P. RS3PE syndrome associated with advanced ankylosing spondylitis. Journal of Rheumatology 1995; 22: 375-6. 89. Cimmino MA, Silvestri E, Garlaschi G. Remitting seronegative symmetrical synovitis with pitting oedema (RS3PE) as recurrence of aborted PMR. Annals of the Rheumatic Diseases 2001, 60: 303. 90. Magy N, Michel F, Auge B, Toussirot E, Wendling D. Amyloid arthropathy revealed by RS3PE syndrome. Revue du Rhumatisme 2000; 67: 475-7.
Scaricare