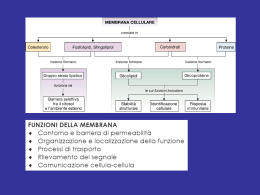
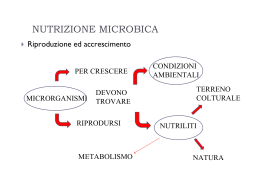
3 3.1. LLE ESIGENZE MICROBICHE INTRODUZIONE Dato che le cellule microbiche possiedono dimensioni piuttosto modeste, lo studio condotto sulle singole unità cellulari comporta notevoli difficoltà ed è di fatto impossibile. Per questo motivo, di norma, si ricorre all’impiego di tecniche colturali attraverso le quali si ottengono elevate quantità d’individui identici, che riproducono in modo fedele (cloni) le caratteristiche dei singoli individui. L’analisi dei fattori nutrizionali necessari alle colture microbiche è stato un settore di studio molto interessante e proficuo, soprattutto nei primi anni della ricerca microbiologica, quando ha portato ad importanti risultanti, come la scoperta di alcuni aminoacidi. Tale settore ha perso gran parte della sua importanza teorica, quando si è compreso che, anche nelle forme biologiche più semplici, la nutrizione era un elemento marginale di un meccanismo biochimico ben più complesso. Ciononostante nella coltivazione microbica permangono aperti problemi di ordine pratico, in quanto in vitro può essere coltivata solo una limitata parte di tutti i microrganismi presenti in natura, mentre molti altri crescono con difficoltà o non crescono affatto, a meno che non siano inoculati in animale vivo. La coltivazione microbica è un’attività piuttosto comune in laboratorio. Piccoli contenitori, come bottiglie, piastre FIGURA 3.1 ◗ nismi. Piastra Petri impiegata nella coltura dei microrga- Petri (figg. 3.1 e 3.4) provette e beute, permettono l’agevole coltivazione di una grande varietà di microrganismi, con l’adozione di substrati nutrizionali e condizioni chimiche e fisiche adeguate. Nell’ambito dei microrganismi i batteri sono tra le forme più semplici da coltivare; sono dotati di una scarsa crescita in volume, ma possiedono una rapida proliferazione cellulare mediante un processo di riproduzione asessuata (scissione binaria). Con questo processo proliferativo producono popolazioni d’individui identici, sia dal punto di vista genetico, sia fenotipico. I primi ad essere coltivati e ad essere studiati sono stati proprio i batteri, poiché tra essi erano comprese numerose specie di grande interesse patologico. Già nella seconda metà del 1800, Pasteur, Koch e altri ricercatori erano nelle condizioni di far crescere numerose specie patogene, come ad esempio il bacillo del carbonchio, gli enterobatteri, il vibrione del colera e il bacillo tubercolare. 3.2. ESIGENZE ENERGETICHE I microrganismi richiedono un adeguato apporto energetico che consente lo sviluppo di tutti i processi endoergonici cellulari, come l’anabolismo (sintesi delle proteine, degli acidi nucleici, dei polisaccaridi), le attività di trasporto attivo e il FIGURA 3.2 ◗ Colonie microbiche cresciute su un terreno di col- tura in piastra. 1 2 Le basi microbiologiche della Biochimica FIGURA 3.3 ◗ Terreni di coltura pronti all’uso in piastre e provette, mantenuti in ambiente refrigerato. movimento. Le forme d’energia utilizzate sono essenzialmente: • la radiazione elettromagnetica solare (soprattutto in corrispondenza dello spettro visibile); • l’energia chimica contenuta nelle molecole inorganiche (es. nitrati e nitriti) ed organiche (es. glucidi, lipidi e protidi). Qualunque sia la forma utilizzata, l’energia è impiegata per la produzione di coenzimi ridotti (NADH, NADPH) e ATP (adenosintrifosfato). Quest’ultimo composto rappresenta il fondamentale combustibile cellulare in quanto, una volta sintetizzato, rende rapidamente disponibile il suo contenuto energetico per tutte le attività cellulari che lo richiedono. Gli organismi che utilizzano come fonte energetica la luce solare, si definiscono fototrofi o fotoautotrofi: comprendono le piante, le alghe, i cianobatteri, i batteri verdi e purpurei e alcuni archeobatteri. Tutti questi producono ATP mediante la fotosintesi clorofilliana o processi che impiegano pigmenti diversi dalla clorofilla (carotenoidi). Gli organismi che utilizzano l’energia contenuta nelle sostanze organiche, vengono definiti chemioeterotrofi o chemiorganotrofi. Comprendono animali, funghi, protozoi e la maggior parte dei batteri. Estraggono l’energia contenuta nelle molecole organiche; queste ultime sono degradate in modo più o meno completo attraverso processi come la respirazione aerobica, la fermentazione e la respirazione anaerobica. Esiste anche una terza, ma limitata categoria di microrganismi procariotici, capaci di estrarre energia da reazioni redox in cui sono coinvolti substrati inorganici. Questi organismi, per le loro caratteristiche nutrizionali, possono essere definiti come chemioautotrofi o chemiolitotrofi. 3.2.1. Fotoautotrofismo È un processo bioenergetico in cui l’energia luminosa è utilizzata per trasferire il potere riducente (protoni ed elettroni) da una molecola stabile e a basso contenuto energetico, come l’acqua (H2O) o una sostanza equivalente (H2S), a una molecola instabile con alto contenuto energetico, come il carbonio inorganico rappresentato dalla CO2. La fotosintesi può essere rappresentata dalla seguente reazione, in cui H2A è il donatore del potere riducente: CO2 + 2H2A + E lum. → CH2O + 2A + H2O Piante, alghe (figg. 3.5, 3.6 e 3.7) e cianobatteri, utilizzano l’acqua come fonte del potere riducente, mentre producono O2 come prodotto di scarto. Per questo motivo il processo è definito fotosintesi ossigenica. La reazione complessiva è: FIGURA 3.4 ◗ Coltura di lieviti in piastra. CO2 + 2H2O + E lum. → CH2O + O2 + H2O Capitolo 3. Le esigenze microbiche 3 La fotosintesi è fortemente endoergonica; la grande quantità d’energia necessaria è fornita dalla luce solare. È alla base di tutti i processi biologici presenti nella biosfera, in quanto mette a disposizione degli organismi chemioeterotrofi una notevole quantità e varietà di molecole organiche, fondamentali per il contenuto energetico posseduto e perché producono gli scheletri carboniosi alla base dei processi biosintetici. 3.2.2. Chemiotrofismo Comprende il chemioautotrofismo e il chemioeterotrofismo. 3.2.2.1. FIGURA 3.5 ◗ Spirogyra: un’alga eucariotica pluricellulare filamentosa. Chemioautotrofismo È un processo presente solamente in alcuni organismi procariotici. È caratterizzato dalla capacità di ossidare composti inorganici in alternativa alle sostanze organiche. Nel chemioautotrofismo il processo di riferimento è rappresentato dalla respirazione aerobica; come in quest’ultima, la sintesi dell’ATP è legata all’ossidazione dei substrati attraverso una catena respiratoria, in cui l’accettore finale dei protoni e degli elettroni è l’ossigeno molecolare. I substrati da cui è ricavato il potere riducente sono inorganici e in particolare: l’ammoniaca (NH4+), i nitriti (NO2–), l’idrogeno molecolare (H2), solfuri (S2–) e lo ione ferroso (Fe2+). 3.2.2.2. Chemioeterotrofismo Permette di convertire l’energia chimica contenuta nelle sostanze organiche in ATP; comprende processi come la respirazione aerobica, la fermentazione e la respirazione anaerobica. FIGURA 3.6 ◗ Un’alga verde costituita da quattro elementi cellulari. Respirazione aerobica. È la forma di metabolismo energetico più diffusa in natura, sia tra gli organismi eucariotici, sia tra quelli procariotici. Il processo, che è essenzialmente ossidoriduttivo, richiede come donatore del potere riducente la sostanza organica come ad esempio: i glucidi, i lipidi ed i protidi. L’accettore dei protoni e degli elettroni è l’ossigeno molecolare. Il processo complessivo, partendo dal glucosio, può essere rappresentato dalla seguente reazione: C6H12O6 + 6O2 → 6CO2 + 6H2O + 36/38ATP FIGURA 3.7 ◗ Una desmidiacea: alga verde unicellulare fotosintetica. La singola cellula è suddivisa in due semicellule da un restringimento centrale. I batteri verdi e purpurei utilizzano H2S come fonte del potere riducente; in questo caso non è prodotto ossigeno molecolare come scarto, ma zolfo (S). Per la mancata produzione dell’ossigeno, il processo è definito fotosintesi anossigenica: CO2 + 2H2S + E lum. → CH2O + 2S + H2O La respirazione aerobica consiste essenzialmente nell’ossidazione dei substrati organici da parte dell’ossigeno molecolare che, al contempo, si riduce ad acqua. Il processo è fortemente esoergonico, in quanto libera almeno 2868 kJ per ogni mole di glucosio e produce teoricamente 36-38 moli di ATP. Richiede la presenza di una catena di trasporto in cui gli elettroni, attraverso reazioni sequenziali, fluiscono dai substrati fino all’ossigeno molecolare; libera energia che è impiegata per la sintesi dell’ATP (fosforilazione ossidativa). Fermentazione. È diffusa soprattutto tra i procarioti; si sviluppa con meccanismi molto diversi. In molti microrganismi, è attuata se manca un adeguato apporto di ossigeno molecolare (anaerobi facoltativi, fig. 3.8); per altri, indipendentemente dalla presenza o meno dell’ossigeno molecolare, rappresenta l’unico processo metabolico in grado di produrre ATP. Con questa modalità bioenergetica i microrganismi sono in grado di produrre una modesta quantità di ATP (1-2 moli di ATP per ogni mole di glucosio utilizzato, fig. 3.9). Comporta la parziale degradazione dei substrati orga- 4 Le basi microbiologiche della Biochimica Alcuni microrganismi autotrofi, come alcuni archeobatteri, se mancano le condizioni per l’attivazione della fotosintesi, modificano il proprio metabolismo impiegando carbonio organico, al posto del carbonio inorganico (CO2). Questa capacità è indicata come fotoautotrofismo facoltativo. 3.3. FIGURA 3.8 ◗ Saccharomyces cerevisiae osservato dopo colorazione di Gram a 1000×. Questo microrganismo eucariotico è dotato di un metabolismo aerobico facoltativo: respiratorio in presenza di ossigeno, fermentativo in carenza di ossigeno (fermentazione alcolica). FIGURA 3.9 ◗ Enterobatteri. In questa famiglia sono compresi batteri Gram negativi dotati di un metabolismo esclusivamente fermentativo (fermentazione acido mista). nici e la formazione di altri composti organici a contenuto energetico più basso. Il prodotto finale definisce il tipo di fermentazione: (alcool etilico → alcolica, acido lattico → lattica, acido propionico → propionica, acido butirrico → butirrica). La fermentazione lattica può essere schematizzata dalla seguente reazione: C6H12O6 → 2C3H6O3 + 2ATP Respirazione anaerobica. È presente in alcuni organismi procariotici. È un processo per certi versi paragonabile alla respirazione aerobica, poiché comporta la degradazione per via ossidativa dei substrati organici; in questo caso, tuttavia, l’accettore dei protoni e degli elettroni non è l’ossigeno molecolare, ma un composto inorganico come il nitrato, il solfato, il carbonato. In questo caso la quantità di ATP prodotta è di 8-10 molecole di ATP o meno. L’apporto energetico quindi è superiore alla fermentazione, ma inferiore alla respirazione aerobica. La respirazione anaerobica dell’acetato da parte dei solfati può essere schematizzata dalla seguente reazione: CH3COO– + SO42– + 3H+ → 2CO2 + H2S + 2H2O ΔG°' = –57,5 kj/mole ESIGENZE NUTRIZIONALI Oltre ad un adeguato apporto energetico, ogni microrganismo deve avere a disposizione un complesso di molecole (nutrienti) con cui sviluppare i processi metabolici di cui necessita. Le esigenze nutrizionali dipendono dal tipo di metabolismo che i microrganismi sono in grado di attuare (fotoautotrofismo, chemioautotrofismo o chemioeterotrofismo) e variano da specie a specie in base al patrimonio enzimatico posseduto. Tutto il complesso delle molecole occorrenti agli organismi, può essere schematicamente suddiviso nei cosiddetti principi nutrizionali che permettono una visione più analitica dell’argomento in questione. Per i microrganismi autotrofi, i principi richiesti sono necessariamente: acqua, ioni inorganici (cationi e anioni), una fonte d’azoto, una fonte di carbonio e una fonte di zolfo; per gli eterotrofi, oltre agli stessi principi necessari agli autotrofi, in genere sono richiesti anche fattori di crescita essenziali, vale a dire sostanze organiche di varia natura, che non riescono a sintetizzare autonomamente. • Acqua. È il composto fondamentale della vita. Rappresenta il mezzo in cui si disciolgono le sostanze biologicamente attive e in cui si sviluppano tutti i processi biologici. Costituisce orientativamente circa il 70% del peso complessivo cellulare; normalmente è richiesta in grandi quantità. Negli ambienti di crescita per i batteri, ad esempio, deve essere presente in concentrazione superiore al 90%. Entra anche in numerose reazioni biologiche ossidoriduttive, idrolitiche e di condensazione. • Ioni inorganici. Sono richieste quantità relativamente elevate di alcuni ioni come ad esempio: PO43–, K+, Ca2+, Na+, Mg2+, Cl–, e Fe2+, in quanto molti di essi sono un elemento costitutivo della sostanza organica (PO43– ad esempio negli acidi nucleici). Altri ioni come Cu+, Ni2+, Co2+ e Zn2+, sono richiesti in quantità piuttosto modeste (oligoelementi), tuttavia sono fondamentali per lo sviluppo di alcuni importanti processi, in quanto entrano nella costituzione di numerosi enzimi. • Carbonio. È alla base di tutte le molecole organiche. Può essere assunto sotto forma organica o inorganica. La CO2 è la forma normalmente utilizzata dagli organismi autotrofi (piante, alghe e cianobatteri). I chemioeterotrofi, invece, utilizzano carbonio organico in forme che variano, in base alle caratteristiche nutrizionali possedute dalle singole specie. Possono impiegare, ad esempio, carboidrati, lipidi, proteine, idrocarburi e alcoli. • Azoto. È contenuto in importanti molecole organiche come le proteine e gli acidi nucleici; dagli autotrofi è assunto in forma inorganica (nitrati), mentre dai chemioeterotrofi in forma organica (proteine). L’azoto inorganico è rappresentato principalmente da quello ammoniacale, nitroso, nitrico o molecolare. L’azoto organico più frequentemente utilizzato è quello proteico. Le proteine integre o parzialmente idrolizzate (peptoni) rappresentano la fonte di azoto più comune dei microrganismi eterotrofi. Capitolo 3. Le esigenze microbiche 5 TABELLA 3.1. Classificazione dei microrganismi in rapporto alle esigenze energetiche e nutrizionali Microrganismi fototrofi Gruppi nutrizionali Fotoautotrofi obbligati Fotoautotrofi facoltativi Chemioautotrofi Chemioeterotrofi Fonte energetica Radiazione luminosa Radiazione luminosa Sostanze organiche Sostanze inorganiche Sostanze organiche Gruppo microbico Alghe eucariotiche Cianobatteri Batteri verdi Batteri rossi Archeobatteri Batteri rossi non sulfurei Idrogenobatteri Batteri nitrosanti Batteri nitrificanti Solfobatteri Ferrobatteri Animali Protozoi Micromiceti Batteri Fonte di carbonio CO2 CO2 e C organico CO2 C organico • Zolfo. Partecipa alla struttura di importanti molecole • Microrganismi chemiotrofi organiche come alcuni aminoacidi solforati (metionina e cisteina) e coenzimi (CoA). È utilizzato da alcuni microrganismi sotto forma inorganica; in questo caso i solfati rappresentano la forma utilizzata con maggiore frequenza, mentre le forme organiche, in genere, sono rappresentate dagli aminoacidi solforati. Fattori di crescita essenziali. Sono composti organici di varia natura che numerosi batteri non sono in grado di sintetizzare autonomamente; devono essere necessariamente presenti nel mezzo di crescita. Sono in particolare: vitamine, acidi grassi (richiesti in modeste concentrazioni), aminoacidi, basi azotate (richiesti in alte concentrazioni). I microrganismi più esigenti in questo senso sono i patogeni; alcuni di essi possiedono esigenze nutrizionali tanto elevate da potere essere soddisfatte solo estraendole direttamente dagli organismi che parassitano. 3.4. ASSUNZIONE DEI NUTRIENTI Il regolare sviluppo di tutti i processi biologici impone ai microrganismi un continuo ed equilibrato rifornimento cellulare dei principi nutrizionali necessari. Nei batteri, nei fun- ghi microscopici e in una parte dei protozoi (sporozoi) l’assunzione dei nutrienti, in genere avviene per assorbimento attraverso la membrana cellulare. In altri microrganismi, come i ciliati ed i rizopodi (amebe), l’assunzione avviene invece con l’ingestione di particelle di grandi dimensioni, rappresentate spesso da batteri, alghe ed altre forme microbiche. L’assunzione per assorbimento richiede sistemi di trasporto posti a livello della membrana; è in grado di veicolare nella cellula microbica tutte le molecole necessarie. Dal momento che attraverso la membrana non è possibile il trasporto di complessi molecolari di grandi dimensioni (proteine, lipidi o polisaccaridi), nei microrganismi sono presenti meccanismi di digestione extracellulare. Attraverso la liberazione all’esterno della cellula di enzimi idrolitici (lipasi, amilasi, proteasi, ecc.), le macromolecole presenti nel mezzo di crescita vengono scisse nei loro monomeri e quindi assorbite. 3.4.1. Struttura della membrana La base organizzativa della membrana cellulare è costituita da un doppio strato fosfolipidico, nel quale sono immerse numerose molecole proteiche (fig. 3.10). Molte di esse sono implicate nella regolazione del passaggio dei soluti dall’ambiente esterno a quello interno della cellula e viceversa. TABELLA 3.2. I principali composti inorganici e organici contenenti carbonio, azoto e zolfo 3.4.1.1. Disposizione delle proteine di membrana Carbonio inorganico Carbonio organico CO2 Glucidi Lipidi Protidi Alcoli Idrocarburi Azoto inorganico Azoto organico NH4+ NO2 NO3 N2 Proteine Peptoni Aminoacidi Zolfo inorganico Zolfo organico SO42– Cisteina Metionina Molte proteine membranali galleggiano nel fluido lipidico; pertanto possono diffondere lateralmente, mantenendosi in costante movimento. Alcune proteine si aggregano tra loro costituendo strutture in grado di svolgere funzioni specifiche (catena respiratoria). Il complesso delle proteine di membrana può essere suddiviso in: proteine periferiche (proteine estrinseche) ed integrali (proteine intrinseche). Le proteine periferiche sono legate con interazioni deboli come legami idrogeno o interazioni elettrostatiche. In alcuni casi tra le proteine di membrana e la componente lipidica sono presenti legami covalenti tra acidi grassi, molecole isoprenoidi e il glicosil-fosfatidil-inositolo (GPI). L’ancoraggio con il GPI è presente solo nella superficie esterna (fig. 3.11); altri tipi di ancoraggio sono distribuiti nella superficie interna. Le proteine integrali sono legate in modo energico, mediante interazioni idrofobiche, alla componente apolare 6 Le basi microbiologiche della Biochimica NH+3 Teste polari C O NH CH 2 Code apolari CH 2 O Proteine periferiche GlcNac–Man–Man–Man–O P O O Man _ O Inositolo O – O P O C H2 O Proteine integrali O H2 C CH2 O O C CH2 FIGURA 3.11 ◗ Schema del legame di una proteina (in rosso) con il Glicosil-fosfatidil-inositolo (GPI) sulla parte esterna della membrana. FIGURA 3.10 ◗ Modello a mosaico fluido della membrana plasmatica: sul doppio strato fosfolipidico galleggiano le proteine integrali e periferiche. fosfolipidica della membrana (code apolari). Mentre in alcune proteine la parte idrofobica è situata al centro della struttura proteica, in altre è localizzata all’estremità della stessa. Questo modello è presente in tutte le cellule, tuttavia la sua composizione dipende anche dal tipo di cellula a cui appartiene. L’idrofobia del doppio strato fosfolipidico impedisce il passaggio attraverso la membrana delle molecole polari, che trovano in tale microambiente idrofobico un insormontabile ostacolo alla loro diffusione. Questo può essere spiegato anche dal punto di vista termodinamico con il fatto che le molecole polari, per potere oltrepassare la membrana, devono mutare da uno stato di idratazione, al di fuori di essa, ad uno stato di perdita della idratazione; quindi da uno stato più stabile ad uno meno vantaggioso dal punto di vista termodinamico. Le uniche molecole che possono oltrepassare la barriera offerta dalla membrana sono le molecole apolari e di piccole dimensioni (normalmente più piccole del glicerolo); molecole di questo tipo sono, in particolare, i gas come l’O2, la CO2, l’N2 e il CH4. Questo processo, definito diffusione semplice, segue le leggi della fisica e permette lo spostamento delle molecole da un gradiente di concentrazione più elevata ad uno a concentrazione più bassa. La diffusione cessa al momento in cui si raggiunge un equilibrio nella concentrazione tra le molecole poste tra i due lati della membrana. Il passaggio attraverso la membrana di molecole con dimensioni maggiori del glicerolo, di norma, è veicolato da molecole proteiche specializzate, definite trasportatori o carrier. Queste molecole sono capaci di riconoscere selettivamente le molecole veicolate e di trasferirle all’interno della cellula con meccanismi di varia natura. Il trasporto attraverso la membrana può avvenire secondo due modalità: il trasporto passivo e il trasporto attivo. Il trasporto passivo, definito anche diffusione facilitata, permette il trasferimento di molecole da un gradiente di concentrazione più elevata ad uno di concentrazione più bassa. Il trasporto attivo è caratterizzato, invece, dalla presenza di proteine in grado di veicolare le molecole attraverso la membrana, contro il gradiente di concentrazione. 3.4.1.2. Trasporto delle molecole attraverso la membrana La membrana possiede proteine in grado di riconoscere in modo specifico le molecole come aminoacidi, monosaccaridi e ioni presenti nell’ambiente di crescita e trasportarle all’inter- Capitolo 3. Le esigenze microbiche Diffusione libera Canale ionico Trasporto passivo 7 Trasporto attivo Gradiente di concentrazione ATP ADP + P FIGURA 3.12 ◗ Il passaggio delle molecole attraverso la membrana cellulare; i primi tre meccanismi sono con gradiente di concentrazione favorevole e non richiedono energia. L’ultimo processo è contro gradiente di concentrazione e richiede ATP. Uniporto FIGURA 3.13 ◗ Antiporto Simporto Le classi dei sistemi di trasporto. no della cellula, anche contro il gradiente di concentrazione o contro il gradiente elettrico. Se, com’è già stato indicato, il passaggio di soluti polari attraverso la membrana è ostacolato dalla idrofobia del doppio strato fosfolipidico, le numerose proteine presenti sulla membrana si legano in modo specifico alle molecole e ne abbassano l’energia di attivazione necessaria al trasporto. Le proteine con queste caratteristiche vengono definite trasportatori, permeasi o carrier. Nel trasporto passivo la direzione del passaggio molecolare avviene secondo il gradiente di concentrazione e non richiede dispendio energetico; il trasporto cessa quanto si raggiunge l’equilibrio tra le concentrazioni presenti sui due lati della membrana. Il trasporto passivo delle molecole si attua secondo due principali meccanismi: • attraverso canali polari che rappresentano corsie preferenziali per molecole polari di adeguate dimensioni; • mediante carrier che legano molecole specifiche e, a seguito di una modificazione conformazionale, le trasportano nella parte opposta della membrana. Il trasporto attivo avviene contro gradiente di concentrazione e necessita di un continuo apporto energetico sotto forma di ATP. Permette di mantenere differenze di concentrazione nei lati opposti della membrana (fig. 3.12). I sistemi di trasporto che interessano singole molecole si definiscono uniporto; quelli che sono in grado di traslocare contemporaneamente più molecole attraverso la membrana si definiscono sistemi di cotrasporto. Qualora tali molecole si muovano in direzioni opposte, il processo è definito antiporto; si parla di simporto, invece, se i due substrati si muovono nella stessa direzione (fig. 3.13). 3.5. ESIGENZE CHIMICO-FISICHE Lo sviluppo di ogni popolazione microbica richiede, oltre ad un continuo flusso di nutrienti dall’esterno, condizioni ambientali favorevoli. Alcuni fattori di tipo chimico-fisico, come la temperatura, il pH, la pressione osmotica e il potenziale redox, sono in grado di influenzare in modo significativo i processi biologici dei microrganismi. Di conseguenza, è fondamentale che ognuno di essi sia esaminato in dettaglio, per comprenderne gli effetti prodotti sull’attività microbica. 3.5.1. Temperatura Si prenda in considerazione l’E. coli. Se ne esamini la velocità di crescita in funzione della temperatura (T) e si rappresenti il tutto graficamente (fig. 3.14), riportando la temperatura (T, in gradi Celsius) sulle ascisse e la velocità di crescita (espressa come numero di generazioni/ora) sulle ordinate. Operando in questo modo, sul diagramma possono essere evidenziati tre punti di riferimento: la T. minima, la T. ottimale e la T. massima. • La temperatura minima (T. min.). Rappresenta la temperatura più bassa a cui vi è crescita microbica. Sotto di essa le cellule microbiche normalmente sono quiescenti, poiché gli enzimi che le costituiscono sono inattivi. Le cellule batteriche possono riattivarsi qualora siano riportate a valori compresi tra la T. min. e la T. max. • La temperatura ottimale (T. Ott.). È la temperatura a cui una specie microbica cresce con la massima velocità. Le basi microbiologiche della Biochimica Velocità di crescita espressa come numero di gen/ora 8 T. ott. 3.0 2.0 1.0 T. min. 0 10 T. max. 20 30 40 50 60 70 Temperatura in °C FIGURA 3.14 ◗ Curva di crescita di E. coli. • I criofili (psicrofili): possiedono una T. min. prossima temperatura a cui è ancora possibile una crescita microbica. Sopra di essa la riproduzione cellulare si annulla, poiché intervengono processi denaturativi delle proteine cellulari e la morte del microrganismo. Le temperature comprese tra la T. min. e la T. max. sono definite eugenesiche; comprendono tutti i valori che permettono la crescita microbica. I valori termici inferiori alla T. min. e superiori alla T. max. sono definiti temperature disgenesiche. Il mantenimento della popolazione microbica alle temperature disgenesiche non permette la proliferazione cellulare. L’esame delle temperature minime, ottimali e massime di un gran numero di specie batteriche, ha evidenziato la presenza in natura di tre gruppi fondamentali: i criofili (psicrofili), i mesofili ed i termofili (fig. 3.15). a 0 °C, una T. ott. intorno ai 15 °C e una T. max. intorno a 20 °C. Comprendono microrganismi procariotici (batteri) ed eucariotici (micromiceti e microalghe) adattati a vivere in zone fredde; possono facilmente ritrovarsi negli ambienti refrigerati artificialmente. I mesofili: possiedono una T. min. intorno ai 15 °C, una T. ott. intorno ai 35-37 °C e una T. max. intorno ai 50-55 °C; comprendono la maggior parte dei microrganismi ambientali adattati a vivere in climi temperati e i simbionti degli animali a sangue caldo. I termofili: possiedono una T. min. intorno ai 30 °C, una T. ott. intorno ai 50 °C e una T. max. intorno ai 60-65 °C. Comprendono numerose specie procariotiche e alcune eucariotiche adattate a vivere in ambienti caldi, come le acque termali. Velocità di crescita espressa come numero di gen/ora • La temperatura massima (T. max.). È la massima • • Criofili Mesofili 3.0 Termofili 2.0 1.0 0 10 20 30 40 50 60 70 Temperatura in °C FIGURA 3.15 ◗ Curva di crescita orientativa dei microrganismi criofili, mesofili e termofili. Capitolo 3. Le esigenze microbiche 9 numerosi archeobatteri. Questi procarioti sono ospiti abituali delle acque termali e delle profondità marine, poste in prossimità delle dorsali medio-oceaniche; è stato accertato che si riproducono a temperature prossime o superiori al punto di ebollizione dell’acqua. Na+ Cl – (3 g/l) Na+ Cl – (27 g/l) H2O 3.5.2. H2O Alta concentrazione di H2O Bassa concentrazione di Na+ Cl– Bassa concentrazione di H2O Alta concentrazione di Na+ Cl– Na+ Cl – (3 g/l) H2O Na+ Cl – (27 g/l) H2O FIGURA 3.16 ◗ Passaggio delle molecole d’acqua tra due soluzioni a diversa concentrazione, separate da una membrana semipermeabile. Si stabilisce un flusso di molecole d’acqua dal comparto in cui l’acqua stessa è a concentrazione più elevata (bassa concentrazione di cloruro di sodio) al comparto in cui è a concentrazione più bassa (alta concentrazione di cloruro di sodio); vale a dire da sinistra a destra nello schema in alto. Oltre a queste tre categorie di riferimento, devono essere ricordati i microrganismi adattati a vivere in condizioni ambientali estreme. Tra questi, sono degni di menzione alcuni micromiceti che si riproducono a temperature sotto il punto di congelamento (fino a –7; –10 °C). Al contrario, diverse specie procariotiche sono in grado di crescere a temperature molto elevate; tra queste possono essere citati Ambiente extracellulare Pressione osmotica equivalente a 7-9 g/l di NaCl H 2O H 2O Pressione osmotica Si esaminino due comparti separati da una membrana permeabile all’acqua, ma impermeabile al soluto, rappresentato ad esempio da una soluzione salina di cloruro di sodio (Na+ Cl–). Se nei due comparti sono poste soluzioni di cloruro di sodio a diversa concentrazione, si ha il passaggio dell’acqua dal comparto a più elevata concentrazione acquosa (più bassa concentrazione salina) al comparto a concentrazione acquosa meno elevata (più alta concentrazione salina); il flusso d’acqua si ha fino a che non si stabilisce una condizione d’equilibrio. La spinta che si esercita tra i due comparti, conseguente al passaggio dell’acqua, è indicata come pressione osmotica; essa assume valori tanto più elevati quanto più alta è la differenza tra le concentrazioni saline poste nei due comparti (fig. 3.16). Molti microrganismi possiedono al loro interno una concentrazione di soluti in grado di produrre una pressione osmotica equivalente, orientativamente, a quella prodotta da 7-9 g/l di NaCl. Ne consegue che l’ambiente ideale per la crescita di microrganismi con queste caratteristiche, è rappresentato da una soluzione acquosa contenente soluti in grado di produrre una pressione osmotica equivalente. Se la pressione osmotica ambientale è inferiore a quella cellulare, si determina il passaggio dell’acqua dall’ambiente esterno a quello interno con aumento del volume cellulare e, in casi estremi, la lisi (plasmoptisi). Se, al contrario, i valori della pressione osmotica esterna sono più elevati rispetto a quelli presenti all’interno della cellula microbica, si ha il richiamo delle molecole d’acqua dall’interno verso l’esterno, con la conseguente diminuzione del volume cellulare. Nelle cellule batteriche o in altri microrganismi dotati di parete, questa situazione comporta il distacco della membrana dalla parete cellulare (plasmolisi) (fig. 3.17). Oltre a microrganismi con queste caratteristiche, esistono specie che, come conseguenza dell’adattamento a Ambiente intracellulare Effetti prodotti Pressione osmotica equivalente a 9 g/l di NaCl La cellula è in equilibrio con l’ambiente Pressione osmotica equivalente a 3 g/l di NaCl H 2O Pressione osmotica equivalente a 9 g/l di NaCl La cellula si rigonfia Pressione osmotica equivalente a 25 g/l di NaCl H 2O Pressione osmotica equivalente a 9 g/l di NaCl Il citoplasma si raggrinzisce FIGURA 3.17 ◗ Rappresentazione schematica degli effetti prodotti da differenti concentrazioni di soluti presenti nel mezzo di crescita microbica. 10 Le basi microbiologiche della Biochimica TABELLA 3.3. Livelli di activity water (Aw) a varie concentrazioni di cloruro di sodio e di glucosio a 25 °C Aw NaCl (%) Glucosio (%) 1,00 0,00 0,00 0,99 1,74 8,90 0,98 3,43 15,74 0,96 6,57 28,51 0,94 9,38 37,83 0,92 11,90 43,72 0,90 14,18 48,54 0,88 16,28 53,05 0,86 18,18 58,45 TABELLA 3.4. Valori di Aw in alcuni alimenti e componenti della flora microbica concomitante Aw Alimenti Flora microbica 0,93-0,85 Salsicce essiccate Prosciutto crudo Staphylococcus aureus Muffe e lieviti 0,85-0,6 Frutta secca Farina Cereali Funghi xerofili Pesce sotto sale Nocciole Alofili Lieviti osmofili Dolciumi Miele Pasta Nessuna crescita microbica < 0,6 li). Questi comportamenti sono tipici dei microrganismi adattati a vivere in ambienti contenenti alte concentrazioni saline, come quelli che si ritrovano nelle acque marine, sulla superficie cutanea o sulla superficie di alimenti sottoposti a salagione, quali gli insaccati e le salamoie. La concentrazione dei soluti è in rapporto allo stato d’idratazione dell’ambiente preso in considerazione; di conseguenza esiste anche la possibilità di esaminare il problema focalizzando l’attenzione sulla concentrazione dell’acqua libera, piuttosto che su quella dei soluti. In particolare, il riferi- particolari habitat, sono dotate di un diverso comportamento. In particolare, tra i batteri, i lieviti e le muffe, sono comprese numerose specie che privilegiano concentrazioni saline normali, ma resistono a concentrazioni saline molto elevate (aloresistenti); altre specie crescono con difficoltà alle normali concentrazioni saline, ma privilegiano ambienti di crescita con alte concentrazioni di soluti (alofi- TABELLA 3.5. La scala del pH; acidità e basicità sono indicate con la normalità degli acidi e delle basi completamente dissociati Acidità Ioni H+ (moli per litro) pH Ioni OH– (moli per litro) 1,0 100 0 10–14 0,1 10–1 1 10–13 0,01 10–2 2 10–12 0,001 10–3 3 10–11 0,0001 –4 10 4 –10 10 0,00001 10–5 5 10–9 0,000001 10–6 6 10–8 pH neutro dell’acqua 10–7 7 10–7 –8 8 –6 10 0,000001 10–9 9 10–5 0,00001 –10 10 10 –4 10 0,0001 10–11 11 10–3 0,001 10–12 12 10–2 0,01 10–13 13 10–1 0,1 10–14 14 100 1,0 10 pH basico Alcalinità pH acido pH neutro dell’acqua Velocità di crescita espressa come N gen/ora Capitolo 3. Le esigenze microbiche 11 pH ott. 3.0 2.0 1.0 pH max. pH min. 0 1 2 3 4 5 6 7 8 9 11 10 12 13 14 Valori di pH FIGURA 3.18 ◗ Velocità di crescita di E. coli ai diversi valori di pH. mento che in questo caso può essere preso in considerazione è l’activity water (Aw). Questo parametro rappresenta la concentrazione dell’acqua libera (vale a dire l’acqua disponibile per le soluzioni e non legata alle molecole) presente nel mezzo di crescita. L’Aw è espressa matematicamente come il rapporto tra la tensione di vapore della soluzione considerata e la tensione di vapore dell’acqua distillata. Aw = concentrazione è il pH, cioè il logaritmo negativo della concentrazione idrogenionica. pH = 1/log [H+] pH = –log [H+] Come per la temperatura, anche per il pH esistono intervalli entro cui ogni specie microbica è in grado di attivare i propri processi biologici e riproduttivi. Al pH ottimale, la crescita è rapida; allontanandosi da questo valore la velocità della proliferazione diminuisce progressivamente fino ad annullarsi, in corrispondenza di valori definiti pH max. e pH min (fig. 3.18). Al di fuori di questi valori si producono profonde alterazioni a livello molecolare, con conseguente arresto delle attività metaboliche e morte cellulare. L’esame delle specie microbiche presenti in natura evidenzia la presenza di tre gruppi fondamentali: i neutrofili, gli acidofili e gli alcalofili (fig. 3.19). P P0 dove P rappresenta la tensione di vapore dalla soluzione, mentre P0 rappresenta la tensione di vapore dell’acqua distillata. 3.5.3. pH Velocità di crescita espressa come N gen/ora Un fattore chimico-fisico che influenza in modo rilevante l’attività microbica è sicuramente la concentrazione idrogenionica (ioni H+). Il parametro utilizzato per misurare tale Acidofili Neutrofili Basofili 3.0 2.0 1.0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Valori di pH FIGURA 3.19 ◗ Velocità di crescita dei microrganismi acidofili, neutrofili e basofili ai diversi valori di pH. 12 Le basi microbiologiche della Biochimica TABELLA 3.6. Valori limite di pH nella crescita di alcune specie microbiche pH di crescita Specie microbica Minimo Ottimale Massimo Penicillium verrucosum 2,0 5-6 10 Aspergillus flavus 2,0 5-6 11,2 Fusarium moniliforme 2,5 5-6 10,7 Saccharomyces cerevisiae 2,3 5-6 8,6 Staphylococcus aureus 4,0 6,3-7,3 9,8 Escherichia coli 4,4 6,0-7,0 8,5 4-4,5 6,0-7,0 8-9,6 Clostridium botulinum 4,6 6,1-7,1 8,5 Bacillus cereus 4,9 6,6-7,6 9,3 Salmonella typhi compresi tra 3,5-4,0. A questi parametri di pH si manifesta una forte azione inibitoria nei confronti di gran parte della flora batterica concomitante e un’efficace conservazione dei prodotti. In questo modo sono ottenuti: dal latte lo yogurt, mentre dai cavoli i crauti. 3.5.4. Tra le specie batteriche alcune si dimostrano alcalofile o acidofile; tuttavia la maggior parte di esse è in grado di crescere a valori di pH compresi tra 5 e 9 e con un pH ottimale intorno alla neutralità. Tra i micromiceti lieviti e muffe prediligono substrati acidi e un pH ottimale intorno a 5-6. Tra i protozoi gran parte delle specie predilige valori di pH tra 6 e 8, mentre la maggior parte delle alghe predilige valori di pH prossimi alla neutralità. L’influenza del pH sui processi metabolici è collegata alle modificazioni che esso provoca sulla solubilità di alcune componenti del terreno di coltura, come dei sali di ferro o dei metalli alcalino-terrosi, che precipitano in ambiente basico. Le variazioni di pH, inoltre, modificando lo stato di ionizzazione delle proteine di trasporto della membrana, alterano la permeabilità cellulare e condizionano la velocità di penetrazione delle molecole all’interno del microrganismo. Durante le coltivazioni, i microrganismi attuano frequentemente processi metabolici in cui sono prodotti e accumulati metaboliti acidi o basici; in particolare i metaboliti finali dei processi fermentativi dei carboidrati sono costituiti in genere da acidi (acido lattico, butirrico, propionico, acetico ed altri), che determinano un significativo abbassamento del pH. Altri processi metabolici, a carico soprattutto delle proteine, producono sostanze basiche, come l’ammoniaca, con conseguente innalzamento del pH. Dato che le alterazioni dei valori di pH condizionano in modo significativo la velocità della crescita microbica, è necessario ridurre al minimo le variazioni della concentrazione idrogenionica; ciò si ottiene, ad esempio, aggiungendo nei terreni di coltura sistemi tampone costituiti da K2HPO4 e da KH2PO4. I tamponi, aggiunti in idonee concentrazioni, costituiscono un’importante fonte di fosforo e, al contempo, comportano la stabilizzazione del pH. Durante la crescita di alcuni microrganismi, la modificazione del pH produce un effetto inibitorio sulla flora microbica concomitante; questo fatto può essere impiegato per conservare alcuni alimenti. I lattobacilli, ad esempio, inoculati in alcuni prodotti (latte, cavoli) mettono in moto la fermentazione lattica, con cui abbassano il pH fino a valori Potenziale redox Il potenziale redox misura la capacità ossidante di un determinato elemento o composto. In un ambiente destinato alla crescita microbica diversi elementi e composti influenzano il potenziale redox. Tra questi possono essere ricordati diversi ioni inorganici, come i solfati e i nitrati; tuttavia l’elemento che assume particolare importanza sotto questo aspetto è l’ossigeno molecolare (O2) sia perché posto al vertice dei processi metabolici ossidativi, sia per l’elevato potenziale redox che lo contraddistingue. Per questo motivo l’O2 possiede la capacità di produrre radicali liberi (come l’anione superossido: O2) che, per l’elevata tossicità, condizionano in modo negativo i processi biologici cellulari. I microrganismi possono essere classificati in rapporto al tipo di metabolismo energetico utilizzato e alla influenza determinata su di essi dall’ossigeno molecolare; in particolare possono essere suddivisi in: • aerobi obbligati. Attuano un metabolismo esclusivamente ossidativo (fig. 3.20) in cui i donatori del potere riducente (protoni ed elettroni) sono composti organici (glucidi, proteine, lipidi, ecc.), mentre l’accettore finale è l’O2. Gli aerobi obbligati possiedono sistemi enzimatici come la superossidodismutasi e la catalasi. Il primo converte l’anione superossido (O2) in perossido d’idrogeno (H2O2), mentre il secondo converte il perossido d’idrogeno in acqua; • aerobi (anaerobi) facoltativi. In presenza di O2 attuano la respirazione aerobica, mentre negli ambienti in cui l’O2 è carente, un metabolismo fermentativo (fig. 3.21). Per questa duplice possibilità, costituiscono un gruppo capace di adattarsi facilmente al mutare delle condizioni ambientali. Il donatore del potere riducente, in condizioni aerobiche e anaerobiche, è la sostanza organica; l’accettore in aerobiosi è l’O2, mentre in anaerobiosi è una molecola organica. Gli aerobi facoltativi possiedono la superossidodismutasi per eliminare l’O2– e la catalasi (in alternativa a questa, la perossidasi) per eliminare il perossido d’idrogeno; • aerotolleranti. Indipendentemente dalla presenza o meno di O2 attuano un metabolismo fermentativo (fig. 3.22). Il donatore di potere riducente è costituito dalla sostanza organica, mentre l’accettore finale è una sostanza organica presente lungo le vie metaboliche percorse. Eliminano l’anione superossido con la superossidodismutasi e il perossido d’idrogeno con la catalasi o la perossidasi; • anaerobi obbligati. Si riproducono in ambienti strettamente anaerobici (fig. 3.23). Non possiedono enzimi in grado di eliminare l’anione superossido e il perossido d’idrogeno. L’O2 ha un effetto microbicida nei confronti dei microrganismi appartenenti a questo gruppo. Com’è già stato indicato, gli aerobi obbligati, gli anaerobi facoltativi e gli aerotolleranti, indipendentemente dal tipo di metabolismo attuato, possiedono enzimi capaci di eliminare l’anione superossido e il perossido d’idrogeno, che si formano durante i processi metabolici. L’enzima in grado di eliminare l’anione superossido è la superossidodismutasi, che lo converte in perossido d’idrogeno (HO2); Capitolo 3. Le esigenze microbiche 13 FIGURA 3.20 ◗ I bacilli difterici sono tipici organismi aerobi obbligati. FIGURA 3.21 ◗ I saccaromiceti sono microrganismi dotati di un metabolismo aerobico facoltativo. FIGURA 3.22 ◗ Gli stafilococchi sono batteri aerotolleranti, in quanto il loro metabolismo è fermentativo sia in presenza, sia in assenza d’ossigeno molecolare. FIGURA 3.23 ◗ I clostridi sono bacilli tipicamente anaerobi obbligati. Crescono esclusivamente in ambienti a bassissimo potenziale redox. questo, in seguito, è trasformato dalla catalasi in acqua e ossigeno molecolare. Le due reazioni possono essere schematizzate in questo modo: 2O2– + 2H + Superossidodismutasi Catalasi H2 O2 + O2k Catalasi H2 O + O 2 k In alternativa alla catalasi, alcuni microrganismi aerotolleranti utilizzano la perossidasi, che è in grado di eliminare il perossido d’idrogeno riducendolo ad acqua. 2O –2 + 2H + Superossidodismutasi +H + Perossidasi H2 O2 + O2 + NADH + 2H 2 O + NAD+ I cosiddetti microaerofili meritano un discorso a parte. Questi microrganismi costituiscono un raggruppamento eterogeneo dal punto di vista enzimatico e metabolico; in ogni caso possiedono la caratteristica comune di crescere in ambiente caratterizzato da una bassa tensione d’ossigeno (2-5%) e, frequentemente, da elevate concentrazioni di CO2. Tra i microaerofili sono compresi gli streptococchi e le neisserie. TABELLA 3.7. Le principali categorie microbiche in rapporto alla presenza di ossigeno Categoria microbica Concentrazione di O2 richiesta Tipo di metabolismo Enzimi inattivanti O2– o H2O2 Aerobi obbligati Respirazione aerobica Alta Superossidodismutasi e catalasi Aerobi facoltativi Respirazione aerobica e fermentazione Indifferente Superossidodismutasi e catalasi o perossidasi Aerotolleranti Fermentazione Indifferente Superossidodismutasi e catalasi o perossidasi Anaerobi obbligati Fermentazione Assente Assenti 14 Le basi microbiologiche della Biochimica Nella coltivazione dei microrganismi è fondamentale che il potenziale ossidoriduttivo ambientale sia adatto al gruppo microbico che si sta ricercando. Per gli aerobi obbligati, gli aerobi facoltativi e gli aerotolleranti, la creazione di un ambiente idoneo in genere non presenta particolari problemi. Più difficoltosa è la coltivazione dei microaerofili e degli anaerobi obbligati, per i quali è necessario ricorrere all’impiego di sistemi di incubazione che forniscano un basso potenziale redox. In particolare per coltivare questi microrganismi si ricorre a terreni di coltura dotati di composti riducenti, come ad esempio la cisteina, e a contenitori per anaerobiosi (giara per anaerobi). La giara è un contenitore dotato di chiusura ermetica; in essa viene creato un ambiente anaerobico ricorrendo a reattivi che eliminano per via catalitica l’ossigeno contenuto (fig. 3.24). FIGURA 3.24 ◗ Contenitori per anaerobiosi. QUESITI DEL CAPITOLO 3 1) Per quali scopi sono coltivati i microrganismi? 2) Che cosa s’intende con il termine clone? 3) Quale composto biochimico svolge il ruolo di trasportatore intracellulare dell’energia? 4) Si evidenzino gli aspetti biochimici alla base della fotosintesi. 5) Quali elementi differenziano la fotosintesi ossigenica da quella anossigenica? 6) Si mettano in luce gli aspetti biochimici alla base del chemioautotrofismo. 7) Si definisca il chemioeterotrofismo (eterotrofismo). 8) Per quali aspetti si differenziano la respirazione aerobica, la fermentazione e la respirazione anaerobica? 9) Quali sono i principi nutrizionali occorrenti agli organismi fotoautotrofi? 10) Quali sono i principi nutrizionali occorrenti agli organismi chemioeterotrofi (eterotrofi)? 11) Si descriva la struttura della membrana cellulare. 12) Si illustrino le modalità con cui avviene il passaggio delle molecole attraverso la membrana. 13) Si descriva il modo con cui varia la velocità della crescita microbica in funzione della temperatura. 14) Quali sono le principali categorie microbiche in base alle diverse temperature di crescita? 15) Che cosa s’intende con i termini temperature eugenesiche e temperature disgenesiche? 16) In che cosa si differenziano i microrganismi criofili, mesofili e termofili? 17) Che cosa s’intende per pressione osmotica? 18) Quando si manifesta la plasmolisi nei microrganismi? 19) In che cosa si differenzia la plasmoptisi dalla plasmolisi? 20) Quali caratteristiche differenziano gli alofili dagli aloresistenti? 21) Si definisca l’Aw. 22) Si descriva il modo con cui varia la velocità della crescita microbica modificando il pH. 23) In che cosa si differenziano i microrganismi alcalofili, neutrofili e basofili? 24) Se sono forniti valori di pH diversi da quelli ottimali, quali effetti sono prodotti nella crescita di una specie microbica? 25) Quando la pressione osmotica ambientale è superiore o inferiore rispetto ai valori presenti all’interno di una cellula, quali eventi si producono? 26) Quali funzioni svolgono la catalasi e la perossidasi? 27) Si evidenzino le diverse categorie microbiche in rapporto al tipo di metabolismo energetico utilizzato ed all’influenza esercitata su di esse dall’ossigeno molecolare. 28) Che cosa s’intende con il termine potenziale redox? 29) In che modo i microrganismi sono in grado di eliminare l’anione superossido ed i perossidi?
Scaricare