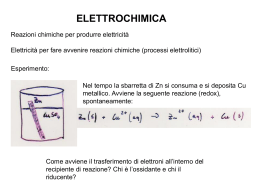
Binetti Vincenzo Merlanti Fabio 1.PILE 1.1 PILE: L’energia chimica si trasforma in energia elettrica ELETTRODI ELETTRODI SEMICELLE SEMICELLE 1.2. Cosa avviene nella pila? Cu ---> Cu2+ + 2 e(OSSIDAZIONE) Ag+ + e- ---> Ag (RIDUZIONE) 2 Ag+ + Cu ---> Cu2+ + 2 Ag ANODO (Polo NEGATIVO) ---> Ossidazione Perde elettroni Red 1 ---> Ox 1 + n e- CATODO (Polo POSITIVO) ---> Riduzione Acquista elettroni Ox 2 + n e- ---> Red 2 Cu / Cu2+ || Ag + / Ag (Catodo a destra) Rimangono in soluzione - + RAME ARGENTO Anodo Catodo NO3Ag+ Cu2+ NO3- 1.3. Qual è la funzione del ponte salino? IL RIEQUILIBRIO DELLE CARICHE - E’ costituito da un tubo di vetro a U rovesciato, riempito di una soluzione di elettroliti ( NaNO3 o KCL); - Gli ioni del ponte salino migrano in modo da neutralizzare le cariche che si vanno a formare nelle 2 celle; - Nel caso precedente gli anioni NO3- si sposteranno verso l’anodo per bilanciare la carica positiva che qui si produce, mentre gli ioni Na+ (del ponte) si sposteranno verso il catodo per bilanciare l’eccesso di ioni negativi che si vanno accumulando. 1.4.POTENZIALE DI RIDUZIONE E’ la potenza in volt che una coppia ossido-riduttiva riesce a fornire. Una coppia Red-Ox ha un potenziale di riduzione alto quando prevale la tendenza della specie ossidata ad acquistare elettroni, mentre è basso quello di una coppia in cui prevale la tendenza della specie ridotta a cederli. Non essendo possibile misurarlo in modo diretto per una coppia presa singolarmente, si supera il problema collegando due coppie in modo da ottenere una pila e misurando la differenza di potenziale (ddf). 1.5.DIFFERENZA DI POTENZIALE La differenza di potenziale di una pila, in condizioni di corrente zero ( circuito aperto), prende il nome di forza elettromotrice (fem o E) e viene misurata in volt. Per calcolare la ddf di un elettrodo vi è bisogno di un altro elettrodo di riferimento che abbia un valore definito e costante ---> L’ELETTRODO A IDROGENO 1.6.ELETTRODO A IDROGENO E’ costituito da un filo di platino ricoperto di platino in polvere (platino platinato), immerso in una soluzione di H+ 1 M e sul quale gorgoglia H2 gassoso alla pressione di 1 atm. Il valore convenzionale dell’elettrodo a idrogeno è 0,000 V. 1.7.Potenziali di Riduzione standard In una pila la coppia a potenziale più alto sottrae elettroni alla coppia a potenziale più basso e funziona da catodo. E = Ecatodo - Eanodo 1.8. L’evoluzione delle pile La prima pila fu creata nel 1796 da A. Volta; si trattava di una serie di dischi di rame e zinco impilati uno sull’altro e separati da cartone imbevuto di una soluzione di NaCl; ANODO (si ossida) : Zn ---> Zn2 + 2 e- CATODO (si riduce): (Rame solo conduttore ) 2 H+ + 2 e- ---> H2 Nel 1836 fu inventata la pila Daniell dall’omonimo chimico; si trattava di una pila costituita da un elettrodo di rame immerso nella soluzione del suo catione (ione positivo), in collegamento con un elettrodo di zinco, anch’esso immerso in una soluzione del proprio catione. ANODO: Zn ---> Zn2+ + 2 eCATODO: Cu2+ + 2 e- ---> Cu PILA DANIELL La pila a secco venne realizzata nel 1866 da G. Leclanchè. L’anodo è costituito da un contenitore di Zinco a contatto con MnO2, NH4Cl (cloruro di ammonio) e grafite, mentre il catodo è costituito da una barretta di grafite; Fornisce una ddp iniziale di circa 1,5 V, ma poi il voltaggio si abbassa per l’accumularsi di ammoniaca intorno alla grafite. Nelle pile alcaline ( che si ottengono usando KOH (idrossido di potassio) al posto di NH4Cl) il voltaggio si mantiene costante. Sono proprio di tipo alcalino le pile a bottone (Pile Mallory); in esse l’anodo è costituito da polvere di Zn e KOH; il catodo (in acciaio) è costituito da HgO e grafite. Le pile reversibili chiamate accumulatori sono quelle che possono essere ricaricate attraverso il passaggio di corrente continua; collegando i poli in senso opposto a quello della corrente prodotta dalla reazione spontanea, quindi il polo positivo con quello positivo e quello negativo analogamente. In un accumulatore al piombo l’anodo è costituito da piombo spugnoso e il catodo da polvere di PbO2 compressa in una griglia di piombo; il tutto immerso in una soluzione di acido solforico REAZIONE DI SCARICA: Pb + PbO2 + 2 So42- + 4H+ ---> 2PbSO4 + 2 H2O REAZIONE DI RICARICA : 2PbSO4 + 2 H2O ---> Pb + PbO2 + 2 So42- + 4H+ Nel 1980 è stata inventata la pila NiMH, un accumulatore costituito da nichel e idruri metallici, per M si intende un composto intermetallico del tipo LaNi5. Ancora più recente è la costruzioni di nuovi accumulatori, per dispostivi più leggeri, nei quali il catodo è costituito da un ossido di litio e manganese , ed è accoppiato ad un anodo di grafite e litio a composizione variabile. Queste hanno voltaggio intorno a 3-4 V in base al tipo di ossido usato. 2.ELETTROLISI L’Elettrolisi fu scoperta nel 1800: - Nicholson – Carlisle - H. Davy - M.Faraday ---> Teoria completa H.Davy M.Faraday - Invertite le polarità ---> ANODO (POSITIVO), CATODO (NEGATIVO) - Cationi verso polo negativo (Catodo) ---> Si riducono (acqistano elettroni) - Anioni verso polo positivo (Anodo) ---> Si ossidano (perdono elettroni) PILA ELETTROLISI CATODO ANODO CATODO ANODO REAZIONE Riduzione Ossidazione Riduzione Ossidazione SEGNO Positivo Negativo Negativo Positivo Riceve elettroni dal circuito esterno SI NO SI NO Manda elettroni al circuito esterno NO SI NO SI Elettroliti 1) 1) 1)Elettrolita Fuso (NaCl) 2)Soluzione Acquosa di NaCl 3)Soluzione Acquosa di Solfato di Sodio 2.1 NaCl (fuso) All’anodo: 2 Cl- ---> Cl2 + 2 eAl catodo: 2Na+ + 2 e- ---> 2 Na Reazione completa 2NaCl ---> 2Na + Cl2 Soluzioni acquose All’interno di soluzioni acquose sono presenti più specie chimiche, l’acqua e un sale in soluzione, per stabilire quale specie si ossida o si riduce bisogna tener presente che: se più specie possono ridursi, si riduce quella con potenziale di riduzione più alto. Se più specie possono ossidarsi si ossida quella con potenziale di riduzione più basso 2.2.Soluzione acquosa di NaCl Consideriamo 2 elettrodi di grafite all’interno di una soluzione di NaCl in acqua: Al catodo: possono ridursi sia l’acqua che il sodio, ma l’acqua ha potenziale di riduzione(-0.83 V) più alto di quello del sodio (- 2 ,73 V) quindi si riduce l’H2O 2 H2O + 2 e- ---> H2 + 2 OHAll’anodo: dovrebbe ossidarsi l’acqua visto il potenziale di riduzione più basso del cloruro ma dato che produrrebbe ossigeno e che questo fa difficoltà a formarsi su un elettrodo di grafite viene favorito lo sviluppo di cloro 2 Cl- ---> Cl2 + 2 e- 2.3.Soluzione acquosa di solfato di sodio Al catodo come nel caso precedente si riduce l’acqua 2 H20 + 2 e- ---> H2 + 2 OHAll’anodo le specie ossidabili sono l’anione solfato e l’acqua, nonostante l’acqua faccia difficoltà come prima a formare ossigeno su grafite ha un potenziale di riduzione nettamente inferiore (2.01 V del SO42- contro i 1.23 V dell’ H2O) dunque si ossida l’acqua 2 H20 ---> O2 + 4 H+ + 4 eLa reazione complessiva è: 2 H2O ---> 2 H2 + O2 Leggi di Faraday 1.La massa delle sostanze prodotte a ciascuno degli elettrodi è direttamente proporzionale alla quantità di elettricità che passa nella cella elettrolitica 2. 2.Le masse di sostanze diverse che si scaricano agli elettrodi al passaggio di una stessa quantità di elettricità stanno tra di loro in un rapporto uguale a quello tra le rispettive masse equivalenti Massa equivalente(ME) ME MM n MM= massa molare n= numero di elettroni scambiati La massa di una sostanza, pari alla massa equivalente, in grammi se si ossida o si riduce impegna una mole di elettroni Quindi: 1,602 ∙ 10-19 C ∙ e-1 ∙ 6.022 ∙ 1023 e = 96485 C (Farady(F)) Tenendo conto che Carica(coulomb) = Corrente(ampere) ∙ Tempo(secondi) m i t ME 96.485 m= massa in grammi di sostanza i= intensità di corrente in ampere t= tempo in secondi
Scaricare