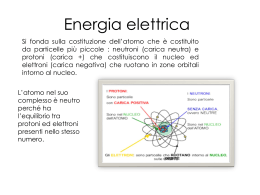
Conducibilità elettrica di una soluzione elettrolitica osservazioni interpretazione Esperimento per osservare come varia la conducibilità di una soluzione elettrolitica : acqua + acido o base o sale Lampadina o amperometro batteria anodo catodo Elettrodi mobili Cella con soluzione elettrolitica intensità La intensità della corrente aumenta con la concentrazione dell’elettrolita viceversa concentrazione catodo anodo intensità La intensità della corrente aumenta con l’aumentare della parte immersa degli elettrodi e viceversa Superficie immersa catodo anodo intensità La intensità della corrente varia con il variare della natura degli elettroliti a parità di altre condizioni A B Distanza,superficie,temperatura,concentrazioni costanti per due elettroliti diversi A,B catodo anodo intensità La intensità della corrente aumenta con l’aumentare della temperatura e viceversa temperatura catodo anodo intensità La intensità della corrente aumenta con il diminuire della distanza degli elettrodi e viceversa distanza catodo anodo Molecole di elettrolita neutro si trasfornano in ioni positivi e negativi I cationi (positivi) migrano verso il catodo(negativo) gli anioni (negativi) migrano verso l’anodo(positivo) I cationi acquistano elettroni dal catodo e si riducono (neutri) gli anioni cedono elettroni all’anodo e si ossidano (neutri) catodo anodo Elettrodi mobili Gli elettroni ceduti all’anodo vengono riportati al catodo per azione della batteria:il circuito si completa:dal catodo gli elettroni passano in soluzione riducendo i cationi; all’anodo gli elettroni vengono ricevuti dagli anioni e mediante la batteria sono restituiti al catodo catodo anodo Elettrodi mobili È evidente che la intensità della corrente (elettroni circolanti) circolante deve aumentare se aumenta il numero di ioni che interagiscono agli elettrodi se aumenta la superficie immersa perché favorisce la interazione contemporanea di più ioni con gli elettrodi se aumenta la temperatura perché aumenta la velocità e frequenza delle interazioni se diminuisce la distanza perché diminuisce il tempo impiegato per raggiungere gli elettrodi se cambia la natura degli elettroliti perché può variare il numero di molecole che si trasformano le cariche portate da ogni ione 100 AC > 60 A+ 60 C- 40 AC 100 AB > 100 A+ 100 B- 100 DF > 100 D++ 100 F-- È evidente che la intensità della corrente (elettroni circolanti) circolante deve aumentare se aumenta il numero di ioni che interagiscono agli elettrodi nello stesso tempo le interazioni sono più numerose nella soluzione più concentrata Ioni 1 > ioni 2 È evidente che la intensità della corrente (elettroni circolanti) circolante deve aumentare se aumenta la superficie immersa degli elettrodi perché aumenta il numero di ioni che contemporaneamente possono interagire S1 > S2 È evidente che la intensità della corrente (elettroni circolanti) circolante deve aumentare se aumenta la temperatura perché aumenta il numero di ioni che contemporaneamente possono interagire se aumenta la loro velocità nella migrazione T1 > T2 È evidente che la intensità della corrente (elettroni circolanti) circolante deve aumentare se diminuisce la distanza da percorrere per migrare agli elettrodi perché aumenta il numero di ioni che contemporaneamente possono interagire D1 < 1/D D2 1/D È evidente che la intensità della corrente (elettroni circolanti) circolante deve variare se varia il numero di molecole che si trasformano; se varia la carica per ogni ione prodotto se varia il numero di ioni per ogni molecola nA > 1/D nB 1/D Al catodo (negativo:riduzione) A+ A° All’anodo (positivo:ossidazione) B- B°
Scaricare