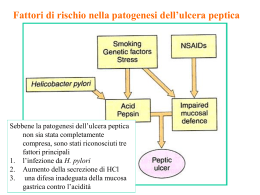
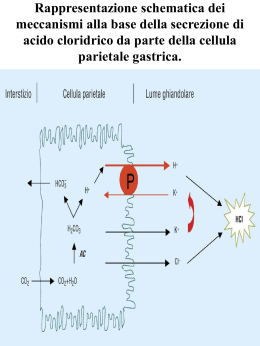
I FARMACI INIBITORI DELLA POMPA PROTONICA Dott. Fausto Turissini Indice del corso Introduzione Anatomia dello stomaco Localizzazione dello stomaco Forma dello stomaco Struttura macroscopica dello stomaco Vascolarizzazione dello stomaco Innervazione dello stomaco Istologia dello stomaco Aspetto macroscopico dello stomaco Struttura della parete dello stomaco Ghiandole dello stomaco Fisiologia dello stomaco Apparato gastro-intestinale Motilità e svuotamento gastrici e loro regolazione Secrezione gastrica Regolazione della secrezione gastrica Pompa protonica: H+/K+-ATPasi Secrezione gastrica acida Regolazione della secrezione gastrica acida Difese contro l’acidità dello stomaco Regolazione endocrina e paracrina della secrezione gastrica Condizioni patologiche correlate all’acidità gastrica Definizioni Malattia da reflusso gastro-esofageo (MRGE) Esofagite da reflusso Ulcera peptica: gastrica e duodenale Infezione da Helicobacter pylori Gastropatia erosiva associata a FANS 1 Sindrome di Zollinger-Ellison Dispepsia funzionale Dati epidemiologici Diagnosi Approccio terapeutico Farmaci per trattare i disturbi correlati all’acidità gastrica Farmaci antiacidi Farmaci antiulcera peptica e malattia da reflusso gastro-esofageo Prostaglandine Farmaci antagonisti del recettore istaminergico H2 Altri farmaci antiulcera peptica e malattia da reflusso gastro-esofageo I farmaci inibitori della pompa protonica Chimica Meccanismo d’azione Formulazioni farmaceutiche Farmacocinetica Effetti collaterali Avvertenze Interazioni farmacologiche Caratteristiche dei singoli principi attivi Esomeprazolo Lansoprazolo Omeprazolo Pantoprazolo Rabeprazolo Trattamenti alternativi per condizioni patologiche correlate all’acidità gastrica I consigli del farmacista 2 INTRODUZIONE Una breve introduzione circa le malattie acido-peptiche e i principali approcci terapeutici utilizzati per affrontarle. Le malattie acido-peptiche sono quei disturbi nei quali l’acido gastrico e la pepsina sono fattori patogenetici necessari, ma non solitamente sufficienti; infatti, sebbene intrinsecamente caustici, l’acido gastrico e la pepsina non causano danni né provocano sintomi a livello dello stomaco in condizioni normali, grazie alla presenza di meccanismi di difesa intrinseci. Le barriere al reflusso dei contenuti gastrici nell’esofago costituiscono la “difesa esofagea primaria”; se queste barriere protettive falliscono e si ha reflusso, possono verificarsi dispepsia e/o esofagiti erosive. In questi casi, le terapie sono dirette a diminuire l’acidità gastrica, ad aumentare il tono dello sfintere esofageo inferiore, o a stimolare la motilità esofagea. Lo stomaco è protetto da un certo numero di fattori, collettivamente definiti come “difesa mucosale”, molti dei quali sono stimolati dalla produzione locale di prostaglandine e ossido nitrico; se queste difese vengono meno, può formarsi un’ulcera gastrica o duodenale. Il trattamento e la prevenzione di questi disturbi acido-correlati sono attuati diminuendo l’acidità gastrica e aumentando la “difesa mucosale”. Il riconoscimento che un agente infettivo, l’Helicobacter pylori, gioca un ruolo chiave nella patogenesi delle malattie acido-peptiche ha determinato nuovi approcci per la prevenzione e la terapia. ANATOMIA DELLO STOMACO Una descrizione dell’apparato gastro-intestinale dal punto di vista anatomico, con particolare riferimento allo stomaco per quanto riguarda la sua localizzazione, forma, struttura macroscopica, vascolarizzazione e innervazione. Localizzazione dello stomaco Lo stomaco rappresenta il primo tratto addominale del tubo digerente, se si esclude il breve tratto addominale dell’esofago, e si presenta come una sacca dilatata asimmetricamente, che si espande prevalentemente sulla sinistra del piano di simmetria del corpo umano; esso è posto al di sotto del muscolo diaframma e occupa le seguenti regioni della cavità addominale: l’ipocondrio sinistro [IPOCONDRIO = regione superiore e laterale (destra o 3 sinistra) dell’addome] e l’epigastrio [EPIGASTRIO = regione superiore e centrale dell’addome]. Anteriormente lo stomaco è coperto per circa due terzi dal lobo sinistro del fegato, mentre nel terzo inferiore è a contatto con la parete addominale; posteriormente è in rapporto con il diaframma, il pancreas, e, a sinistra, con il rene, il surrene e la milza; il colon trasverso e la flessura sinistra dello stesso prendono rapporto con la grande curvatura dello stomaco, mentre la piccola curvatura si collega alla faccia inferiore del fegato. Lo stomaco è un organo intraperitoneale [PERITONEO = membrana sierosa estesa, che riveste le pareti delle cavità addominale e pelvica, dalle quali si riflette per avvolgere o ricoprire, a gradi diversi, i visceri di queste cavità; la superficie interna libera della membrana è rivestita da un singolo strato di cellule mesoteliali appiattite e secerne un fluido sieroso, permettendo così il libero movimento dei visceri e fra i visceri e lo strato parietale], compreso entro due foglietti sierosi che, a livello della piccola curvatura, continuano fino alla faccia inferiore del fegato, formando il legamento gastro-epatico; a livello della grande curvatura, la membrana sierosa collega lo stomaco al colon, mediante il legamento gastro-colico, e alla milza, mediante il legamento gastro-lienale. Forma dello stomaco Pur essendo, a digiuno, appiattito in senso antero-posteriore e a cavità virtuale, lo stomaco ha una capacità media di circa 1200 ml, è lungo circa 30 cm, e ha un diametro trasverso di circa 5-10 cm. La forma è a sacca conica, incurvata, con base cupoliforme in alto e a sinistra, e apice ristretto in basso e a destra; la forma è notevolmente modificabile, in rapporto con la posizione corporea, la costituzione individuale, le abitudini alimentari, lo stato psicofisico. È inoltre caratterizzato da due tipiche curvature, la piccola curvatura e la grande curvatura, a livello delle quali la faccia anteriore e la faccia posteriore dello stomaco passano l’una nell’altra. Struttura macroscopica dello stomaco Lo stomaco è costituito da quattro parti principali: il Cardias, il fondo, il corpo e la parte pilorica. Il Cardias rappresenta il tratto di comunicazione con l’esofago. Il fondo è costituito dalla base cupoliforme e si appoggia al diaframma, sopravanzando il Cardias sulla sinistra. Un piano trasverso passante per il Cardias segna il limite superiore del corpo, che si estende verso il basso, incurvandosi medialmente e restringendosi. La parte pilorica è l’ultimo tratto, che piega verso l’alto e termina restringendosi in un canale cilindrico di pochi 4 centimetri, che prosegue con il duodeno: il primo tratto leggermente rigonfio della parte pilorica costituisce l’antro pilorico, a cui fa seguito il canale pilorico. Vascolarizzazione dello stomaco Lo stomaco presenta una ricca vascolarizzazione sanguigna. Esso è vascolarizzato dall’arteria gastrica sinistra (ramificazione dell’arteria celiaca, che è un importante ramo viscerale dell’arteria aorta addominale) e da ramificazioni sia dell’arteria gastro-epatica che dell’arteria gastro-lienale (entrambe ulteriori ramificazioni dell’arteria celiaca). Le vene che portano invece il sangue refluo dell’apparato digerente confluiscono nella Vena Porta la quale, invece di aprirsi nella Vena Cava inferiore, penetra nel fegato convogliando sangue ricco di prodotti dell’assorbimento; dal fegato emergono le vene sovra-epatiche, che riportano il sangue, modificato dalla funzionalità epatica, nella Vena Cava inferiore o ascendente, la quale sfocia poi nell’atrio destro del cuore. Nel dettaglio, le vene reflue dallo stomaco fanno capo più o meno direttamente alla Vena Porta e al plesso periesofageo. Lo stomaco presenta anche una ricca vascolarizzazione linfatica: numerosi sono infatti i vasi linfatici e i gruppi di linfonodi annessi. Tutti i vasi linfatici confluiscono in due tronchi rappresentati dal dotto toracico e dal dotto linfatico destro, che riversano la linfa alla confluenza della Vena Giugulare interna con la Vena Succlavia, rispettivamente a sinistra e a destra. Il tronco intestinale porta la linfa dell’intestino, dello stomaco, del pancreas, della milza e del fegato, e fa capo alla cosiddetta cisterna del chilo, una dilatazione ampollare da cui ha poi origine il dotto toracico, che garantisce il ritorno della linfa al circolo venoso. Innervazione dello stomaco Il Sistema Nervoso si suddivide in Centrale, costituito dall’encefalo e dal midollo spinale, e Periferico, formato da nervi, gangli, e anche dispositivi recettoriali sensoriali: il Sistema Nervoso Centrale è connesso alla periferia tramite il Sistema Nervoso Periferico. Il Sistema Nervoso Simpatico è quella parte del Sistema Nervoso Periferico che esercita la sua azione prevalente a livello dei visceri: poiché le sue attività sfuggono in gran parte al controllo della volontà è stato anche denominato Sistema Nervoso Autonomo. Esso può essere suddiviso in ortosimpatico e parasimpatico, differenti sia dal punto di vista anatomico che funzionale (l’ortosimpatico è un sistema che tende a stimolare le funzioni e lo sviluppo di energia, mentre il parasimpatico è un sistema che tende a favorire l’economia energetica e l’anabolismo). La maggior parte dei visceri riceve una doppia innervazione effettrice, sia ortosimpatica che parasimpatica, con azione tra loro antagonista; vi può 5 tuttavia essere anche azione sinergica dei due sistemi; alcuni organi infine ricevono invece solo fibre post-gangliari ortosimpatiche. Per quanto riguarda specificatamente lo stomaco, l’innervazione di tipo ortosimpatico è garantita dal plesso celiaco, mentre quella di tipo parasimpatico è fornita dai nervi vaghi, i quali stimolano la peristalsi, la secrezione ghiandolare e il rilasciamento degli sfinteri. Si riconoscono due plessi nella tonaca muscolare e nella tonaca sottomucosa, che controllano sia l’attività motoria che quella secretiva dello stomaco: il plesso mioenterico di Auerbach e il plesso sottomucoso di Meissner. Essi rappresentano due reti nervose principali, che costituiscono l’innervazione intrinseca dell’apparato gastro-intestinale, e che nel loro insieme formano il Sistema Nervoso Enterico, il quale è collegato con il Sistema Nervoso Centrale tramite fibre simpatiche e parasimpatiche, ma è in grado pure di funzionare autonomamente. ISTOLOGIA DELLO STOMACO Una descrizione dello stomaco dal punto di vista istologico, con particolare riferimento al suo aspetto macroscopico, alla struttura della sua parete e alle ghiandole che vi si possono trovare. Aspetto macroscopico dello stomaco La superficie interna dello stomaco è roseo-grigiastra e diventa rossa durante la digestione per il maggior apporto sanguigno. A organo vuoto, lo stomaco presenta grossolane pieghe a prevalente decorso longitudinale. Queste pieghe scompaiono con il riempimento e la distensione dell’organo che, in questo stato, mostra la superficie mucosa finemente disegnata da sottili solchi permanenti, che delimitano piccole aree in rilievo dette areole gastriche, le quali mostrano numerose minute infossature dette fossette gastriche, sul cui fondo si aprono le ghiandole intramurali dello stomaco. A livello pilorico, la parete si solleva in una piega circolare, detta valvola pilorica, all’interno della quale lo strato circolare della tonaca muscolare forma lo sfintere pilorico; a tale livello si colloca l’orifizio che fa comunicare lo stomaco con il duodeno, che è il primo tratto dell’intestino tenue. 6 Struttura della parete dello stomaco Lo stomaco presenta una parete costituita, dall’esterno verso l’interno (lume), dalla tonaca sierosa, dalla tonaca muscolare, dalla tonaca sottomucosa, dalla muscolaris mucosae, dalla lamina propria connettivale e dalla tonaca mucosa. La tonaca sierosa è rappresentata dal peritoneo viscerale, e aderisce alla sottostante tonaca muscolare per mezzo di un sottile strato di tessuto connettivo lasso sottosieroso [TESSUTO CONNETTIVO = tessuto formato da cellule e matrice intercellulare, matrice che a sua volta è costituita da fibre e da una parte amorfa detta “sostanza fondamentale”. TESSUTO CONNETTIVO LASSO = tessuto connettivo con abbondante “sostanza fondamentale”]. La tonaca muscolare è assai sviluppata e risulta costituita da muscolatura liscia orientata diversamente: uno strato obliquo, presente in corrispondenza del fondo e che si sfiocca a ventaglio a livello dei due strati successivi nelle altre regioni; uno strato longitudinale, esteso soprattutto a livello delle curvature; e uno strato circolare di fibrocellule, che a livello pilorico forma lo sfintere. Nel suo spessore è presente un plesso nervoso, il plesso mioenterico di Auerbach, interessato principalmente al controllo motorio. La tonaca sottomucosa è formata da tessuto connettivo lasso, e contiene il plesso sottomucoso di Meissner, interessato in primo luogo al controllo della secrezione. La tonaca mucosa presenta un epitelio cilindrico o batiprismatico semplice [EPITELIO CILINDRICO O BATIPRISMATICO SEMPLICE = epitelio formato da cellule piuttosto alte, con abbondante citoplasma, e nucleo situato per lo più verso il polo profondo; per la sua struttura si presta a molteplici funzioni, quali: protezione degli strati sottostanti, capacità di assorbimento di sostanze dall’ambiente esterno, capacità di secrezione di sostanze nell’ambiente esterno], le cui cellule elaborano materiale mucoso neutro, che si stratifica alla superficie interna dell’organo con funzione protettiva nei confronti del succo gastrico acido; a livello del Cardias, una sottile linea frastagliata segna il brusco passaggio dalla mucosa esofagea a quella gastrica, con un cambiamento netto nella struttura dell’epitelio. L’epitelio appoggia sopra una spessa lamina propria di tessuto connettivo lasso, che ospita numerose ghiandole intramurali, fittamente stipate soprattutto in corrispondenza del fondo e del corpo. Al di sotto della lamina propria è presente una muscolaris mucosae, costituita da muscolatura liscia, in due strati, la cui contrazione facilita l’espulsione del secreto ghiandolare. 7 Ghiandole dello stomaco Le ghiandole sono formazioni, generalmente di derivazione epiteliale, specializzate nella sintesi e nella liberazione di una vasta gamma di sostanze; esistono casi di ghiandole unicellulari, ma più comunemente sono pluricellulari, consistendo di associazioni di più cellule secernenti che talvolta raggiungono dimensioni notevoli. Le ghiandole esocrine versano i loro prodotti di secrezione all’esterno del corpo umano oppure all’interno di organi cavi attraverso i condotti escretori; possono essere interamente comprese nella parete dell’organo cui sono annesse (ghiandole intramurali) oppure possono trovarsi all’esterno della parete dell’organo cui sono congiunte tramite un sistema di condotti escretori (ghiandole extramurali); più frequentemente la porzione escretrice (il sistema dei dotti) è strutturalmente e funzionalmente differente dalla porzione secernente (il sistema degli adenomeri). Si classificano sulla base della conformazione del condotto escretore e della forma degli adenomeri, che possono essere tubulari, acinosi, o alveolari; le ghiandole semplici sono provviste di un unico condotto escretore, che drena il secreto di uno o più adenomeri e in quest’ultimo caso si parla di ghiandole semplici ramificate; le ghiandole composte sono formate da un gran numero di adenomeri e di condotti escretori, i quali confluiscono in uno o, più raramente, due condotti escretori principali. La mucosa gastrica contiene molte ghiandole profonde. Le ghiandole dello stomaco differiscono nelle diverse regioni, e vengono così distinte ghiandole cardiali, ghiandole piloriche e ghiandole gastriche propriamente dette. Le ghiandole cardiali occupano un’area limitata a livello della regione del Cardias; sono ghiandole tubulari composte, a secrezione mucosa neutra. Le ghiandole piloriche si aprono sul fondo delle fossette gastriche della regione pilorica; sono ghiandole tubulari semplici ramificate, a secrezione mucosa neutra. Le ghiandole gastriche occupano la lamina propria della mucosa delle regioni del corpo e del fondo dello stomaco e sono le più numerose e fittamente stipate; sono ghiandole tubulari semplici, che si aprono nel fondo delle fossette gastriche. Sono caratterizzate da diversi tipi cellulari, distribuiti variamente nel tubulo. Le cellule parietali (o oxintiche, o di rivestimento, o delomorfe) elaborano acido cloridrico e fattore intrinseco e predominano nella parte media del tubulo. Esse sono facilmente identificabili nei preparati istologici per l’intensa colorazione che assumono, per la forma arrotondata, e per i contorni molto netti. A livello ultrastrutturale presentano profonde invaginazioni della membrana cellulare, con funzione di capillari di secrezione intracellulari: in questi capillari viene secreto l’acido cloridrico, che poi è riversato nel lume del tubulo 8 ghiandolare. Le cellule parietali producono anche il fattore intrinseco antianemico, che facilita l’assorbimento della vitamina B12. Le cellule principali (o zimogene, o peptiche, o adelomorfe) secernono pepsinogeno, che viene successivamente attivato a pepsina che è un enzima proteolitico, e lipasi gastrica, e sono distribuite soprattutto nel fondo del tubulo. Sono anche dette adelomorfe in quanto non mostrano limiti cellulari netti al microscopio ottico. A livello ultracellulare posseggono uno sviluppato reticolo endoplasmatico granulare. Le cellule entero-cromaffini-simili secernono istamina e sono disperse nella parete tubulare. FISIOLOGIA DELLO STOMACO Una descrizione dell’apparato gastro-intestinale dal punto di vista fisiologico, con particolare riferimento allo stomaco per quanto riguarda la sua motilità, il suo svuotamento e la sua attività secretiva, con le rispettive regolazioni, concentrando infine l’attenzione sulla pompa protonica, la secrezione acida dello stomaco, il suo processo di regolazione e la descrizione delle difese intrinseche gastriche nei confronti dell’acidità. Apparato gastro-intestinale L’apparato gastro-intestinale è essenzialmente un tubo che si estende dall’orifizio buccale a quello anale; nell’ordine si incontrano: la bocca, l’esofago, lo stomaco, il duodeno, il digiuno, l’ileo, il cieco, il colon, il retto e l’ano. La sua funzione primaria è quella di fungere da via d’ingresso alle sostanze nutritive e ai liquidi, che così possono essere assorbiti dal corpo umano. Per favorirne l’assorbimento, il cibo viene mescolato con le numerose secrezioni prodotte dalle cellule della mucosa della parete gastro-intestinale e dalle ghiandole (quali quelle salivari, la colecisti e il pancreas) che vi riversano il proprio secreto. Contemporaneamente, le differenti forme di contrattilità dell’apparato gastro-intestinale favoriscono il rimescolamento e la progressione del cibo lungo il canale alimentare. Questo è funzionalmente suddiviso in segmenti per la presenza di sfinteri, che ottimizzano i processi di digestione e di assorbimento; vi sono gli sfinteri esofagei superiore e inferiore, lo sfintere pilorico che ritarda lo svuotamento dello stomaco, la valvola ileocecale che trattiene il contenuto colico nell’intestino crasso, e gli sfinteri anali interno ed esterno. 9 Al termine di tutto questo processo, i residui alimentari non digeriti, assieme ai detriti cellulari e ai prodotti liposolubili del catabolismo secreti nella bile invece che nell’urina vengono espulsi dall’organismo. Nel complesso, queste funzioni risultano essere strettamente regolate, in accordo con l’assunzione di cibo. Motilità e svuotamento gastrici e loro regolazione Quando il cibo entra nello stomaco, il fondo e la parte superiore del corpo si rilasciano per ricevere il materiale, con scarso o nullo aumento della pressione; questo processo, detto rilasciamento recettivo, è mediato dal nervo vago ed evocato dal movimento della faringe e dell’esofago. La peristalsi inizia nella porzione inferiore del corpo, mescolando e frantumando gli alimenti e permettendo alle particelle piccole e semiliquide di passare, attraverso il piloro, nel duodeno. La contrazione della porzione distale dello stomaco provocata da ciascuna onda peristaltica è chiamata anche sistole antrale e può protrarsi fino a 10 secondi, mentre le onde peristaltiche hanno una frequenza di 3-4 per minuto. Nella regolazione dello svuotamento gastrico, l’antro, il piloro e la parte prossimale del duodeno si comportano apparentemente come un’unità funzionale: la contrazione dell’antro è seguita dalla contrazione sequenziale della regione pilorica e del duodeno. Nell’antro, la contrazione parziale a valle del contenuto gastrico, che sta avanzando, impedisce che nel duodeno entri materiale solido, che viene qui triturato e rimescolato; il contenuto gastrico più liquido viene invece spruzzato nell’intestino tenue in piccole quantità. Di norma non si ha rigurgito dal duodeno, perché la contrazione del segmento pilorico tende a persistere un po’ più a lungo di quella del duodeno; tale reflusso è forse evitato anche per effetto dell’azione stimolante sullo sfintere pilorico della colecistochinina e della secretina. La velocità alla quale lo stomaco si svuota nel duodeno dipende dalla natura del pasto: un pasto ricco di glucidi abbandona lo stomaco in poche ore, un po’ più lentamente un pasto ricco di proteine, e più lentamente ancora un pasto ricco di lipidi. La velocità di svuotamento inoltre dipende dalla pressione osmotica del materiale che entra nel duodeno: l’iperosmolarità del contenuto duodenale è recepita da osmo-recettori duodenali, che rallentano lo svuotamento gastrico probabilmente attraverso un meccanismo di origine nervosa. Infine è da segnalare che, nel duodeno, la presenza di lipidi, carboidrati e acidi inibisce la motilità gastrica e la secrezione di acido e di pepsina attraverso meccanismi nervosi e ormonali; responsabile di tale effetto è probabilmente il peptide YY, ma anche la colecistochinina risulta implicata nel controllo dello svuotamento gastrico. 10 Secrezione gastrica La secrezione gastrica giornaliera aggiunge al contenuto intestinale circa 2,5 litri; tuttavia, nonostante il ragguardevole volume e il fine controllo, le secrezioni gastriche non sono indispensabili ai fini della completa digestione e dell’assorbimento di un pasto, fatta eccezione per l’assorbimento di vitamina B12. Questo illustra un aspetto importante della fisiologia gastro-intestinale: cioè che le capacità digestive e di assorbimento sono ampiamente in eccesso rispetto al fabbisogno normale; d’altra parte, se la secrezione gastrica venisse cronicamente ridotta, gli individui potrebbero manifestare maggiore suscettibilità alle infezioni acquisite per via orale. Al cibo ingerito si aggiunge pertanto un significativo volume di succhi digestivi. Analogamente a quanto avviene per la secrezione salivare, durante la cosiddetta fase cefalica della secrezione, che può essere influenzata dalle abitudini alimentari, lo stomaco si predispone a ricevere il pasto ancor prima che lo stesso sia effettivamente ingerito; successivamente interviene la fase gastrica della secrezione, che è quantitativamente la più significativa; infine subentra la fase intestinale, quando il cibo lascia lo stomaco. Ogni fase è strettamente regolata da stimoli locali e a distanza. Le secrezioni gastriche sono prodotte sia dalle ghiandole ubicate nella parete dello stomaco, che si svuotano nel suo lume, che dalle cellule mucose superficiali, che secernono soprattutto muco e bicarbonato, per proteggere lo stomaco dall’autodigestione, e sostanze note come peptidi a trifoglio, in grado di stabilizzare lo strato di muco e bicarbonato. Le secrezioni ghiandolari dello stomaco differiscono nelle diverse regioni gastriche; il corpo secerne prevalentemente muco, pepsinogeno e acido cloridrico, mentre l’antro secerne prevalentemente muco, pepsinogeno e gastrina. A digiuno, il contenuto del succo gastrico normale risulta costituito da: • cationi: sodio (Na+), potassio (K+), magnesio (Mg2+) e idrogeno (H+); • anioni: cloruro (Cl-), idrogeno fosfato (HPO42-) e solfato (SO42-); • pepsine; • lipasi; • muco; • fattore intrinseco. L’acido svolge funzione antibatterica nei confronti del cibo e favorisce l’idrolisi delle macromolecole alimentari. Il pepsinogeno è il precursore della pepsina, che viene attivata in presenza di acido cloridrico e avvia la digestione delle proteine e dei polipeptidi, staccando legami peptidici adiacenti ad aminoacidi aromatici; esistono diversi tipi di 11 pepsinogeni e di relative pepsine. La lipasi gastrica inizia invece la digestione dei grassi alimentari, specificatamente dei trigliceridi, che vengono scissi in glicerolo e acidi grassi. Il fattore intrinseco è importante infine per il successivo assorbimento della vitamina B12. Regolazione della secrezione gastrica Tre sono i principali stimoli responsabili della secrezione gastrica e ciascuno svolge un ruolo specifico nell’adeguare l’entità della secrezione alle richieste funzionali. La gastrina è l’ormone secreto dalle cellule G dell’antro gastrico, sia in risposta a uno specifico neurotrasmettitore rilasciato dalle terminazioni nervose enteriche noto come peptide liberante la gastrina (GRP), sia in presenza di altri fattori. Attraverso il circolo, la gastrina raggiunge le ghiandole del fondo, legandosi ai recettori di membrana non solo delle cellule parietali (e, verosimilmente, di quelle principali) per stimolarne la secrezione, ma anche a quelli delle cosiddette cellule entero-cromaffini-simili presenti all’interno delle ghiandole e responsabili della secrezione di istamina. L’istamina, secreta appunto dalle cellule entero-cromaffini-simili, rappresenta un altro stimolo secretorio efficace, legandosi ai recettori istaminergici H2 delle cellule parietali. Infine, le cellule parietali e principali possono anche essere stimolate dall’acetilcolina rilasciata dalle terminazioni nervose enteriche nel fondo dello stomaco. Durante la fase cefalica, la secrezione gastrica è prevalentemente indotta da impulsi vagali, che originano dal cosiddetto complesso vagale dorsale, nel bulbo, sede di coordinazione di impulsi provenienti dai centri nervosi superiori. Le efferenze vagali allo stomaco determinano il rilascio di peptide liberante la gastrina e di acetilcolina, inducendo così l’attività secretoria. Ulteriori segnali in grado di stimolare significativamente l’entità della secrezione, prima che il cibo entri nello stomaco, sono scarsi, fatto che limita l’entità della secrezione stessa. Durante la fase gastrica, una volta ingerito, il cibo o i suoi componenti inducono un marcato rilascio di gastrina, e la presenza stessa del cibo distende le pareti gastriche attivando recettori da stiramento che provocano una risposta “vago-vagale” e anche riflessi locali, i quali stimolano ulteriormente la secrezione. La presenza del cibo è anche in grado di tamponare l’acidità gastrica, che altrimenti fungerebbe da segnale per un controllo a retroazione inibitorio in grado di bloccare la secrezione tramite la liberazione di somatostatina da parte delle cellule D-simili dell’antro. La somatostatina inibisce la funzione delle cellule G e delle cellule entero-cromaffini-simili, come pure la secrezione delle stesse cellule parietali: è questo probabilmente un meccanismo chiave, tramite il quale la secrezione gastrica viene inibita, allorché il pasto passa dallo stomaco nell’intestino tenue. 12 Pompa protonica: H+/K+-ATPasi La secrezione di acido nello stomaco avviene per azione della H+/K+-ATPasi. Essa è una pompa protonica, che in fase attiva è situata nella membrana della cellula parietale, a livello del versante cellulare apicale. Essa scambia, tramite trasporto attivo, contro gradiente di concentrazione, ioni idrogeno (H+) e ioni potassio (K+), in uno scambio elettricamente neutro, attraverso la membrana della cellula stessa. Spostando gli ioni idrogeno (H+) dal citoplasma allo spazio extracellulare, cioè nel lume dello stomaco, essa genera un incredibile gradiente protonico. È difficile ottenere il prodotto della secrezione delle cellule parietali puro e non contaminato da altre secrezioni gastriche, ma i campioni più puri analizzati presentano a livello intra-canalicolare un pH di circa 0,8; se si tiene conto che il pH citoplasmatico delle cellule parietali è compreso, come quello di altre cellule, tra 7,00 e 7,30, e il pH del plasma degli individui sani è mantenuto, entro stretti limiti, tra 7,35 e 7,45, si può avere un’idea dell’enorme gradiente di concentrazione contro cui la H+/K+-ATPasi trasporta gli ioni idrogeno (H+). Esso è il più grande gradiente ionico conosciuto nei Vertebrati. A causa dell’insolito compito di secernere acido concentrato, le cellule parietali presentano un elevato livello di specializzazione; esse sono infatti ricche di mitocondri, necessari per garantire il fabbisogno energetico per l’attivazione della H+/K+-ATPasi. L’ATPasi infatti fornisce l’energia per il trasporto attivo, tramite l’idrolisi dell’ATP e quindi, per la secrezione acida, è necessario un rapido rifornimento di ATP. La H+/K+-ATPasi è omologa in sequenza alla Na+/K+-ATPasi e alla Ca2+-ATPasi e ha una disposizione simile nelle sue eliche transmembrana; inoltre, al pari degli altri due trasportatori citati, essa viene fosforilata durante il suo ciclo catalitico e si inter-converte tra due conformazioni principali. Secrezione gastrica acida La secrezione gastrica acida è un processo complesso e continuo, nel quale fattori multipli centrali e periferici contribuiscono a un comune obiettivo: la secrezione di ioni idrogeno (H+) da parte delle cellule parietali gastriche. A riposo, le cellule parietali presentano dei canalicoli intracellulari, che si aprono sulla superficie apicale della membrana cellulare, e delle pompe protoniche, segregate in numerosi compartimenti di membrana intra-citoplasmatici noti come strutture tubulovescicolari. Vi sono prove che la H+/K+-ATPasi, in condizioni di riposo, sia sintetizzata nelle strutture tubulo-vescicolari. 13 Quando la cellula parietale viene attivata, le strutture tubulo-vescicolari si fondono con le invaginazioni della membrana cellulare apicale, i cosiddetti canalicoli che dal lume penetrano in profondità nella cellula, e microvilli si proiettano nei canalicoli cosicché l’area della membrana cellulare a contatto con il lume gastrico aumenta notevolmente; ciò favorisce il posizionamento delle pompe protoniche sulla superficie della membrana per dare inizio alla secrezione acida. Esaminando nel dettaglio i processi di scambio ionico, nel citoplasma della cellula parietale, gli ioni idrogeno (H+) vengono generati dall’attivazione dell’anidrasi carbonica di tipo II, che produce ioni idrogeno (H+) e ioni bicarbonato (HCO3-), partendo da anidride carbonica (CO2) e acqua (H2O); la scorta di anidride carbonica (CO2) è assicurata sia dal liquido interstiziale che dal metabolismo cellulare. Nella membrana cellulare della cellula parietale a livello apicale vi sono inoltre canali per il potassio, necessari al movimento di ioni potassio (K+), e canali per i cloruri, necessari per il passaggio di ioni cloruro (Cl-) e per la formazione e secrezione di acido cloridrico (HCl) nel lume gastrico. La secrezione degli ioni idrogeno (H+) così prodotti, in scambio con ioni potassio (K+) mediante la H+/K+-ATPasi, è infine accompagnata dal rilascio nel sangue di un numero equivalente di ioni bicarbonato (HCO3-), attraverso la membrana cellulare della cellula parietale a livello baso-laterale, mediante fusione di vescicole o tramite lo scambiatore ioni cloruro/ioni bicarbonato. Pertanto il sangue proveniente dallo stomaco è alcalino e ha un elevato contenuto in ioni bicarbonato (HCO3-); quando, dopo un pasto, la secrezione gastrica acida è elevata, può essere secreta nello stomaco una quantità di ioni idrogeno (H+), e quindi nel sangue una quantità di ioni bicarbonato (HCO3-) sufficiente ad aumentare il pH del sangue sistemico e a rendere le urine alcaline, fatto che probabilmente spiega l’elevato pH delle urine escrete dopo un pasto, la cosiddetta marea alcalina postprandiale. Regolazione della secrezione gastrica acida Fattori endocrini (la gastrina), paracrini (l’istamina) e neuronali (l’acetilcolina) regolano insieme la secrezione gastrica acida. I tre agonisti (gastrina, istamina e acetilcolina) delle cellule parietali nel fondo e nel corpo dello stomaco si legano a specifici recettori disposti sul versante baso-laterale della membrana cellulare: i recettori colecistochininici CCK-B o CCK2 per la gastrina, i recettori istaminergici H2 per l’istamina e i recettori muscarinici M3 per l’acetilcolina. Alcuni di questi recettori sono anche presenti sulle cellule entero-cromaffinisimili, dove regolano il rilascio di istamina. La gastrina e l’acetilcolina promuovono la secrezione gastrica acida innalzando la concentrazione di calcio libero nel citoplasma; entrambe agiscono legandosi a recettori che 14 sono accoppiati alla proteina G, i quali attivano nelle cellule parietali il meccanismo GqPLC(fosfolipasi C)-IP3(inositolo trifosfato)-Ca2+. L’istamina promuove invece la secrezione gastrica acida innalzando la concentrazione intracellulare di adenosin-3’-5’-monofosfato ciclico (AMP ciclico): il recettore istaminergico H2 è anch’esso accoppiato a una proteina G, ma attiva nelle cellule parietali il meccanismo Gs-adenilil ciclasi-AMP ciclico-PKA (protein chinasi A). [RECETTORE ACCOPPIATO ALLA PROTEINA G = recettore che attraversa la membrana cellulare come un fascio di sette α-eliche; gli esseri umani esprimono oltre 800 tipi di questi recettori, che sono coinvolti nella percezione sensoriale e regolano un notevole numero di funzioni fisiologiche; tra i leganti di questi recettori si annovera un numero molto elevato ed eterogeneo di sostanze; a causa del loro numero e della loro importanza fisiologica, essi sono bersaglio per molti farmaci; esistono molteplici sottotipi di recettori e, quando i leganti selettivi non sono conosciuti, i recettori sono più comunemente definiti come isoforme, piuttosto che come sottotipi; essi si accoppiano a una famiglia di proteine di natura regolatoria, eterotrimeriche (subunità α, β, γ), leganti GTP, chiamate “proteine G”, che sono trasduttori del segnale, cioè trasmettono l’informazione che l’agonista è legato al recettore dal recettore stesso a una o più proteine effettrici, che includono enzimi e canali ionici di membrana; la famiglia di proteine G è costituita da 23 subunità α, 7 subunità β e 12 subunità γ; le subunità α rientrano poi in quattro possibili famiglie (Gs, Gi, Gq, e G12/13), che sono responsabili di accoppiare i recettori a tipi di effettori relativamente differenti]. Nelle cellule parietali, l’effetto netto di questi secondi messaggeri è quello di attivare la H+/K+-ATPasi. Queste due vie distinte di attivazione, attraverso differenti secondi messaggeri, sono sinergiche, con un effetto più che additivo sui livelli di secrezione, quando istamina e gastrina o istamina e acetilcolina o tutti e tre gli agonisti sono contemporaneamente presenti. Il significato fisiologico di questa sinergia risiede nel fatto che alti livelli di secrezione possono essere raggiunti tramite variazioni relativamente limitate della disponibilità di ciascuno stimolo. Tale sinergia assume anche significato terapeutico, in quanto la secrezione può essere notevolmente inibita, bloccando l’azione di uno solo dei fattori attivanti (più comunemente l’istamina, mediante l’uso di antagonisti del recettore istaminergico H2, utilizzati nelle terapie dirette a contrastare gli effetti negativi di una eccessiva secrezione gastrica acida). La gastrina è il più potente induttore della secrezione gastrica acida; stimola tale secrezione indirettamente, inducendo il rilascio di istamina da parte delle cellule entero-cromaffinisimili, e direttamente, agendo sulle cellule parietali con un’azione che tuttavia gioca un ruolo minore. La somatostatina inibisce la secrezione gastrica acida: un’acidificazione del 15 pH del lume gastrico a un valore inferiore a 3 stimola il rilascio di somatostatina, che sopprime il rilascio di gastrina con un meccanismo a feedback negativo. Le cellule secernenti somatostatina sono ridotte nei pazienti affetti da infezione da Helicobacter pylori, e la conseguente riduzione dell’effetto inibitorio potrebbe contribuire all’eccessiva produzione di gastrina. L’istamina gastrica è prodotta dalle cellule entero-cromaffini-simili, che sono solitamente in stretta prossimità delle cellule parietali; l’istamina agisce quindi come un mediatore paracrino, diffondendo dal proprio sito di rilascio verso le vicine cellule parietali, dove attiva i recettori istaminergici H2. Le più importanti strutture del Sistema Nervoso Centrale per la stimolazione della secrezione gastrica acida sono il nucleo motore dorsale del nervo vago, l’ipotalamo, e il nucleo del tratto solitario; fibre efferenti, che originano dai nuclei motori dorsali, scendono verso lo stomaco attraverso il nervo vago e fanno sinapsi con cellule del ganglio del Sistema Nervoso Enterico. Il rilascio di acetilcolina dalle fibre vagali post-gangliari stimola direttamente la secrezione gastrica acida attraverso recettori muscarinici M3 presenti sulla membrana baso-laterale delle cellule parietali. Il Sistema Nervoso Centrale modula prevalentemente l’attività del Sistema Nervoso Enterico attraverso l’acetilcolina, stimolando la secrezione gastrica acida in risposta alla vista, all’odore, al sapore, o all’attesa del cibo (fase cefalica della secrezione acida). L’acetilcolina influenza anche indirettamente le cellule parietali, aumentando il rilascio di istamina dalle cellule entero-cromaffini-simili nel fondo dello stomaco e di gastrina dalle cellule G nell’antro gastrico. Difese contro l’acidità dello stomaco La concentrazione estremamente elevata di ioni idrogeno (H+) nel lume gastrico richiede efficaci meccanismi di difesa per proteggere lo stomaco. L’acido cloridrico (HCl) è sufficientemente concentrato da provocare danno tessutale, ma negli individui normali la mucosa gastrica non viene né irritata, né digerita. Lo stomaco si protegge dal danno dell’acido attraverso una serie di meccanismi che richiedono un adeguato flusso sanguigno a livello della mucosa, forse a causa della sua elevata attività metabolica e delle sue richieste di ossigeno. Un sistema chiave di difesa è la secrezione di uno strato di muco e di ioni bicarbonato (HCO3-) da parte delle cellule epiteliali superficiali, muco che aiuta a proteggere le cellule stesse trattenendo gli ioni bicarbonato (HCO3-) secreti alla superficie cellulare. Il muco è secreto dalle cellule mucose superficiali nella regione dell’antro e del corpo e da cellule simili di altre parti dello stomaco. Esso è costituito tra l’altro da glicoproteine che contengono 16 subunità connesse da ponti disolfuro: tramite questi, il muco, che è solubile quando viene secreto, forma rapidamente uno strato flessibile simile a un gel e insolubile, che riveste la mucosa, rallenta la diffusione degli ioni, e previene il danno mucosale da parte di macromolecole come la pepsina. La produzione di muco è stimolata dalle prostaglandine E2 e I2, che inibiscono anche direttamente la secrezione gastrica acida dalle cellule parietali, agendo in entrambi i casi attraverso recettori EP3. Per questo motivo, i farmaci che inibiscono la produzione di prostaglandine (come per esempio i farmaci antinfiammatori non steroidei (FANS) e l’etanolo) riducono la secrezione di muco e predispongono allo sviluppo della malattia acido-peptica. Lo strato stazionario di muco e ioni bicarbonato (HCO3-) sulla mucosa, assieme alle membrane superficiali delle cellule mucosali e alle giunzioni strette tra di esse costituiscono la barriera mucosale, che protegge le cellule mucosali stesse da possibili danni a opera dell’acido gastrico. Alcune sostanze tendono a rompere la barriera e a causare irritazione gastrica: tra queste vi sono l’etanolo, l’aceto, i sali biliari, l’acido acetilsalicilico e altri FANS. Regolazione endocrina e paracrina della secrezione gastrica Una descrizione della regolazione endocrina e paracrina dell’attività secretiva e della motilità dello stomaco, con la citazione delle principali sostanze che vi entrano in gioco e la spiegazione delle loro azioni principali. Le varie funzioni dell’apparato gastro-intestinale sono oggetto di una regolazione integrata per garantire un’efficace assimilazione delle sostanze nutritive dopo un pasto. Vi sono tre principali modalità di regolazione gastro-intestinale, che operano in maniera complementare per garantire un’appropriata funzione. La regolazione endocrina è mediata dal rilascio di ormoni, in risposta a stimoli associati al pasto, che viaggiano con il flusso sanguigno; la regolazione paracrina è attuata da mediatori non sufficientemente stabili da permanere in circolo, ma in grado di alterare la funzione di cellule limitrofe alla zona in cui sono secreti; la regolazione neurocrina è ottenuta tramite l’estesa rete nervosa del tratto gastro-intestinale. Polipeptidi biologicamente attivi, secreti da cellule nervose oppure da cellule ghiandolari della mucosa, entrano in circolo o agiscono in maniera paracrina. In base all’analogia strutturale e, in certa misura, all’analogia funzionale, gli ormoni principali rientrano in una delle due famiglie: la famiglia della gastrina, i cui principali membri sono la gastrina e la colecistochinina, e la famiglia della secretina, i cui principali membri sono la secretina, il glucagone, la glicentina (GLI), il polipeptide intestinale vasoattivo (VIP), e il polipeptide gastro-inibitore (o peptide insulinotropo glucosio-dipendente o GIP); infine altri ormoni non 17 rientrano chiaramente in queste due famiglie, quali la motilina, la sostanza P, il polipeptide liberante la gastrina (GRP) e la guanilina. È importante segnalare inoltre che nella mucosa dello stomaco, dell’intestino tenue e del colon sono stati identificati più di 15 tipi di cellule enteroendocrine secernenti ormoni. Molte di queste cellule secernono un solo ormone e sono identificate con lettere (cellule G, cellule S...); altre producono serotonina o istamina e sono chiamate cellule entero-cromaffini o entero-cromaffini-simili. Le principali sostanze ad azione ormonale sono di seguito elencate. GASTRINA La gastrina è prodotta dalle cosiddette cellule G, situate nella porzione antrale della mucosa gastrica. È tipica di un gruppo di ormoni polipeptidici che mostrano sia macro-eterogeneità, dovuta alla presenza nei tessuti e nei liquidi corporei di catene polipeptidiche di varia lunghezza, che micro-eterogeneità, dovuta a differenze della struttura molecolare correlate alla derivazione dei singoli residui aminoacidici [le gastrine si possono trovare in forma non solforilata a livello della tirosina (gastrina I) e in forma solforilata (gastrina II)]. Il significato fisiologico di questa marcata eterogeneità suggerisce che forme differenti siano adibite ad azioni differenti; tuttavia una conclusione che si può trarre è che la forma G 17 della gastrina sia quella principale per ciò che riguarda la secrezione gastrica acida. La loro emivita varia da 2 a 15 minuti e la loro inattivazione ha luogo principalmente nel rene e nell’intestino tenue. Le loro principali azioni fisiologiche sono la stimolazione della secrezione gastrica di acido e di pepsina e l’azione trofica di stimolazione dell’accrescimento della mucosa gastrica e intestinale. La secrezione di gastrina aumenta: • in presenza nello stomaco di prodotti della digestione proteica, in particolare gli aminoacidi, che agiscono direttamente sulle cellule G, e particolarmente efficaci in questo senso risultano essere la fenilalanina e il triptofano; • con la distensione gastrica; • per aumento della scarica vagale, e il mediatore secreto dalle fibre vagali post-gangliari che innervano le cellule G è probabilmente il polipeptide liberante la gastrina (GRP), piuttosto che l’acetilcolina; • dalla presenza di fattori umorali, quali il calcio e l’adrenalina. 18 La secrezione di gastrina cala: • in presenza di acido nell’antro, che in parte inibisce con azione diretta le cellule G e in parte stimola la liberazione di somatostatina che è un inibitore relativamente potente della secrezione di gastrina; pertanto un aumento della secrezione di gastrina fa aumentare la secrezione di acido, e questo a sua volta inibisce l’ulteriore secrezione di gastrina; • dalla presenza di fattori umorali, quali la secretina, il GIP, il VIP, il glucagone, la calcitonina. COLECISTOCHININA (CCK) La colecistochinina esplica molteplici azioni a livello gastro-enterico; per quanto riguarda specificatamente lo stomaco, essa inibisce lo svuotamento gastrico e sembra aumenti la contrazione dello sfintere pilorico prevenendo il reflusso del contenuto duodenale nello stomaco. SECRETINA La secretina svolge anch’essa diverse azioni a livello gastro-enterico; per quanto riguarda specificatamente lo stomaco riduce la secrezione acida dello stomaco e sembra causi contrazione dello sfintere pilorico. PEPTIDE INTESTINALE VASOATTIVO (VIP) Il peptide intestinale vasoattivo (VIP) è presente nei nervi del tratto gastro-intestinale e quindi non è di per sé un ormone, ma un neurotrasmettitore o prodotto neurocrino; a livello gastrico inibisce la secrezione acida. PEPTIDE GASTRO-INIBITORE (GIP) Il peptide gastro-inibitore (GIP) è stato così chiamato poiché, in dosi elevate, inibisce la secrezione e la motilità gastriche; tuttavia sembra che non abbia attività inibitoria gastrica quando somministrato in dosi minori, che innalzano il suo livello ematico a quello osservato dopo un pasto. Esso invece stimola la secrezione insulinica ed è l’unico ormone in grado di stimolare la secrezione di insulina se somministrato in dosi che danno livelli ematici paragonabili a quelli causati dall’ingestione di glucosio; per questo motivo esso è ora spesso denominato polipeptide insulinotropo glucosio-dipendente. 19 MOTILINA La motilina è secreta dalle cellule entero-cromaffini e da altre cellule dello stomaco, del tenue e del colon. La sua concentrazione in circolo aumenta a intervalli di circa 100 minuti durante le fasi inter-digestive ed è un importante regolatore dei “complessi motori migranti” [COMPLESSI MOTORI MIGRANTI = modificazioni dell’attività elettrica e contrattile della muscolatura liscia gastro-intestinale a digiuno, attraverso cicli di attività motoria che migrano dallo stomaco alla porzione distale dell’ileo; tali cicli o complessi si muovono lungo il tratto gastro-enterico a una velocità costante durante il digiuno; l’assunzione di cibo determina la loro completa inibizione e il movimento riprende dopo 90-120 minuti dall’assunzione del pasto], che controlla la motilità gastro-intestinale tra i pasti; al contrario, in seguito alla ingestione di un pasto, la secrezione di motilina è soppressa fino al termine della digestione e dell’assorbimento. L’eritromicina si lega ai recettori per la motilina e i suoi derivati possono esser d’aiuto nel trattamento di pazienti con ipomotilità gastro-intestinale. SOMATOSTATINA La somatostatina è secreta anche da cellule D-simili presenti nella mucosa gastro-intestinale a livello antrale. Tra le sue azioni vi è l’inibizione della secrezione di gastrina, VIP, GIP, secretina, e motilina. La sua secrezione è stimolata dall’acidità del lume e, probabilmente, agisce in modo paracrino per mediare l’inibizione della secrezione di gastrina prodotta dall’acidità. Sempre a livello gastrico, essa inibisce anche la secrezione acida e la motilità. ALTRI PEPTIDI GASTRO-INTESTINALI • Il peptide YY inibisce la secrezione acida e la motilità dello stomaco. • La grelina è primariamente secreta dallo stomaco e sembra svolgere un importante ruolo nel controllo centrale dell’assunzione di cibo. • Il polipeptide liberante la gastrina (GRP) è presente nelle terminazioni nervose vagali che innervano le cellule G ed è il neurotrasmettitore vagale che stimola la secrezione di gastrina. CONDIZIONI PATOLOGICHE CORRELATE ALL’ACIDITÀ GASTRICA Una descrizione delle condizioni patologiche che possono essere correlate all’acidità gastrica e che sono indicazioni per la somministrazione dei farmaci inibitori della pompa protonica. Per ciascuna condizione patologica si forniscono: la definizione, gli aspetti clinici 20 principali, le potenziali cause, alcuni significativi dati epidemiologici, il processo diagnostico, e l’approccio terapeutico consigliato. Definizioni L’acidità gastrica risulta essere coinvolta in diverse condizioni patologiche, nelle quali possono essere utilizzati i farmaci inibitori della pompa protonica: • la malattia da reflusso gastro-esofageo (MRGE), • l’esofagite da reflusso, • l’ulcera peptica: gastrica e duodenale, • l’infezione da Helicobacter pylori, • la gastropatia erosiva associata a farmaci antinfiammatori non steroidei (FANS), • la sindrome di Zollinger-Ellison, • la dispepsia funzionale. MALATTIA DA REFLUSSO GASTRO-ESOFAGEO (MRGE) Il reflusso gastro-esofageo è il passaggio anomalo nell’esofago di contenuto gastrico; quest’ultimo, essendo acido, può danneggiare l’esofago che non ha una struttura del tutto adeguata a sopportare questo tipo di insulto. Tale reflusso sembra essere un importante fattore di rischio per l’insorgenza dell’adenocarcinoma [ADENOCARCINOMA = tumore epiteliale maligno] dell’esofago, e il rischio aumenta all’aumentare della durata nel tempo e dell’intensità del reflusso. La malattia da reflusso gastro-esofageo (MRGE) è una condizione clinica che si sviluppa quando il reflusso di contenuto gastrico nell’esofago determina sintomi e/o complicanze fastidiose. Esistono numerose possibili forme cliniche, che si possono distinguere in due gruppi principali: • le sindromi esofagee, distinte in: − sindromi con danno esofageo mucosale (esofagite, stenosi, esofago di Barrett, adenocarcinoma dell’esofago); − sindromi senza danno mucosale o sintomatiche(sindrome tipica da reflusso, sindrome da reflusso con dolore toracico); • le sindromi extra-esofagee, distinte in: − sindromi per cui l’associazione con la MRGE è sufficientemente provata (tosse da reflusso, laringite da reflusso, asma da reflusso, erosione dentale da reflusso); 21 − sindromi in cui l’associazione con la MRGE è solo ipotizzata (faringite, sinusite idiopatica, fibrosi polmonare idiopatica, otite media ricorrente). Generalmente, nella MRGE, il danno mucosale è presente solo in una casistica minima, probabilmente inferiore al 33%, pertanto la sua manifestazione prevalente è rappresentata dalla malattia da reflusso non erosiva [MALATTIA DA REFLUSSO GASTRO-ESOFAGEO NON EROSIVA o NERD = pazienti con sintomi tipici, quali pirosi e rigurgito, ma senza segni macroscopici di esofagite all’indagine endoscopica]; invece, per quanto riguarda le forme con danno mucosale, il quadro più frequente è costituito dall’esofagite non complicata, e solo una piccola parte dei pazienti presenta ulteriori complicazioni quali stenosi, ulcera, esofago di Barrett, adenocarcinoma. Gli episodi di reflusso che si verificano durante la notte sono più pericolosi e lesivi, sia perché avvengono quando la posizione corporea non consente l’effetto di rimozione passiva del materiale acido legato alla forza di gravità, sia perché manca la stimolazione cosciente che attiva la deglutizione di saliva e la peristalsi dell’esofago. La regola secondo la quale la pirosi, nel paziente con MRGE, sia legata al reflusso acido non sembra essere più valida: vari studi hanno infatti documentato che la pirosi può essere indotta, oltre che dal reflusso acido, anche dal reflusso debolmente acido, dal reflusso non acido, dalla infusione di lipidi intra-duodenali, e da fattori psicologici come l’ansia e la depressione. Inoltre un concetto di importanza clinica è che non esiste un parallelismo tra la severità dei sintomi, in particolare quelli tipici (pirosi e rigurgito), e la presenza e la gravità di lesioni macroscopiche: ovvero non esiste una linearità tra manifestazioni soggettive e danni anatomici oggettivi; esiste tuttavia, almeno in certi pazienti, una discreta correlazione tra la frequenza e la durata dei sintomi e l’entità dell’esposizione esofagea all’acido. La MRGE ha una patogenesi multifattoriale, associabile a uno squilibrio tra fattori aggressivi e fattori difensivi. Tra i fattori aggressivi vi sono: l’acidità e la quantità del materiale gastrico refluito, la contemporanea presenza di componenti duodenali come bile ed enzimi pancreatici, e l’attività della pepsina. Tra i fattori difensivi vi sono: l’effetto chimico della saliva, la contiguità dello strato cellulare epiteliale esofageo, il ricambio cellulare, la capacità tampone intra-cellulare ed extra-cellulare nei confronti degli ioni idrogeno (H+) refluiti, la produzione di muco e ioni bicarbonato (HCO3-), l’attività peristaltica dell’esofago, l’azione dello sfintere esofageo inferiore e un adeguato svuotamento gastrico. La MRGE, pur appartenendo al gruppo di patologie acido-correlate, non è strettamente collegata a una ipersecrezione gastrica acida: nella maggior parte dei casi quest’ultima è infatti nella norma. Il fattore di maggiore importanza patogenetica è rappresentato invece dal 22 rilasciamento transitorio e inappropriato, cioè non successivo alla deglutizione, dello sfintere esofageo inferiore, che nei pazienti con MRGE risulta quantitativamente aumentato e più frequentemente associato a episodi di reflusso acido; fisiologicamente tale meccanismo, il cui stimolo principale è dato dalla distensione del fondo gastrico, ha la funzione di permettere il passaggio del gas, prodottosi a livello dello stomaco, verso la bocca, evitando una eccessiva distensione gastrica. Anche l’importanza patogenetica dell’ernia iatale [ERNIA IATALE = protrusione attraverso lo iato diaframmatico, ovvero il foro fisiologico del muscolo diaframma attraverso cui passa l’esofago, di una porzione dello stomaco e dell’esofago inferiore] è stata rivalutata: essa determina un disaccoppiamento degli sfinteri esofagei riducendo l’ampiezza del sistema anti-reflusso e inoltre costituisce un serbatoio di acido intra-toracico che facilita, immediatamente dopo un atto di rimozione da parte della peristalsi esofagea, una nuova acidificazione dell’esofago. Per quanto riguarda invece l’origine dei sintomi extra-esofagei, la causa di sintomi come la raucedine, la tosse, o l’asma potrebbe essere un’estensione prossimale o addirittura un’inalazione del reflusso, mentre la causa del dolore toracico potrebbe essere la stimolazione chimica diretta o la stimolazione dei tensocettori della parete esofagea dovuta a distensione della parete, entrambe indotte dal reflusso stesso. ESOFAGITE DA REFLUSSO L’esofagite da reflusso è la persistenza nell’esofago di materiale gastrico fino a provocare un danno visibile all’endoscopia del tubo esofageo; è determinata dalla combinazione di un eccessivo reflusso del contenuto gastrico, non necessariamente acido, con un’alterata rimozione esofagea dello stesso. L’esofago di Barrett (nome del medico inglese che lo descrisse per primo) è una metaplasia [METAPLASIA = trasformazione anomala di una parte di tessuto adulto completamente differenziato in un altro tipo di tessuto adulto] caratterizzata da una sostituzione del normale epitelio squamoso pluristratificato dell’esofago distale con un epitelio metaplasico di tipo colonnare, a seguito dell’insulto cronico derivante dal reflusso gastro-esofageo. La metaplasia rappresenta una condizione di rischio per lo sviluppo di displasia e quindi di adenocarcinoma dell’esofago distale e della giunzione esofago-stomaco. Il cancro dell’esofago comprende due forme principali e distinte: l’istotipo squamocellulare, che origina dall’epitelio squamoso esofageo, e l’adenocarcinoma, che origina da un epitelio metaplasico di tipo colonnare; questi due istotipi rappresentano il 95% delle neoplasie maligne dell’esofago, mentre le rimanenti sono dovute ad altre tipologie neoplastiche. Negli ultimi decenni del secolo scorso si è assistito a un’inversione di tendenza per quanto 23 riguarda l’incidenza delle due principali neoplasie esofagee: l’incidenza dell’istotipo squamocellulare è globalmente diminuita, mentre quella dell’adenocarcinoma è globalmente aumentata a causa della cresciuta prevalenza della MRGE. ULCERA PEPTICA: GASTRICA E DUODENALE L’erosione è una lesione piccola e superficiale della mucosa, che non supera mai la muscolaris mucosae, tende in genere a una completa guarigione, e ha una rilevanza clinica minore; l’ulcera invece è una lesione senza interruzione della mucosa, di diametro superiore a 3 mm, di forma rotonda o ovalare, che supera sempre la muscolaris mucosae estendendosi alla tonaca sottomucosa e raggiungendo talvolta anche la tonaca muscolare. L’ulcera peptica dello stomaco (ulcera gastrica) o del bulbo duodenale (ulcera duodenale) è una malattia cronica, il cui decorso clinico è caratterizzato da cicatrizzazioni, anche spontanee, successive recidive, e dall’eventuale comparsa di complicanze, talvolta mortali, come l’emorragia e la perforazione. In circa il 30% dei casi, la malattia peptica è del tutto silente, non si accompagna ad alcuna sintomatologia, e si può manifestare con una complicanza, più frequentemente un’emorragia. Nel 50% dei casi, l’ulcera peptica si manifesta con un dolore localizzato a livello dell’epigastrio, che può irradiarsi posteriormente; nel quadro clinico classico, le caratteristiche del dolore epigastrico sono differenti a seconda che si tratti di un’ulcera gastrica o di un’ulcera duodenale; nell’ulcera gastrica, il dolore è sordo e insorge precocemente subito dopo il pasto o addirittura può essere esacerbato dal pasto; nell’ulcera duodenale, il dolore è urente, insorge a digiuno oppure 2-3 ore dopo il pasto oppure durante la notte e si attenua con l’assunzione di cibo. Nel restante 20% dei casi, il dolore presenta caratteristiche meno specifiche e può essere accompagnato o sostituito da altri sintomi dispeptici (come senso di pienezza post prandiale, digestione lenta, nausea talvolta accompagnata da vomito, pirosi epigastrica e retrosternale). Essendo l’ulcera peptica una malattia caratterizzata da cicatrizzazioni e recidive, anche la sintomatologia è in genere intermittente ed episodica, intervallata da periodi di benessere della durata di alcuni mesi e da periodi di riacutizzazione prevalentemente stagionali, in primavera e in autunno. Ogni anno tuttavia, l’1-2% dei pazienti con ulcera peptica presenta una complicanza, che può essere di tre tipi: emorragia, perforazione, ostruzione. L’emorragia è la complicanza più frequente, si manifesta in genere con ematemesi [EMATEMESI = il vomitare sangue] e/o melena [MELENA = passaggio di feci scure o nerastre, colorate da sangue digerito], e può portare a uno shock ipovolemico e talvolta alla morte; in alternativa, vi può essere uno stillicidio ematico cronico, che si manifesta con un 24 quadro clinico di anemia sideropenica. La perforazione della parete in cavità addominale è una complicanza meno frequente, ma con un esordio talvolta più drammatico, caratterizzato da un dolore addominale improvviso e violentissimo. L’ostruzione infine è la complicanza meno frequente, è dovuta in genere a una stenosi pilorica provocata da una fibrosi e/o da una deformazione cicatriziale, e nausea e vomito post-prandiale sono i sintomi più caratteristici. L’infezione da Helicobacter pylori è la causa principale dell’ulcera peptica; l’altra causa più frequente è l’assunzione di FANS, compreso l’acido acetilsalicilico a basse dosi; esiste poi una varietà di altre cause meno frequenti, come la sindrome di Zollinger-Ellison, l’iperplasia delle cellule G antrali e la mastocitosi sistemica [MASTOCITOSI SISTEMICA = forma disseminata di proliferazione di mastociti, cellule del tessuto connettivo che presentano un citoplasma ricco di granuli contenenti eparina e istamina, con coinvolgimento della cute, del fegato, dei linfonodi, del tratto intestinale, dell’osso e del midollo osseo]; infine in un piccolo gruppo di soggetti non sono riconoscibili fattori eziologici noti e questi sono i cosiddetti casi di “ulcera idiopatica”. INFEZIONE DA HELICOBACTER PYLORI L’Helicobacter pylori è un batterio Gram-negativo, ricurvo o spiraliforme, dotato di flagelli, il cui assetto metabolico ne consente la sopravvivenza in ambiente acido; nello stomaco, predilige le aree a pH più elevato (regione antrale). Il batterio penetra nello strato di muco e raggiunge l’epitelio gastrico grazie a tre fattori di colonizzazione: l’ureasi, i flagelli e le adesine. Il succo gastrico ha proprietà battericide fino a che il pH rimane inferiore a 4, ma l’ureasi, enzima prodotto in grandi quantità dal batterio, idrolizza l’urea presente nel lume gastrico con produzione di ammoniaca (NH3) e ioni bicarbonato (HCO3-), che neutralizzano parzialmente l’acidità gastrica creando intorno al batterio un ambiente alcalino; la presenza di flagelli rende poi il batterio libero di muoversi; infine le adesine presenti sulla superficie batterica gli permettono di aderire all’epitelio gastrico, localizzandosi quasi sempre al di sopra dell’epitelio, senza invadere la lamina propria. Il batterio esercita il suo effetto patogeno sulla mucosa con due meccanismi: sia inducendo un’intensa risposta infiammatoria della mucosa, sia liberando enzimi e tossine che alterano lo strato di muco e danneggiano l’epitelio gastrico rendendo la mucosa più vulnerabile al danno dell’acido. Le vie di trasmissione dell’infezione non sono state ancora del tutto chiarite, anche se questa viene acquisita attraverso l’ingestione del batterio e quindi le più plausibili vie di trasmissione tra esseri umani sembrano quella fecale-orale oppure quella oro-orale. La re-infezione da 25 Helicobacter pylori dopo l’eradicazione, cioè dopo l’eliminazione del batterio con terapia antibiotica, è un’evenienza rara, interessando solo circa l’1-2% dei soggetti all’anno. L’infezione da Helicobacter pylori causa pressoché invariabilmente una gastrite cronica che, nella maggior parte dei casi, decorre in maniera asintomatica e persiste per tutta la vita senza che si sviluppi mai alcuna patologia del tratto digestivo superiore. Una piccola percentuale, circa il 10-15%, dei soggetti sviluppa anche un’ulcera peptica; è stato ipotizzato che a favorire ciò intervengano fattori legati al batterio (quali la virulenza), all’ospite (quali la predisposizione genetica), oltre a fattori esterni (quali il fumo). Se da una parte non vi è dubbio che l’Helicobacter pylori sia la causa dell’ulcera, d’altra parte non sono stati ancora chiariti i meccanismi patogenetici attraverso i quali l’infezione determina la malattia ulcerosa; più in dettaglio, la cascata di eventi che legano l’infezione da Helicobacter pylori alla produzione di acido da parte dello stomaco non è stata del tutto confermata. Il processo patogenetico che determina lo sviluppo dell’ulcera gastrica sembra essere tuttavia diverso da quello che porta all’ulcera duodenale. L’ulcera gastrica si associa in genere a una gastrite cronica diffusa o prevalentemente a livello del corpo, con atrofia delle ghiandole secernenti acido; nonostante la ridotta secrezione acida, la patogenesi dell’ulcera gastrica è da riferirsi verosimilmente a una riduzione dei meccanismi di difesa della mucosa all’attacco acido, conseguenza dell’infiammazione cronica e del danno indotto alla mucosa da parte dell’Helicobacter pylori. L’ulcera duodenale invece si associa in genere a una gastrite cronica prevalentemente a livello antrale, senza atrofia delle ghiandole secernenti acido; si verifica una ipersecrezione gastrica acida, conseguenza di un’aumentata liberazione di gastrina, dovuta a diversi fattori legati all’infezione da Helicobacter pylori, tra cui una ridotta secrezione di somatostatina; nel bulbo duodenale si sviluppano aree di metaplasia in risposta all’aumentato carico acido e il batterio presente nello stomaco può colonizzare queste aree, con conseguente sviluppo di duodenite, che a sua volta determina un’aumentata suscettibilità della mucosa all’acido e predispone allo sviluppo dell’ulcera. GASTROPATIA EROSIVA ASSOCIATA A FANS Sebbene si usi spesso la definizione “gastrite erosiva” per descrivere le erosioni gastriche, esse possono non essere realmente associate alla presenza di segni istologici di gastrite [GASTRITE = patologia caratterizzata dalla presenza di cellule infiammatorie nella mucosa gastrica, documentate istologicamente]: pertanto è più corretto utilizzare la definizione “gastropatia erosiva”. La gastropatia erosiva associata a FANS causa raramente sanguinamenti acuti clinicamente evidenti, mentre la maggior parte dei sanguinamenti gravi è associata a ulcere peptiche 26 causate da questi farmaci. Il trattamento con FANS può provocare lesioni ulcerative spesso sanguinanti anche a carico dell’intestino tenue: si parla in questo caso di “enteropatia erosiva” associata a FANS. La patogenesi del danno gastro-duodenale da FANS è riconducibile a un duplice meccanismo: questi farmaci infatti danneggiano la mucosa gastrica attraverso un’azione topica e attraverso un’azione sistemica. L’azione topica deriva dalla modificazione delle proprietà biochimiche dello strato di muco che riveste la superficie della mucosa gastrica: la presenza del farmaco aumenta la permeabilità del muco, con conseguente retro-diffusione degli ioni idrogeno (H+) e danno della mucosa. L’azione sistemica è esplicata attraverso l’inibizione di enzimi chiamati ciclossigenasi (COX), che sintetizzano le prostaglandine a partire dall’acido arachidonico; esistono due forme di ciclossigenasi: la COX-1 e la COX-2. La COX-1 è una forma dell’enzima presente costituzionalmente in alcuni tessuti, tra cui la mucosa gastrica, ed è responsabile della sintesi delle prostaglandine fisiologiche che proteggono l’integrità della mucosa gastrica, attraverso la secrezione di muco e ioni bicarbonato (HCO3-), il mantenimento di un adeguato flusso ematico della mucosa, la regolazione del ricambio cellulare e dei sistemi di riparazione. La COX-2 è invece una forma inducibile dell’enzima, ovvero non costitutiva dei tessuti, e la cui sintesi è stimolata da insulti flogogeni ed è quindi responsabile della sintesi delle prostaglandine infiammatorie. I FANS inibiscono in modo non selettivo sia la COX-1 che la COX-2; esistono tuttavia anche FANS che inibiscono selettivamente la COX-2, con un effetto inibitorio minimo sulla COX-1. L’uso dei FANS selettivi per la COX-2 si associa a un minor rischio di ulcera gastrica e duodenale, tuttavia essi sono controindicati in pazienti con patologie cardiovascolari, cerebrovascolari e con vasculopatie perché, inibendo la sintesi della prostaglandina I2 ma lasciando inalterata quella del trombossano A2, determinano un aumentato rischio di trombosi vascolare. SINDROME DI ZOLLINGER-ELLISON La sindrome di Zollinger-Ellison è una rara condizione in cui si verifica un aumento considerevole della secrezione gastrica acida, dovuta a un tumore endocrino producente gastrina (gastrinoma), generalmente localizzato a livello del pancreas o del duodeno. Tale sindrome è spesso caratterizzata da ulcere multiple, localizzate a livello antrale, nella parte distale del bulbo duodenale, e spesso anche nella seconda porzione duodenale. La malattia peptica ulcerosa e i suoi sintomi sono presenti nel 90-95% dei pazienti; i sintomi possono essere persistenti, progressivi, e scarsamente rispondenti alla terapia medica e chirurgica. La diarrea si verifica in più del 30% dei pazienti e può precedere la comparsa dei sintomi dell’ulcera; la steatorrea [STEATORREA = presenza di un eccesso di grassi nelle 27 feci] può essere causata dall’inattivazione della lipasi pancreatica, insieme alla mancata idrolizzazione intra-luminale dei trigliceridi, e da un basso pH nel lume dell’intestino tenue che porta alla formazione di acidi biliari insolubili con una ridotta formazione di micelle. DISPEPSIA FUNZIONALE La dispepsia è una sindrome caratterizzata dalla presenza di sintomi cronici o ricorrenti che fanno riferimento alle prime vie digestive, tra i quali: il dolore e/o fastidio localizzati a livello dell’epigastrio, insieme al senso di pienezza post-prandiale e di sazietà precoce, che possono sovrapporsi con la pirosi e i rigurgiti acidi. La classificazione su base eziologica riconosce due tipi di dispepsia: una forma dovuta alla presenza di alterazioni organiche (dispepsia organica) e una forma non correlata ad alterazioni o cause specifiche strutturali o biochimiche (dispepsia funzionale). Una recente classificazione ha proposto di definire, per la dispepsia funzionale, la distinzione in due sottogruppi: la sindrome da disturbo post-prandiale (caratterizzata da senso di ripienezza post-prandiale e di sazietà precoce) e la sindrome dolorosa epigastrica (caratterizzata da bruciore e dolore epigastrico); i sintomi caratteristici dei due sottogruppi, che possono anche coesistere nello stesso paziente, devono essere stati presenti negli ultimi tre mesi ed essere iniziati almeno sei mesi prima della diagnosi. La secrezione gastrica acida non risulta generalmente aumentata nei pazienti con dispepsia funzionale, tuttavia in alcuni casi un’aumentata sensibilità all’acido può essere evidenziata, anche come risultato di una minore capacità di rimozione dell’acido da parte del duodeno. I meccanismi fisiopatologici responsabili della dispepsia funzionale non sono del tutto chiari. Una disfunzione motoria e sensoriale è tra le ipotesi accreditate; potenziali meccanismi includono: un ritardato svuotamento gastrico, una modificata accomodazione del fondo gastrico in risposta a un pasto, un’ipersensibilità alla distensione meccanica gastrica, un’alterata sensibilità viscerale, l’infezione da Helicobacter pylori, un’ipersensibilità duodenale ai grassi e all’acido, un’ipersensibilità dell’esofago all’acido, una mancata inibizione della contrattilità fasica gastrica, e le contrazioni esofagee longitudinali. Dati epidemiologici Una descrizione delle condizioni patologiche che possono essere correlate all’acidità gastrica e che sono indicazioni per la somministrazione dei farmaci inibitori della pompa protonica, in termini di alcuni significativi dati epidemiologici. Le malattie dell’apparato gastro-intestinale hanno una larga diffusione in Italia; esse sono al secondo posto in termini di dispendio di risorse sanitarie, venendo subito dopo le patologie 28 dell’apparato cardio-vascolare. Nei diversi Paesi dell’Unione Europea si osserva invece un andamento che non risulta essere sempre omogeneo. MALATTIA DA REFLUSSO GASTRO-ESOFAGEO ED ESOFAGITE DA REFLUSSO La MRGE è la più frequente patologia del tratto gastro-intestinale superiore. In Europa e nell’America del Nord, negli ultimi 10-20 anni, si è registrato un continuo incremento dell’incidenza [INCIDENZA = numero di casi che avvengono in una popolazione, in un certo periodo di tempo, espresso come proporzione (esempio: “x” casi per 1000 abitanti per anno)] della MRGE e si stima che circa il 20-30% della popolazione presenti questa condizione. Recenti revisioni sistematiche e metanalisi hanno documentato un aumento nel tempo della prevalenza della malattia e dei tassi di ospedalizzazione, in particolare nel mondo occidentale; ma anche in Asia, ove la prevalenza era significativamente inferiore, ora essa è in forte aumento a causa dei cambiamenti avvenuti nell’alimentazione. In generale, elementi epidemiologici sembrano collegare l’epidemia di obesità, osservabile in tutto il mondo, all’epidemia della MRGE. Dati epidemiologici italiani sulla prevalenza [PREVALENZA = numero di casi che avvengono in una popolazione, in un certo periodo di tempo, espresso in rapporto alla popolazione totale] e sull’incidenza della MRGE sono generalmente riferiti a studi condotti su popolazioni o aree geografiche limitate e non ci sono quindi dati relativi alla popolazione italiana nel suo complesso. Per quanto riguarda la storia naturale dei pazienti affetti da MRGE, i dati indicano una naturale evoluzione delle forme non erosive verso quelle erosive, stimabile in circa il 10-12% per anno, seppur sia in atto una terapia antisecretiva; tale progressione è rappresentata per la maggior parte dei casi (80%) da esofagiti di lieve-moderata entità, mentre gradi maggiori di esofagite si riscontrano più spesso in pazienti con gravi disturbi motori dell’esofago, in pazienti psichiatrici, o in pazienti molto anziani, defedati, o affetti da più patologie. La MRGE presenta inoltre una scarsa tendenza alla remissione spontanea dei sintomi e delle lesioni, e si caratterizza semmai per una tendenza alla cronicizzazione degli stessi in assenza di adeguata terapia: tanto nelle forme erosive che in quelle non erosive, alla sospensione della terapia d’attacco, si verifica una tendenza alla recidiva sintomatica superiore al 75%. ULCERA PEPTICA: GASTRICA E DUODENALE In Europa e nell’America del Nord, negli ultimi 10-20 anni, si è progressivamente ridotta la prevalenza dell’ulcera peptica. Nonostante, nelle popolazioni industrializzate, si sia registrato 29 questo calo significativo, l’ulcera peptica interessa ancora circa il 4% della popolazione generale ed è presente in circa il 10% dei pazienti con sintomi dispeptici. L’ulcera gastrica è meno frequente dell’ulcera duodenale; l’età più colpita è superiore per l’ulcera gastrica (50-70 anni) rispetto a quella duodenale (30-40 anni); infine le lesioni peptiche nel loro insieme (ulcera gastrica e ulcera duodenale) rimangono al primo posto come cause di emorragia gastro-intestinale alta, rispettivamente con il 24% e il 34% dei casi. INFEZIONE DA HELICOBACTER PYLORI L’infezione da Helicobacter pylori è una delle infezioni più diffuse nel mondo, interessando circa la metà della popolazione mondiale. La prevalenza dell’infezione varia nelle diverse popolazioni ed è inversamente proporzionale alle condizioni socio-economiche: infatti il batterio infetta circa l’80% degli adulti nelle popolazioni in via di sviluppo, mentre è presente in circa il 20-50% delle popolazioni industrializzate. Negli ultimi decenni, nei Paesi industrializzati, l’incidenza dell’infezione da Helicobacter pylori si è ridotta marcatamente grazie alle migliorate condizioni socio-economiche: si stima che solo circa il 20-30% della popolazione di età compresa tra i 20-30 anni ne sia portatrice e solo il 10-20% dei bambini ne sia infettato. Questo indica che probabilmente nei prossimi decenni la prevalenza dell’infezione, e quindi dell’ulcera peptica, si potrà ridurre ulteriormente. Nella maggior parte dei casi, l’infezione da Helicobacter pylori viene acquisita precocemente nell’infanzia o nell’adolescenza e tende poi a persistere per tutta la vita. L’Helicobacter pylori è la causa principale dell’ulcera peptica, essendo responsabile di circa l’80% delle ulcere gastriche e di circa il 90% delle ulcere duodenali; l’eradicazione determina tuttavia una drastica riduzione delle recidive dell’ulcera che, a un anno, passano da circa l’80% nei soggetti non eradicati a meno di circa il 5% nei soggetti eradicati. GASTROPATIA EROSIVA ASSOCIATA A FANS L’assunzione cronica di FANS, incluso l’acido acetilsalicilico a basse dosi, è la più frequente causa di ulcera peptica non correlata all’Helicobacter pylori; essa è responsabile di circa il 15% delle ulcere gastriche e di circa il 5% delle ulcere duodenali. Dati epidemiologici suggeriscono che almeno l’1% della popolazione generale faccia uso quotidiano di FANS, assunti non solo su prescrizione medica, ma anche come automedicazione; va inoltre considerata la sempre più diffusa prescrizione di acido acetilsalicilico a basse dosi per la prevenzione dell’infarto cardiaco e degli eventi ischemici cerebrovascolari. Tra i consumatori abituali di FANS, circa il 25% sviluppa un’ulcera peptica e circa il 2-4% sviluppa una sua complicanza. 30 Diversi fattori aumentano il rischio di insorgenza di ulcera peptica in soggetti che assumono FANS, tra questi: un’anamnesi positiva per ulcera peptica o sanguinamento; un’età avanzata indicativamente superiore ai 65 anni; un uso di elevate dosi di FANS; un’assunzione concomitante di acido acetilsalicilico, steroidi, o anticoagulanti; e la presenza di infezione da Helicobacter pylori. Il rischio di ulcera e di sviluppare complicanze aumenta, ovviamente, nei soggetti che presentano più fattori di rischio contemporaneamente. SINDROME DI ZOLLINGER-ELLISON È una condizione relativamente rara. L’incidenza dei gastrinomi è sconosciuta, tuttavia si suppone che questi tumori siano responsabili di circa lo 0,1-1% delle ulcere duodenali. La sindrome di Zollinger-Ellison si manifesta inizialmente tra i 30 e i 50 anni, e circa un terzo dei pazienti con questa sindrome ha un’età superiore ai 60 anni. DISPEPSIA FUNZIONALE La dispepsia è una condizione clinica molto frequente; studi effettuati nell’Europa occidentale e negli Stati Uniti riportano una prevalenza annuale che varia dal 25 al 40%. La fascia di età maggiormente coinvolta è quella tra i 40 e i 50 anni. In molti casi i sintomi sono di breve durata o di lieve entità e vengono pertanto autogestiti; tuttavia quasi la metà dei pazienti con dispepsia richiede l’intervento del medico, con un elevato impatto socio-economico. È difficile raccogliere dati certi circa la prevalenza della dispepsia funzionale, dal momento che si tratta essenzialmente di una diagnosi di esclusione, che richiederebbe indagini costose e invasive; questo anche a causa della sovrapposizione con altri disturbi funzionali intestinali. Inoltre i pazienti che all’esordio presentano sintomi riconducibili alla dispepsia funzionale, nel corso degli anni possono diventare asintomatici oppure sviluppare sintomi che suggeriscono un disturbo dell’apparato gastro-intestinale inferiore. I fattori che sembrano favorire la persistenza della sintomatologia dispeptica e lo sviluppo di disturbi dell’apparato gastro-intestinale inferiore sono il sesso femminile e un elevato grado di somatizzazione; d’altra parte, in questi pazienti, il rischio di sviluppare patologie organiche sembra ridotto, anche se sono necessari ulteriori studi per confermare questo aspetto. Diagnosi Una descrizione delle condizioni patologiche che possono essere correlate all’acidità gastrica e che sono indicazioni per la somministrazione dei farmaci inibitori della pompa protonica, in termini di processo diagnostico. 31 MALATTIA DA REFLUSSO GASTRO-ESOFAGEO ED ESOFAGITE DA REFLUSSO A livello di medicina generale, l’approccio diagnostico al paziente con sospetta MRGE è essenzialmente clinico ed è basato sul riconoscimento dei sintomi tipici (pirosi e rigurgito) e sull’assenza dei segni o sintomi d’allarme (anemia, calo di peso ingiustificato, anoressia, disfagia, sintomi prolungati o refrattari, età d’insorgenza dei sintomi superiore ai 50 anni) che richiederebbero una valutazione diagnostica strumentale. Per quanto riguarda la valutazione dei sintomi extra-esofagei, anch’essa deve essere effettuata dopo la ricerca dei sintomi tipici. I sintomi tipici tuttavia non presentano particolare specificità e sensibilità, e quindi il loro valore predittivo è limitato. Pertanto, a scopo diagnostico, è importante effettuare un’attenta anamnesi orientata alla ricerca di tutti i segni e i sintomi, inclusi quelli che spesso non sono spontaneamente riferiti dal paziente ma che possono essere messi in relazione patogenetica con la MRGE; importante è anche lo studio della correlazione di questi sintomi con i pasti, con la posizione corporea e con il sonno. Un esame endoscopico del tratto digestivo superiore, in un paziente con sintomi suggestivi di MRGE, viene condotto principalmente per identificare l’esofago di Barrett. Non esistono sintomi predittivi che si correlino con un elevato rischio di diagnosi di esofago di Barrett, anche se una sintomatologia di durata particolarmente lunga (superiore ai 15 anni) o con una severità e/o frequenza importante incrementano la probabilità di tale complicanza. Almeno il 50% dei pazienti con sintomi tipici di MRGE tuttavia non presenta un reperto endoscopico di esofagite, e questo spiega la limitata sensibilità dell’endoscopia. A tal proposito è opportuno sottolineare che, attualmente, il più utilizzato sistema di classificazione endoscopica dell’esofagite richiede come lesione minima la presenza di almeno una breve erosione, mentre non riconosce lesioni come l’iperemia o la fragilità mucosale a causa della loro modesta riproducibilità. Poiché la MRGE è una condizione clinica determinata dal reflusso più o meno continuativo di contenuto gastrico in esofago, la misurazione del pH nell’esofago distale per 24 ore, attraverso la pH-metria esofagea delle 24 ore, è stata considerata un valido procedimento diagnostico per identificare un’esposizione esofagea all’acido di durata patologica, e per correlare i vari episodi sintomatici con il reflusso di acido. Nella popolazione italiana, i limiti superiori alla norma sono costituiti da un’esposizione esofagea all’acido con pH inferiore a 4 che superi il 5% del tempo di registrazione; un altro parametro importante è costituito dall’indice sintomatico, cioè dalla percentuale di corrispondenza tra sintomi ed episodi di reflusso, dove un valore superiore al 50% è in genere considerato come patologico. Nei pazienti con NERD è tuttavia presente una durata patologica di esposizione acida in meno del 50% dei casi; pertanto la pH-metria presenta valori di sensibilità limitati proprio nei 32 pazienti negativi all’endoscopia, in cui viceversa dovrebbe rappresentare l’esame strumentale più utile per collegare i sintomi al reflusso. Per le limitazioni legate all’incapacità di evidenziare episodi di reflusso non acidi o debolmente acidi, la tendenza è di sostituire gradualmente la pH-metria esofagea con la pH impedenzometria esofagea delle 24 ore. Questa tecnica, basata sulla misurazione dell’impedenza (o resistenza) elettrica endo-luminale, valuta la relazione quantitativa esistente tra la variazione dell’impedenza e il movimento di materiale liquido o gassoso o solido all’interno di un viscere cavo, come l’esofago. Combinando la misurazione dell’impedenza con quella del pH endo-esofageo è possibile quindi ricostruire la natura fisica e chimica di ogni episodio di reflusso, misurarne la durata, e verificare la corrispondenza con i sintomi; inoltre è possibile anche valutare l’estensione prossimale del reflusso, parametro di particolare importanza nel caso di pazienti con sintomi extra-esofagei. I raggi X dell’esofago con bario infine rappresentano un esame non di routine nel paziente con sintomi suggestivi di MRGE, ma è un esame utile preliminarmente alla valutazione endoscopica nel sospetto di stenosi (benigna o neoplastica) nel paziente disfagico o nel paziente con dolore toracico non cardiogeno. Non ha alcuna utilità nel caso di sintomi tipici, ma permette con adeguate manovre di evidenziare la presenza di ernia iatale. ULCERA PEPTICA: GASTRICA E DUODENALE Sebbene la presenza di un quadro clinico classico possa fornire un orientamento diagnostico, la diagnosi certa dell’ulcera peptica si basa sull’esecuzione di un’indagine strumentale: l’esame radiologico con mezzo di contrasto (bario) o l’esame endoscopico del tratto digestivo superiore (esofago-gastro-duodeno-scopia). L’esame radiologico è in grado di evidenziare l’ulcera peptica in circa l’80% dei casi. L’esame endoscopico è tuttavia l’indagine di prima scelta, poiché ha una sensibilità del 95100%; inoltre permette di evidenziare i segni di rischio di sanguinamento, o di un sanguinamento in atto, o di uno recente; infine nel corso dell’esame è possibile effettuare prelievi bioptici della mucosa, fattore particolarmente importante sia per una diagnosi di infezione da Helicobacter pylori, che richiede prelievi bioptici multipli nell’antro e nel corpo gastrico, che per una diagnosi di ulcera gastrica, la quale deve necessariamente essere sottoposta a biopsie multiple per differenziare un’ulcera benigna da una maligna e il cui esame istologico permetterà di differenziare un’ulcera peptica da ulcere dovute a malattie sistemiche che possono colpire tutto il tubo digerente, come il Morbo di Crohn. 33 INFEZIONE DA HELICOBACTER PYLORI Esistono diversi test per la diagnosi di infezione da Helicobacter pylori, alcuni invasivi e altri non invasivi. I test invasivi sono quelli che necessitano dell’esame endoscopico, essendo effettuati su prelievi bioptici della mucosa gastrica, e sono: il test rapido all’ureasi, l’esame istologico e la coltura. I test non invasivi sono invece: il 13C-urea breath test o test del respiro, il test fecale e la sierologia. La sensibilità di tutti i test diagnostici, tranne la sierologia, può essere ridotta dalla recente assunzione di farmaci antisecretivi o antibiotici che, riducendo marcatamente la carica batterica, possono determinare dei risultati falsamente negativi. Qualsiasi test per la diagnosi dell’infezione da Helicobacter pylori, tranne la sierologia, deve essere perciò eseguito dopo un intervallo di tempo di almeno due settimane dalla sospensione dei farmaci antisecretivi e di almeno quattro settimane dalla sospensione dei farmaci antibiotici. Test rapido all’ureasi: l’ureasi dell’Helicobacter pylori idrolizza l’urea, con produzione di ammoniaca che, essendo alcalina, determina un aumento del pH, indicato da un indicatore che ha un viraggio di colore. Esame istologico: altamente accurato sia nella diagnosi iniziale che nella diagnosi posttrattamento dell’infezione; poiché il batterio è distribuito sulla mucosa gastrica in modo non uniforme, deve essere effettuato su almeno due biopsie di mucosa gastrica prelevate nell’antro e due biopsie di mucosa gastrica prelevate nel corpo. Coltura: caduta in disuso nella pratica clinica, poiché è un esame complesso, costoso, e con una relativamente bassa sensibilità, permette però di eseguire l’antibiogramma, cioè di testare la sensibilità del batterio agli antibiotici, e può essere utile nei casi di infezione resistente agli antibiotici. 13 C-urea breath test o test del respiro: test di prima scelta per la diagnosi; si somministra al paziente una soluzione acquosa contenente una piccola quantità di urea, marcata con carbonio 13 che è un isotopo naturale non radioattivo del carbonio, e di acido citrico, che rallenta lo svuotamento gastrico e prolunga il tempo di permanenza dell’urea marcata nello stomaco. L’urea marcata viene rapidamente idrolizzata dall’ureasi del batterio, producendo ammoniaca e anidride carbonica marcata. Vengono quindi raccolti al paziente due campioni di respiro, uno prima dell’inizio dell’esame e uno 30 minuti dopo la somministrazione dell’urea marcata, facendo soffiare il paziente con una cannuccia in una provetta: un aumento della anidride carbonica marcata nei due campioni di respiro, misurata con uno spettrometro di massa, indica la presenza dell’infezione da Helicobacter pylori. Test fecale: da qualche anno sono disponibili in commercio dei test in grado di evidenziare la presenza di antigeni fecali di Helicobacter pylori, con una metodica immuno-enzimatica; 34 hanno dimostrato un’ottima accuratezza nella diagnosi iniziale dell’infezione, mentre non altrettanto soddisfacente è la loro accuratezza dopo il trattamento. Sierologia: consiste nel dosaggio di anticorpi sierici, IgG, contro antigeni di superficie dell’Helicobacter pylori, mediante tecniche di agglutinazione e metodiche enzyme-linked immunosorbent assay (ELISA). Il test è semplice, ampiamente disponibile, e soprattutto poco costoso, per cui è stato per anni il test più diffuso nella pratica clinica; non è però altamente accurato e, in questi ultimi anni, è stato soppiantato dal 13C-urea breath test o test del respiro e dal test fecale. Trova tuttavia applicazione nella diagnosi iniziale di infezione da Helicobacter pylori, in quei pazienti che non possono sospendere il trattamento con farmaci antisecretivi, poiché è l’unico test a non essere influenzato dalla concomitante assunzione di farmaci; tuttavia non deve essere mai usato nella diagnosi di infezione da Helicobacter pylori dopo un trattamento antibiotico eradicante, poiché è gravato da un’alta percentuale di risultati falsamente positivi, essendo le IgG anticorpi di memoria che persistono nel sangue per anni, talvolta per tutta la vita, anche dopo l’eradicazione del batterio. GASTROPATIA EROSIVA ASSOCIATA A FANS La diagnosi di tale condizione si basa su un’anamnesi positiva per assunzione di FANS e, successivamente, sull’utilizzo delle metodiche diagnostiche illustrate per “L’ulcera peptica: gastrica e duodenale”. SINDROME DI ZOLLINGER-ELLISON La diagnosi della sindrome di Zollinger-Ellison si basa sui suoi caratteristici reperti clinici. L’esame radiografico con il bario può evidenziare le prominenti pliche gastriche e duodenali (e occasionalmente digiunali), che possono essere ispessite e dilatate. Inoltre un’ipersecrezione di acido gastrico si verifica in più del 90% dei pazienti. Il test diagnostico più sensibile e specifico è tuttavia rappresentato dall’identificazione di una condizione di ipergastrinemia, che è caratteristica dei pazienti affetti da gastrinoma. DISPEPSIA FUNZIONALE In un paziente che sia stato sottoposto a un completo percorso diagnostico per escludere la presenza di una dispepsia organica, possono essere diagnosticate essenzialmente quattro condizioni cliniche: ulcera peptica (circa 10% dei casi), MRGE con esofagite (circa 20% dei casi), MRGE senza esofagite (circa 20% dei casi), cancro delle prime vie digestive (circa 1% dei casi), e dispepsia funzionale (circa 49% dei casi), quest’ultima rimanendo una diagnosi di esclusione. 35 Nella gestione del paziente dispeptico è fondamentale per il medico poter acquisire, attraverso un’accurata anamnesi, una serie di dati in base ai quali orientare correttamente le proprie scelte diagnostiche e terapeutiche. Qualora nel paziente non si riscontri una causa organica di dispepsia e neppure parametri di allarme, si potrà seguire un approccio terapeutico a più fasi, che potrebbe richiedere ulteriori valutazioni diagnostiche, come di seguito indicato. Inizialmente si potranno consigliare modifiche sia dello stile di vita, che alimentari. Nel caso di non risposta o di recidiva, e nel caso di una prevalente sintomatologia dolorosa o caratterizzata da fastidio epigastrico, si potrà verificare la presenza di Helicobacter pylori e, nei casi positivi, si eseguirà una terapia eradicante, mentre nei casi negativi si potrà trattare il paziente farmacologicamente. Nel caso invece di una prevalente sintomatologia con pirosi e rigurgiti, si tratterà il paziente farmacologicamente e, nel caso di recidiva, si effettuerà un test per verificare la presenza di Helicobacter pylori, oppure si continuerà con il trattamento, se efficace. In tutti i casi di insuccesso della terapia farmacologica, sarà comunque necessario eseguire una esofago-gastro-duodeno-scopia. Infine, nel caso in cui il paziente viva con ansia i suoi sintomi, anche se non vi sono motivi per ricorrere a esami di laboratorio e strumentali, può essere opportuno eseguirli allo scopo di rassicurarlo; fattori ambientali, psicologici e comportamentali, di scarso valore diagnostico, possono infatti influenzare in vario grado l’esposizione della sintomatologia da parte del paziente e il decorso della dispepsia funzionale, ed è pertanto importante ricercarli ed eventualmente trattarli perché possono interferire con la risposta al trattamento. Approccio terapeutico Una descrizione delle condizioni patologiche che possono essere correlate all’acidità gastrica e che sono indicazioni per la somministrazione dei farmaci inibitori della pompa protonica, in termini di approccio terapeutico consigliato. MALATTIA DA REFLUSSO GASTRO-ESOFAGEO ED ESOFAGITE DA REFLUSSO I pazienti con sintomi lievi possono essere trattati solo sulla base della sintomatologia, senza ricorrere a esami diagnostici; cambiamenti dietetici e dello stile di vita in aggiunta all’assunzione per brevi periodi di tempo di farmaci inibitori della pompa protonica o farmaci antagonisti del recettore istaminergico H2 possono essere sufficienti. Nei pazienti con sintomi debilitanti in grado di ridurre in maniera significativa la qualità della vita, la soppressione acida deve essere invece continuativa; la regressione della 36 sintomatologia può essere raggiunta iniziando con cambiamenti dietetici e dello stile di vita, e proseguendo con la terapia farmacologica che può essere somministrata a dosi crescenti sino al completo controllo dei sintomi oppure può essere somministrata da subito a dosi massimali riducendone successivamente la dose fino a quella minima efficace. Per quanto riguarda i cambiamenti dello stile di vita, importanti fattori di rischio associati alla MRGE sono l’alcol, il fumo, la predisposizione genetica e un aumento dell’indice di massa corporea, il quale si correla anche a un incremento statisticamente significativo di sintomi di MRGE, di esofagite erosiva, di esofago di Barrett, e di adenocarcinoma esofageo. Pertanto validi suggerimenti possono essere quelli di smettere di fumare e di ridurre l’assunzione di alcol, menta, cioccolato, caffè, cibi grassi e in generale pasti troppo abbondanti, oltre a riposare facendo in modo che il capo risulti essere in posizione più elevata rispetto al resto del corpo. Il trattamento più efficace per i sintomi da MRGE, con o senza esofagite, è la riduzione della secrezione acida, al fine di portare il pH gastrico al di sopra di 4 per almeno 12 ore. I farmaci inibitori della pompa protonica risultano superiori in efficacia ai farmaci antagonisti del recettore istaminergico H2 nel ridurre i sintomi da MRGE, nel curare l’esofagite, e nel mantenere la remissione. I farmaci antisecretivi, anche i più potenti, non curano tuttavia la vera causa del reflusso che è il rilasciamento inappropriato dello sfintere esofageo inferiore ma, inibendo la secrezione di acido, riducono l’acidità e la quantità di materiale che refluisce in esofago e hanno qualche efficacia anche se il materiale che refluisce è frammisto a bile. Gli agenti procinetici possono coadiuvare la soppressione della secrezione gastrica acida nel trattamento della MRGE; la loro efficacia è dovuta all’aumento della pressione dello sfintere esofageo inferiore e al miglioramento della peristalsi e dello svuotamento gastrico; tuttavia hanno un’efficacia limitata e presentano effetti collaterali, soprattutto extrapiramidali, per cui il loro uso non è consigliato per lunghi periodi di tempo o in monoterapia. Nei pazienti con sintomi tipici, come la pirosi e il rigurgito, ma senza segni macroscopici di esofagite all’indagine endoscopica (NERD), i farmaci inibitori della pompa protonica sono parzialmente efficaci; nelle forme di pirosi funzionale, essi non sono invece efficaci; nel caso di reflusso alcalino di tipo biliare, essi sono scarsamente efficaci al pari dei farmaci di barriera e quindi in alternativa può essere considerata l’opzione chirurgica, che è efficace anche nel caso di reflusso non acido. Nelle forme dominate da sintomi extra-esofagei, come l’asma, la tosse cronica, la raucedine, i farmaci inibitori della pompa protonica hanno un effetto inferiore. Il trattamento dei pazienti con esofago di Barrett è basato sugli stessi principi del trattamento dei pazienti con MRGE, anche se è suggerito un approccio che inizi con farmaci 37 inibitori della pompa protonica a dosaggio pieno, riducendone successivamente la dose per attestarsi a quella minima efficace: questo per garantire una soppressione costante della secrezione gastrica acida. La terapia a lungo termine ha come scopo principale quello di alleviare i sintomi, curare l’esofagite e prevenire le recidive e le complicanze. Tenuto conto della tendenza della MRGE a recidivare, spesso si ricorre a una terapia di mantenimento, anche a causa della frequente ricomparsa dei sintomi dopo la sospensione della terapia in acuto. Se i sintomi si ripresentano in un arco di tempo inferiore ai tre mesi, la terapia di mantenimento viene considerata necessaria e i farmaci inibitori della pompa protonica dovrebbero essere somministrati alla dose minima in grado di prevenire la ricomparsa dei sintomi; se i sintomi si ripresentano in un arco di tempo superiore ai tre mesi e in assenza di esofagite severa, è indicata la terapia al bisogno con farmaci inibitori della pompa protonica o farmaci antagonisti del recettore istaminergico H2. ULCERA PEPTICA: GASTRICA E DUODENALE Prima della scoperta dell’infezione da Helicobacter pylori, la terapia dell’ulcera peptica si basava esclusivamente sull’uso di farmaci capaci di ridurre l’acidità gastrica, che erano in grado di alleviare i sintomi e di permettere all’ulcera di cicatrizzarsi, ma non di modificare il decorso naturale della malattia ulcerosa caratterizzato dalla frequente comparsa di recidive. La scoperta dell’Helicobacter pylori ha modificato la terapia dell’ulcera gastrica e duodenale, che coincide oggi inevitabilmente con il trattamento eradicante l’infezione. Per il trattamento delle ulcere non-Helicobacter pylori correlate, i farmaci inibitori della pompa protonica sono quelli più efficaci. INFEZIONE DA HELICOBACTER PYLORI Numerosi sono i regimi terapeutici utilizzati nel trattamento dell’infezione da Helicobacter pylori. Attualmente una tra le terapie meglio tollerate e più efficaci, con percentuali di eradicazione superiori all’80%, è la cosiddetta triplice terapia: un inibitore di pompa protonica + claritromicina 500 mg + metronidazolo 500 mg o amoxicillina 1000 mg, somministrati due volte al giorno, per 1 settimana. L’antibiotico-resistenza dell’Helicobacter pylori alla claritromicina è la principale causa di fallimento della triplice terapia. Nei casi di fallimento, una delle terapie di seconda linea è la cosiddetta quadruplice terapia, che permette di eradicare l’Helicobacter pylori in circa il 90% dei soggetti in cui si è avuto il fallimento della triplice terapia: un inibitore di pompa protonica x 2 volte al giorno + bismuto 38 subcitrato 120 mg x 4 volte al giorno + tetraciclina 500 mg x 4 volte al giorno + metronidazolo 500 mg x 3 volte al giorno, per 1 settimana. GASTROPATIA EROSIVA ASSOCIATA A FANS I farmaci inibitori della pompa protonica si sono dimostrati altamente efficaci nella cicatrizzazione delle ulcere peptiche da FANS e nella prevenzione delle recidive e delle complicanze. Anche il misoprostolo, analogo sintetico della prostaglandina E1, si è dimostrato efficace nella prevenzione delle ulcere da FANS avendo un’azione gastro-protettrice; però deve essere somministrato ad alti dosaggi e ciò si associa frequentemente a effetti collaterali. Infine l’uso dei FANS selettivi nei confronti della COX-2 riduce il rischio di ulcere FANScorrelate e può essere preso in considerazione nei pazienti privi di patologie cardiovascolari, cerebrovascolari, e di vasculopatie. SINDROME DI ZOLLINGER-ELLISON L’asportazione chirurgica del gastronoma viene indicata da alcuni medici come il migliore trattamento dei sintomi dovuti alla sindrome di Zollinger-Ellison e le percentuali di guarigione si avvicinano al 40%. La valutazione pre-operatoria mira a localizzare i gastrinomi e a escludere le metastasi, in quanto l’intervento chirurgico è controindicato nei pazienti con una malattia metastatica non sottoponibile a resezione. Per il trattamento non chirurgico, i farmaci inibitori della pompa protonica sono i farmaci di scelta. La secrezione gastrica acida viene monitorata, con l’obiettivo di ridurre la secrezione acida basale a meno di 10 mEq/h, nei pazienti che non sono candidati alla chirurgia; a meno di 5 mEq/h, nei pazienti già sottoposti alla resezione gastrica; a meno di 1 mEq/h, nei pazienti con grave malattia da reflusso gastro-esofageo. L’octreotide è un farmaco appartenente a una classe diversa, essendo un analogo sintetico della somatostatina; esso determina una riduzione dei livelli della gastrina sierica e della secrezione gastrica acida, ma può essere somministrato solo per via parenterale e sembra non avere vantaggi rispetto ai farmaci inibitori della pompa protonica. Infine la chemioterapia con streptozocina e 5-fluorouracile diminuisce i livelli sierici della gastrina nei pazienti con malattia metastatica e, di solito, è riservata ai pazienti con metastasi epatiche per alleviare i sintomi. 39 DISPEPSIA FUNZIONALE Nella dispepsia funzionale, l’entità del disturbo dipende anche dalla componente psicoemotiva che accompagna i sintomi, per i quali spesso il paziente non è in grado di dare una giustificazione causale. La risposta del paziente può quindi essere favorevolmente influenzata da un corretto approccio del medico, sia nella fase diagnostica, che in quella terapeutica. È necessario eliminare convinzioni errate spiegando in maniera semplice e comprensibile la natura dei sintomi, porre una diagnosi in modo convincente, e rassicurare il paziente focalizzandosi su ciò che lo preoccupa e dando spiegazioni esaurienti riguardo i suoi timori. L’approccio farmacologico non è univoco a causa dell’incerta eziopatogenesi, alla quale possono concorrere diversi fattori. Nell’ambito di un’ampia scelta di farmaci disponibili per la dispepsia funzionale, i seguenti gruppi di farmaci sono quelli generalmente più utilizzati, singolarmente o in combinazione: i farmaci inibitori della secrezione gastrica acida, i farmaci procinetici e i farmaci sedativi e antidepressivi a basse dosi. Qualunque sia la scelta terapeutica, è comunque consigliabile evitare trattamenti protratti nel tempo e preferire, nei pazienti con frequenti recrudescenze della sintomatologia, trattamenti di breve durata ripetuti nel tempo. FARMACI PER TRATTARE I DISTURBI CORRELATI ALL’ACIDITÀ GASTRICA Una descrizione delle classi di farmaci utilizzabili per trattare le condizioni patologiche che possono essere correlate all’acidità gastrica. Per ciascuna classe di farmaci si forniscono: i principi attivi più utilizzati, il caratteristico meccanismo d’azione e le informazioni principali inerenti gli aspetti farmacologici (farmacocinetica e farmacodinamica). In base alla “Classificazione Anatomica Terapeutica Chimica dei medicinali” (ATC), i farmaci per il gruppo anatomico “Apparato gastro-intestinale e metabolismo” e relativi al gruppo terapeutico “Farmaci per disturbi correlati all’acidità” vengono suddivisi in 3 sottogruppi terapeutici: • i farmaci antiacidi, • i farmaci antiulcera peptica e malattia da reflusso gastro-esofageo, • e gli altri farmaci per disturbi correlati all’acidità [l’unico rappresentante di quest’ultimo sottogruppo terapeutico è l’associazione tra glucosio anidro, potassio citrato e piridossina: una miscela gluco-salino-vitaminica, 40 che svolge anche un’attività neutralizzante l’acidità gastrica per azione del bicarbonato di sodio (NaHCO3), il quale si forma anche per metabolizzazione dell’acido citrico dopo l’assorbimento sistemico]. Farmaci antiacidi Una descrizione della classe dei farmaci antiacidi in termini di: principi attivi più utilizzati, meccanismo d’azione e informazioni inerenti gli aspetti farmacologici (farmacocinetica e farmacodinamica). I farmaci antiacidi comprendono: composti del magnesio; associazioni fra composti di alluminio, calcio e magnesio; antiacidi associati ad antimeteorici; antiacidi in associazione con spasmolitici; antiacidi in associazione con bicarbonato di sodio; e altre associazioni di antiacidi. Sebbene consacrati dalla tradizione, questi farmaci sono stati ampiamente sostituiti da altri più efficaci e convenienti; tuttavia essi continuano a essere utilizzati dai pazienti per varie indicazioni. Molti fattori ne influenzano l’efficacia e la scelta, tra cui la gradevolezza al gusto. Il bicarbonato di sodio (NaHCO3), sebbene neutralizzi di fatto l’acido, è molto solubile in acqua, viene rapidamente assorbito dallo stomaco, e il conseguente carico di prodotti alcalini e di sodio può rappresentare un rischio per i pazienti affetti da insufficienza renale o da insufficienza cardiaca. A seconda della grandezza delle particelle e della struttura del cristallo, il carbonato di calcio (CaCO3) neutralizza rapidamente ed efficacemente gli ioni idrogeno (H+) gastrici, ma il calcio può anche indurre una secrezione acida di rimbalzo, determinando la necessità di più frequenti somministrazioni. Un problema comune è il conseguente rilascio di anidride carbonica (CO2) dai farmaci antiacidi a base di bicarbonato e carbonato, che può causare eruttazione, gonfiore addominale, flatulenza e nausea. Le combinazioni di idrossido di magnesio [Mg(OH)2], che agisce rapidamente, e di idrossido di alluminio [Al(OH)3], che agisce lentamente, garantiscono una capacità di neutralizzazione relativamente bilanciata e prolungata, ed esse sono preferite dalla maggior parte degli esperti. Il magaldrato è un complesso che viene convertito rapidamente nell’ambiente acido gastrico in idrossido di magnesio [Mg(OH)2] e idrossido di alluminio [Al(OH)3], i quali sono scarsamente assorbiti e pertanto forniscono un prolungato effetto antiacido. Sebbene in teoria le combinazioni di magnesio e di alluminio neutralizzino gli eventi avversi a carico dell’intestino uno dell’altro [in quanto lo ione alluminio (Al3+) può rilassare la muscolatura liscia gastrica, determinando un ritardato svuotamento gastrico e 41 costipazione, mentre lo ione magnesio (Mg2+) esercita effetti opposti], nella pratica tale equilibrio non è sempre raggiunto. Il simeticone, un surfattante che può diminuire la formazione di schiuma e quindi il reflusso esofageo, viene incluso in molte preparazioni antiacido. Di seguito vengono riportate alcune caratteristiche comuni a questa classe di farmaci. La relativa efficacia delle preparazioni antiacido è espressa in termini di capacità di neutralizzare milli-equivalenti di acido; a causa delle discrepanze tra le capacità di neutralizzare in vitro e in vivo, i dosaggi di questi farmaci sono titolati in pratica sulla base del sollievo che possono dare alla sintomatologia. Per ulcere non complicate, i farmaci antiacidi vengono somministrati per via orale 1-3 ore dopo i pasti e al momento di coricarsi; per sintomi severi o in caso di reflusso non controllato, possono essere somministrati più frequentemente. In generale, essi dovrebbero essere assunti in forma di sospensione, perché questa ha probabilmente una capacità neutralizzante superiore rispetto alle forme farmaceutiche in polvere o in compresse; se queste ultime vengono utilizzate, esse dovrebbero essere completamente masticate per avere un effetto massimale. I farmaci antiacidi sono eliminati dallo stomaco vuoto in circa 30 minuti, ma la presenza di cibo è sufficiente a elevare il pH gastrico a un valore di circa 5 per circa 1 ora e a prolungare l’effetto neutralizzante dei farmaci antiacidi per circa 2-3 ore. Il grado di assorbimento nell’organismo di questi farmaci varia e pertanto variano i loro effetti sistemici. I farmaci che contengono ioni alluminio (Al3+), ioni calcio (Ca2+), o ioni magnesio (Mg2+) vengono assorbiti meno completamente di quelli che contengono bicarbonato di sodio (NaHCO3). Con una funzione renale normale, i modesti accumuli di ioni alluminio (Al3+) e di ioni magnesio (Mg2+) non determinano alcun problema, ma in presenza di insufficienza renale gli ioni alluminio (Al3+) assorbiti possono contribuire all’osteoporosi, all’encefalopatia, e alla miopatia prossimale. Circa il 15% di una dose somministrata per via orale di ioni calcio (Ca2+) viene assorbita, causando un’ipercalcemia transitoria; sebbene ciò non costituisca un problema in pazienti normali, essa può causare problemi in pazienti affetti da uremia [UREMIA = complesso sintomo dovuto a insufficienza renale e caratterizzato tra le varie alterazioni anche da iperazotemia, acidosi, iperfosfatemia, iperkaliemia, e ipocalcemia]. In passato, quando grandi dosi di bicarbonato di sodio (NaHCO3) e carbonato di calcio (CaCO3) venivano somministrate con il latte per la gestione dell’ulcera peptica, la sindrome latte-alcali, rappresentata da alcalosi metabolica con ipercalcemia e insufficienza renale, si poteva verificare frequentemente, ma attualmente questa sindrome è rara. 42 In generale, molti farmaci antiacidi possono aumentare il pH urinario di circa un’unità. Alterando il pH gastrico e urinario, essi possono dar luogo a interazioni con un certo numero di altri farmaci, quali gli ormoni tiroidei, l’allopurinolo, e i farmaci antifungini imidazolici, di cui alterano la velocità di dissoluzione e di assorbimento, la biodisponibilità e l’eliminazione renale. Inoltre i farmaci antiacidi a base di ioni magnesio (Mg2+) e di ioni alluminio (Al3+) tendono a chelare eventuali altre sostanze ad azione farmacologica presenti nel tratto gastro-intestinale, formando complessi insolubili che vengono eliminati senza essere assorbiti. Pertanto è generalmente prudente evitare la concomitante somministrazione di farmaci antiacidi e di farmaci destinati a un assorbimento sistemico, cercando di assumere i farmaci antiacidi almeno due ore prima o dopo in modo da evitare possibili interazioni. Farmaci antiulcera peptica e malattia da reflusso gastro-esofageo Una descrizione della classe dei farmaci antiulcera peptica e malattia da reflusso gastroesofageo, in termini di: sottoclassi principali e relativi principi attivi più utilizzati, meccanismo d’azione e informazioni inerenti gli aspetti farmacologici (farmacocinetica e farmacodinamica). I farmaci antiulcera peptica e malattia da reflusso gastro-esofageo comprendono: le prostaglandine; i farmaci antagonisti del recettore istaminergico H2; i farmaci inibitori della pompa protonica; e gli altri farmaci antiulcera peptica e malattia da reflusso gastro-esofageo. PROSTAGLANDINE Una descrizione della sottoclasse delle prostaglandine in termini di: principi attivi più utilizzati, meccanismo d’azione, e informazioni inerenti gli aspetti farmacologici (farmacocinetica e farmacodinamica). Il farmaco rappresentante di questo sottogruppo terapeutico-chimico è il misoprostolo. La prostaglandina E2 (PGE2) e la prostaciclina (PGI2) sono le più importanti prostaglandine sintetizzate dalla mucosa gastrica; esse si legano al recettore EP3 delle cellule parietali, stimolando un meccanismo inibitorio che diminuisce l’AMP ciclico intracellulare e quindi la secrezione gastrica acida. La prostaglandina E2 (PGE2) può anche prevenire il danno gastrico attraverso effetti citoprotettivi, che includono la stimolazione della secrezione di mucina [MUCINA = glicoproteina presente nel muco] e di ioni bicarbonato (HCO3-) e un aumentato flusso sanguigno mucosale. Dal punto di vista clinico, l’effetto tuttavia più importante sembra essere la soppressione della secrezione acida. 43 Il misoprostolo è un analogo sintetico della prostaglandina E1 (PGE1), avente precise modificazioni strutturali che ne aumentano la biodisponibilità per via orale, la potenza, la durata dell’effetto antisecretivo e la sicurezza. Il grado di inibizione della secrezione gastrica acida è direttamente correlato alla dose di misoprostolo, che presenta un regime posologico di 4 assunzioni giornaliere. Esso viene rapidamente assorbito dopo la somministrazione orale e quindi ampiamente metabolizzato a formare il metabolita principale e attivo del farmaco: parte di questa trasformazione può avvenire nelle cellule parietali stesse. Una singola dose inibisce la produzione di acido entro 30 minuti; l’effetto terapeutico raggiunge l’apice a 60-90 minuti e può durare fino a 3 ore. Il cibo e i farmaci antiacidi riducono la velocità di assorbimento del misoprostolo, determinando un ritardato e diminuito picco nelle concentrazioni plasmatiche del metabolita attivo, che viene escreto principalmente nelle urine. La diarrea, con o senza dolore addominale e crampi, si può verificare in circa il 30% dei pazienti che assumono misoprostolo; apparentemente dose correlata, si manifesta tipicamente entro le prime 2 settimane dopo l’inizio del trattamento e spesso si risolve spontaneamente entro 1 settimana; i casi più severi o che si protraggono possono richiedere la sospensione della terapia. Il misoprostolo può causare esacerbazioni cliniche della malattia infiammatoria intestinale e dovrebbe essere evitato in pazienti con questa patologia. È anche controindicato durante la gravidanza, perché può aumentare la contrattilità uterina. L’uso terapeutico del misoprostolo è per prevenire il danno mucosale causato dai FANS: poiché i FANS diminuiscono la formazione di prostaglandine, analoghi sintetici delle prostaglandine rappresentano un logico approccio nel tentativo di ridurre il danno mucosale causato da questi farmaci; tuttavia esso viene usato in modo limitato a causa dei suoi effetti collaterali e del poco pratico regime posologico che richiede 4 somministrazioni giornaliere. FARMACI ANTAGONISTI DEL RECETTORE ISTAMINERGICO H2 Una descrizione della sottoclasse dei farmaci antagonisti del recettore istaminergico H2 in termini di: principi attivi più utilizzati, meccanismo d’azione e informazioni inerenti gli aspetti farmacologici (farmacocinetica e farmacodinamica). I farmaci appartenenti a questo sottogruppo terapeutico-chimico sono: cimetidina, famotidina, nizatidina, ranitidina, roxatidina, e associazioni di famotidina. La descrizione di un blocco selettivo del recettore istaminergico H2 fu un evento epocale nel trattamento della malattia acido-peptica; infatti, prima della disponibilità di questi farmaci, il trattamento abituale consisteva semplicemente nella neutralizzazione dell’acido nel lume 44 dello stomaco, solitamente con risultati non sufficienti; tuttavia, nella pratica clinica attuale, questi farmaci vengono sostituiti sempre più da altri principi attivi ancora più potenti, quali i farmaci inibitori della pompa protonica. I farmaci antagonisti del recettore istaminergico H2 inibiscono la produzione di acido competendo in modo reversibile con l’istamina per il legame ai recettori istaminergici H2 sulla membrana baso-laterale delle cellule parietali. Diversi farmaci di questo sottogruppo sono presenti in commercio, e differiscono principalmente nelle loro proprietà farmacocinetiche e nella loro tendenza a causare interazione con altri farmaci. Essi sono meno potenti dei farmaci inibitori della pompa protonica, ma sopprimono pur sempre la secrezione gastrica acida nelle 24 ore di circa il 70% e prevalentemente inibiscono la secrezione acida basale, fatto che spiega la loro efficacia nel sopprimere la secrezione acida notturna. Questi farmaci sono disponibili in formulazioni per via orale, ma possono essere somministrati anche in boli endovenosi intermittenti o per infusione endovenosa continua, quest’ultima in grado di controllare meglio il pH gastrico. Formulazioni per via endovenosa sono utilizzabili per cimetidina, famotidina, nizatidina e ranitidina, seppur in Italia, a febbraio 2012, risulti disponibile solo una preparazione per via endovenosa della ranitidina. I farmaci antagonisti del recettore istaminergico H2 sono rapidamente assorbiti dopo somministrazione orale, con concentrazioni sieriche di picco entro 1-3 ore; livelli terapeutici sono raggiunti velocemente dopo somministrazione endovenosa e vengono mantenuti per un periodo di tempo variabile dalle 4 alle 11 ore, a seconda del principio attivo. Solo una piccola percentuale di questi farmaci si lega alle proteine. Piccole quantità, da meno del 10% a circa il 35%, sottostanno a metabolismo epatico, ma la malattia epatica non richiede aggiustamenti di dosaggio. I reni invece sono responsabili della eliminazione di questi farmaci e dei loro metaboliti per filtrazione e secrezione tubulare renale, ed è quindi importante ridurre i dosaggi in pazienti con ridotta clearance della creatinina: infatti né l’emodialisi, né la dialisi peritoneale sono in grado di rimuovere significative quantità di questi farmaci. I farmaci antagonisti del recettore istaminergico H2 sono generalmente ben tollerati, con una minima incidenza di effetti collaterali (inferiore al 3%); tali effetti generalmente non sono gravi e includono: diarrea, mal di testa, sonnolenza, stanchezza, dolore muscolare e costipazione; tra gli effetti collaterali meno comuni vi sono quelli a carico del Sistema Nervoso Centrale (confusione, delirio, allucinazioni), che si verificano principalmente con la somministrazione endovenosa o nei pazienti anziani. L’utilizzo di questi farmaci può 45 comportare varie anomalie del sangue, tra cui la trombocitopenia. Essi attraversano la placenta e vengono secreti nel latte materno; sebbene non ci sia un rischio teratogeno di primaria importanza, tuttavia cautela è richiesta quando devono essere usati in gravidanza. Tutte le sostanze che inibiscono la secrezione gastrica acida possono alterare la velocità di assorbimento e la successiva biodisponibilità dei farmaci antagonisti del recettore istaminergico H2. Per quanto riguarda invece le interazioni farmacologiche date da questi farmaci, esse avvengono principalmente con la cimetidina e per questo il suo utilizzo è diminuito marcatamente; ciò è dovuto al fatto che tale principio attivo inibisce alcuni citocromi P450 epatici e così può aumentare i livelli di una varietà di altri farmaci che sono substrati di questi stessi enzimi. Anche la ranitidina interagisce con i citocromi P450 epatici, ma con un’affinità solo del 10% rispetto a quella della cimetidina e pertanto l’interferenza con il metabolismo epatico degli altri farmaci è minima. La famotidina e la nizatidina sono persino più sicure a tal proposito, non avendo significative interazioni farmacologiche mediate dall’inibizione dei citocromi P450 epatici. Le principali indicazioni terapeutiche per i farmaci antagonisti del recettore istaminergico H2 sono il trattamento della malattia da reflusso gastro-esofageo non complicata, la cicatrizzazione delle ulcere gastrica e duodenale e la prevenzione della comparsa delle ulcere da stress. ALTRI FARMACI ANTIULCERA PEPTICA E MALATTIA DA REFLUSSO GASTROESOFAGEO Una descrizione della sottoclasse degli altri farmaci antiulcera peptica e malattia da reflusso gastro-esofageo in termini di: principi attivi più utilizzati, meccanismo d’azione e informazioni inerenti gli aspetti farmacologici (farmacocinetica e farmacodinamica). Prima di affrontare i farmaci inibitori della pompa protonica, si tratta questo sottogruppo terapeutico-chimico, che include: sucralfato, bismuto subcitrato, sulglicotide e acido alginico. Il sucralfato consiste di una molecola di saccarosio combinata con 8 gruppi solfato e con idrossido di alluminio (Al(OH)3). In presenza di un danno indotto dall’acido, l’idrolisi delle proteine della mucosa mediata dalla pepsina contribuisce all’erosione mucosale e alle ulcerazioni: questo processo può essere inibito da polisaccaridi solfati. In ambiente acido con pH inferiore a 4, il sucralfato sottostà a un esteso processo di reticolazione, producendo un polimero viscoso e colloso che aderisce alle cellule epiteliali e ai crateri dell’ulcera per un periodo di tempo fino a 6 ore dopo ogni singola dose. Oltre all’inibizione dell’idrolisi delle proteine mucosali da parte della pepsina, esso potrebbe avere ulteriori effetti citoprotettivi, 46 inclusa una stimolazione della produzione locale di prostaglandine e di fattori di crescita, e inoltre è anche in grado di legarsi ai sali biliari. Essendo attivato dall’acido, il sucralfato dovrebbe essere assunto a stomaco vuoto, un’ora prima dei pasti; per lo stesso motivo, l’uso di farmaci antiacidi nei 30 minuti dopo l’assunzione di sucralfato dovrebbe essere evitato. La posologia abituale può variare da due a quattro somministrazioni al giorno. L’uso terapeutico del sucralfato per trattare la malattia acido-peptica è diminuito negli ultimi anni; tuttavia, poiché l’aumentato pH gastrico potrebbe essere uno dei fattori coinvolti nello sviluppo di polmoniti acquisite in ospedale in pazienti gravemente debilitati, esso può offrire un’alternativa terapeutica rispetto ai farmaci inibitori della pompa protonica e ai farmaci antagonisti del recettore istaminergico H2 nella profilassi delle ulcere da stress. A causa del suo unico meccanismo d’azione, esso è stato utilizzato anche in diverse altre condizioni associate all’infiammazione o all’ulcerazione mucosale che potrebbero non rispondere alla soppressione della secrezione acida, inclusa la gastropatia da reflusso biliare. Il più comune effetto collaterale è la costipazione, che incide in circa il 2% dei casi. Poiché parte dell’alluminio può essere assorbito, esso dovrebbe essere evitato in pazienti con insufficienza renale che sono a rischio di sovraccarico di alluminio; allo stesso modo farmaci antiacidi contenenti alluminio dovrebbero non essere combinati con il sucralfato in questi pazienti. Il sucralfato forma un viscoso strato nello stomaco che potrebbe inibire l’assorbimento di altri farmaci, inclusi la fenitoina, la digossina, la cimetidina, il ketoconazolo e gli antibiotici fluorochinolonici; dovrebbe pertanto essere assunto almeno due ore dopo la somministrazione di altri farmaci. Infine, in modo conciso, si riassumono gli altri principi attivi di questo sottogruppo terapeutico-chimico. • Bismuto subcitrato (biskalammonio citrato): è una sostanza colloidale, solubile in acqua, che giunta nell’ambiente acido dello stomaco si lega in corrispondenza dell’ulcera creando un rivestimento protettivo; non neutralizza le secrezioni gastriche, ma stimola la produzione di ioni bicarbonato (HCO3-) e di mucina e ha un’azione antibatterica nei confronti dell’Helicobacter pylori; l’utilizzo più frequente è nelle terapie combinate, associato a un antibiotico e a un farmaco antisecretivo, per l’eradicazione dell’Helicobacter pylori. • Sulglicotide: è un glicopeptide solfato, chimicamente correlato alle glicoproteine presenti nel succo gastrico responsabili della difesa della mucosa gastro-duodenale; le ipotesi circa il suo meccanismo d’azione sono almeno tre: 1) un’azione citoprotettiva a livello 47 gastro-duodenale mediante l’aumento della normale biosintesi delle prostaglandine, 2) un antagonismo dell’ipersecrezione gastrica indotta dai più comuni mediatori, e 3) un’azione anti-peptica per combinazione con la pepsina e formazione di un complesso meno attivo. • Acido alginico: dopo l’assunzione, la sostanza reagisce rapidamente con l’acido gastrico formando una barriera tipo gel di acido alginico, che possiede un pH quasi neutro e che galleggia sul contenuto dello stomaco per un periodo di tempo fino a 4 ore, impedendo efficacemente il reflusso gastro-esofageo; nei casi di reflusso severo, la barriera stessa può essere spinta in esofago al posto del contenuto gastrico, esercitando un effetto emolliente. I FARMACI INIBITORI DELLA POMPA PROTONICA Una descrizione della classe dei farmaci inibitori della pompa protonica in termini di: principi attivi, chimica, meccanismo d’azione, formulazioni farmaceutiche, farmacocinetica, effetti collaterali, avvertenze e interazioni farmacologiche. I farmaci appartenenti a questo sottogruppo terapeutico-chimico sono: esomeprazolo, lansoprazolo, omeprazolo, pantoprazolo e rabeprazolo. Essi rappresentano i più potenti soppressori della secrezione gastrica acida, inibendo la H+/K+-ATPasi gastrica, cioè la pompa protonica: alle dosi tipicamente utilizzate, questi farmaci diminuiscono la produzione giornaliera di acido (basale e stimolata) dell’80-95%. Chimica L’omeprazolo (una miscela racemica degli enantiomeri R ed S), l’esomeprazolo (l’enantiomero S dell’omeprazolo), il lansoprazolo, il pantoprazolo e il rabeprazolo hanno una struttura chimica di base simile, differendo essenzialmente nei loro sostituenti a livello della piridina e del gruppo benzimidazolico. Esomeprazolo: R0= H R1= CH3O R2= CH3 R3= CH3O R4= CH3 Lansoprazolo: R0= H R1= H R2= H R3= CF3CH2O R4= CH3 Omeprazolo: R1= CH3O R2= CH3 R3= CH3O R4= CH3 Pantoprazolo: R0= CHF2O R1= H R2= H R3= CH3O R4= CH3O Rabeprazolo: R1= H R2= H R3= CH3O(CH2)3O R4= CH3 R0= H R0= H 48 I diversi sostituenti contribuiscono a determinare differenti proprietà farmacocinetiche, tra cui la biodisponibilità per via orale, il legame alle proteine plasmatiche, il volume di distribuzione, la massima concentrazione plasmatica e il tempo richiesto per ottenerla, il tempo richiesto affinché la concentrazione plasmatica si dimezzi (emivita), la rimozione sistemica dal sangue e l’escrezione urinaria del farmaco immodificato. A titolo di esempio, l’enantiomero S dell’omeprazolo (esomeprazolo) viene eliminato meno rapidamente dell’enantiomero R, e ciò fornisce teoricamente un vantaggio terapeutico a causa dell’aumentata emivita. Meccanismo d’azione I farmaci inibitori della pompa protonica sono pro-farmaci, che richiedono un’attivazione in ambiente acido. Dopo l’assorbimento nella circolazione sistemica, il pro-farmaco diffonde nelle cellule parietali dello stomaco e si accumula nei canalicoli secretori dell’acido. Qui viene attivato attraverso un processo catalizzato da protoni, che porta dapprima alla formazione di un derivato acido sulfenico e quindi alla formazione di una sulfenamide tetraciclica: in questo modo il farmaco viene trattenuto e non può più diffondere indietro attraverso la membrana canalicolare. La forma attivata si lega covalentemente con i gruppi sulfidrilici delle cisteine della H+/K+-ATPasi, inattivando irreversibilmente la pompa protonica. La secrezione acida riprende solo dopo che nuove molecole di H+/K+-ATPasi vengono sintetizzate e inserite nella membrana luminale delle cellule parietali: in questo modo si ottiene una prolungata (fino a 24-48 ore) soppressione della secrezione acida, nonostante le emivite plasmatiche dei composti originari siano molto più brevi (da 0,5 a 2 ore). Dal momento che bloccano il passaggio finale della produzione di acido, questi farmaci sono efficaci nella soppressione della secrezione acida indipendentemente dalla presenza di altri fattori stimolanti. Nel complesso, i farmaci inibitori della pompa protonica risultano essere notevolmente simili nelle loro proprietà farmacologiche: nonostante affermazioni tendano a rivendicare il contrario, sembra infatti che i diversi farmaci di questa classe abbiano un’efficacia equivalente a dosaggi comparabili. Numerosi studi hanno messo a confronto questi principi attivi, confermando che esistono differenze sul livello di inibizione della secrezione gastrica acida da essi indotta, anche se nella maggior parte dei casi a queste differenze non sembra corrispondere un reale significato clinico. 49 Formulazioni farmaceutiche I farmaci inibitori della pompa protonica sono acido-labili e, per prevenirne la degradazione da parte dell’acido nel lume gastrico, le forme farmaceutiche per la somministrazione orale possono essere disponibili in formulazioni differenti: • farmaci rivestiti con un rivestimento gastro-resistente (cioè costituito da un materiale che permetta il transito del farmaco attraverso lo stomaco fino all’intestino tenue, prima che lo stesso venga rilasciato), contenuti all’interno di capsule di gelatina; • granuli rivestiti con un rivestimento gastro-resistente, forniti come una polvere per sospensione; • compresse rivestite con un rivestimento gastro-resistente. Le compresse a rilascio ritardato e rivestite con un rivestimento gastro-resistente si sciolgono solo a pH alcalino: ciò migliora sostanzialmente la biodisponibilità per via orale di questi farmaci acido-labili. È importante che l’assunzione di queste forme farmaceutiche con rivestimento gastroresistente avvenga senza la distruzione del rivestimento protettivo stesso: pertanto i granuli, le compresse o le capsule dotate di rivestimento gastro-resistente devono essere deglutite senza masticarle o frantumarle. Le capsule possono eventualmente essere aperte e i granuli in esse contenuti ingeriti con acqua, senza masticarli o frantumarli. I pazienti che non possono assumere i farmaci inibitori della pompa protonica per via orale, così come quelli che richiedono un’immediata soppressione della secrezione acida, possono ora essere trattati per via parenterale con esomeprazolo, lansoprazolo, o pantoprazolo, che sono approvati per la somministrazione endovenosa negli USA, mentre in Italia, a febbraio 2012, risultano disponibili preparazioni per via endovenosa di esomeprazolo, omeprazolo e pantoprazolo. Un singolo bolo endovena di 80 mg di pantoprazolo inibisce la produzione di acido dell’80-90% entro un’ora e questa inibizione persiste per un periodo di tempo fino a 21 ore, permettendo un dosaggio di una somministrazione al giorno per raggiungere il desiderato grado di ipocloridria [IPOCLORIDRIA = diminuita secrezione gastrica di acido cloridrico]. Farmacocinetica Questi farmaci dovrebbero essere assunti in condizioni ideali circa 30 minuti prima dei pasti, poiché il cibo stimola la produzione di acido e un pH acido nei canalicoli della cellula parietale è necessario per la loro attivazione. La contemporanea assunzione di cibo potrebbe un po’ ridurre la velocità di assorbimento, ma questo effetto non è ritenuto essere 50 clinicamente significativo. La somministrazione contemporanea di altri farmaci che inibiscano la secrezione acida potrebbe invece ridurre l’efficacia dei farmaci inibitori della pompa protonica, ma l’importanza clinica di questa potenziale interazione non è del tutto nota. Una volta raggiunto l’intestino tenue, questi farmaci sono assorbiti rapidamente, vengono legati ampiamente dalle proteine e sono metabolizzati estensivamente dai citocromi P450 epatici, in particolare CYP2C19 e CYP3A4. Diverse varianti del CYP2C19 sono state identificate; per gli Asiatici c’è una probabilità superiore rispetto agli uomini di razza bianca o agli Americani di origine africana (23% contro 3%, rispettivamente) di avere il genotipo del CYP2C19 che si correla con un lento metabolismo dei farmaci inibitori della pompa protonica, fattore che sembra contribuire all’aumentata efficacia e/o tossicità in questo gruppo etnico. Sebbene il genotipo del CYP2C19 sia correlato con l’ampiezza della soppressione gastrica acida da parte dei farmaci inibitori della pompa protonica, non c’è evidenza che esso sia predittivo dell’efficacia clinica di questi farmaci. Siccome non tutte le H+/K+-ATPasi o non tutte le cellule parietali sono attive nello stesso istante, la massima soppressione della secrezione acida richiede diverse somministrazioni di farmaci inibitori della pompa protonica. Per esempio, possono essere necessari 2-5 giorni di terapia con una somministrazione di una volta al giorno per raggiungere il 70% di inibizione delle pompe protoniche, osservabile allo stato di equilibrio. Somministrazioni iniziali più frequenti (per esempio due volte al giorno) ridurranno il periodo di tempo necessario per raggiungere una completa inibizione, ma non è dimostrato che migliorino l’esito del trattamento nei confronti del paziente. Questo ritardo nella massima inibizione della secrezione di acido con i farmaci inibitori della pompa protonica (2-5 giorni) li rende meno adatti a un uso “al bisogno” per avere un sollievo rapido della sintomatologia; a tale scopo, i farmaci antagonisti del recettore istaminergico H2, sebbene meno efficaci nel sopprimere la secrezione di acido, hanno un inizio d’azione più rapido e sono più utili per la gestione di sintomi lievi o poco frequenti. La malattia epatica riduce sostanzialmente la clearance dei farmaci inibitori della pompa protonica, e pertanto in pazienti con patologia epatica grave una riduzione del dosaggio può essere raccomandata e dovrebbe essere presa in considerazione. L’insufficienza renale cronica invece non determina accumulo di farmaci inibitori della pompa protonica se la somministrazione avviene una volta al giorno; tuttavia una particolare attenzione deve essere prestata se i principi attivi utilizzati sono l’esomeprazolo o il pantoprazolo. 51 Effetti collaterali I farmaci inibitori della pompa protonica in generale determinano pochi effetti collaterali. I più comuni sono: nausea, vomito, dolore addominale, costipazione, flatulenza e diarrea; sono stati inoltre segnalati: cefalea, vertigine, miopatia, artralgia, eruzioni cutanee; meno frequentemente: insonnia, malessere, prurito, secchezza delle fauci, sonnolenza, visione offuscata. L’uso cronico di farmaci inibitori della pompa protonica è stato associato a un aumentato rischio di frattura ossea: rari casi di demineralizzazione calcica sono stati descritti, i quali possono portare a frattura della testa del femore; tuttavia non vi sono ancora dati a sufficienza per consigliare ai pazienti in terapia prolungata con questi farmaci la densitometria ossea o l’integrazione della dieta con supplementi di calcio. L’uso cronico di farmaci inibitori della pompa protonica è stato associato anche a un’aumentata predisposizione a certe infezioni (quali per esempio le polmoniti acquisite a livello ospedaliero e le infezioni da Clostridium difficile acquisite in comunità). Negli ultimi anni è stato sollevato il dubbio che i potenti farmaci antisecretivi disponibili possano favorire la crescita di una flora batterica nel tratto digestivo superiore, attraverso l’innalzamento prolungato del pH gastrico. Vari studi hanno confermato che questi farmaci alterano la popolazione batterica gastro-intestinale, ma l’evidenza che questo determini rilevanti conseguenze cliniche è attualmente limitata. Oltre alle possibili infezioni intestinali, può essere presente anche il rischio di un’aumentata incidenza di infezioni a livello extraintestinale; tuttavia anche l’evidenza che la terapia con i farmaci inibitori della pompa protonica causi infezioni al di fuori dell’apparato digerente sembra essere limitata. La cronica soppressione della secrezione acida può peggiorare il decorso di una gastrite cronica in presenza di un’infezione da Helicobacter pylori, con conseguente rischio di una gastrite atrofica; pertanto l’eradicazione dell’Helicobacter pylori dovrebbe essere raccomandata. Il trattamento cronico con omeprazolo diminuisce l’assorbimento di vitamina B12, ma l’importanza clinica di questo effetto non è chiara; tuttavia potrebbe essere consigliato controllare periodicamente il livello di vitamina B12. L’ipergastrinemia, più frequente e più severa con i farmaci inibitori della pompa protonica rispetto ai farmaci antagonisti del recettore istaminergico H2, può predisporre a una ipersecrezione gastrica acida di rimbalzo alla sospensione della terapia e potrebbe anche promuovere lo sviluppo di tumori gastro-intestinali. È ben documentata la tolleranza (intesa come riduzione degli effetti di un farmaco dovuta a una prolungata somministrazione nel tempo) agli effetti soppressivi della secrezione acida, di 52 cui sono responsabili i farmaci antagonisti del recettore istaminergico H2. Essa potrebbe spiegare il ridotto effetto terapeutico durante le somministrazioni protratte di questi farmaci. Può svilupparsi entro 3 giorni dall’inizio del trattamento e può essere resistente all’incremento di dosaggio del principio attivo. La causa sarebbe da ricercarsi nell’ipergastrinemia secondaria, che si instaura al fine di stimolare il rilascio di istamina dalle cellule entero-cromaffini-simili. I farmaci inibitori della pompa protonica, sebbene determinino maggiori innalzamenti della gastrina endogena, non portano a questo fenomeno, probabilmente perché il loro sito d’azione è distale rispetto all’azione dell’istamina sul rilascio di acido. Avvertenze I farmaci inibitori della pompa protonica possono mascherare i sintomi del cancro gastrico, pertanto la sua presenza deve essere esclusa prima dell’inizio del trattamento; inoltre particolare attenzione deve essere posta anche in caso di modificazione della sintomatologia in corso di trattamento. In presenza di sintomi allarmanti (quali disfagia, ematemesi, melena, perdita di peso significativa e non intenzionale, vomito ricorrente) e quando si sospetta o è confermata la presenza di un’ulcera gastrica, la natura maligna dell’ulcera deve essere esclusa, in quanto la terapia con i farmaci inibitori della pompa protonica potrebbe alleviare i sintomi e ritardare una diagnosi. I pazienti trattati per un lungo periodo di tempo, in particolare quelli sottoposti a trattamento per più di un anno, devono essere controllati regolarmente. Inoltre i pazienti in regime terapeutico di trattamento al bisogno devono essere istruiti a contattare il loro medico qualora i sintomi avvertiti dovessero assumere un carattere diverso. Infine i farmaci inibitori della pompa protonica dovrebbero essere usati con cautela, quando consentito, nei pazienti con insufficienza epatica, nei pazienti con insufficienza renale (esomeprazolo e pantoprazolo), nelle pazienti in gravidanza, e nelle pazienti durante l’allattamento. Interazioni farmacologiche I farmaci inibitori della pompa protonica sono metabolizzati dai citocromi P450 epatici e quindi possono interferire con l’eliminazione di altri farmaci che sottostanno alla stessa via metabolica. Tra i farmaci inibitori della pompa protonica, solo l’omeprazolo inibisce il CYP2C19, determinando pertanto una riduzione della rimozione di farmaci quali disulfiram, fenitoina e 53 altri, e induce l’espressione del CYP1A2, determinando quindi un aumento della rimozione di farmaci quali imipramina, teofillina e diversi farmaci antipsicotici. Inoltre c’è un’emergente evidenza che l’omeprazolo possa interagire sfavorevolmente con il farmaco anticoagulante clopidogrel a livello del CYP2C19 di cui entrambi sono substrati, nel senso che l’omeprazolo può inibire la conversione del clopidogrel alla sua forma anticoagulante attiva, mentre il pantoprazolo è meno probabile che dia luogo a questa interazione; infatti il contemporaneo utilizzo di clopidogrel e farmaci inibitori della pompa protonica (principalmente pantoprazolo) ha ridotto in maniera significativa il sanguinamento gastro-intestinale, senza aumentare gli eventi avversi a livello cardio-vascolare. Infine la riduzione dell’acidità a livello gastrico potrebbe anche influenzare la biodisponibilità di certi farmaci come ketoconazolo, esteri dell’ampicillina e sali di ferro. Riassumendo, si elencano alcune delle principali interazioni farmacologiche: • con ansiolitici e ipnotici – diazepam: inibizione del metabolismo e aumento della concentrazione plasmatica con esomeprazolo e omeprazolo; • con antibiotici – claritromicina: aumento della concentrazione plasmatica con omeprazolo (che pure presenta un aumento della concentrazione plasmatica); • con anticoagulanti – derivati cumarinici: possibile aumento dell’effetto anticoagulante con esomeprazolo, omeprazolo e pantoprazolo; • con antidepressivi – escitalopram: aumento della concentrazione plasmatica con omeprazolo; • con antiepilettici – fenitoina: aumento dell’effetto con esomeprazolo e probabilmente omeprazolo; • con antimetaboliti – metotrexato: possibile riduzione dell’escrezione con aumento del rischio di tossicità con omeprazolo; • con antimicotici – ketoconazolo e itraconazolo: riduzione dell’assorbimento; • con antipsicotici – clozapina: possibile riduzione della concentrazione plasmatica con omeprazolo; • con antitrombotici – cilostazolo: aumento della concentrazione plasmatica con rischio di tossicità e necessità di evitare l’uso concomitante con omeprazolo; • con antitrombotici – cilostazolo: possibile aumento della concentrazione plasmatica con necessità di evitare l’uso concomitante con lansoprazolo; • con antivirali – atazanavir: possibile riduzione della concentrazione plasmatica, con necessità di evitare l’uso concomitante; • con antivirali – atazanavir: riduzione significativa della concentrazione plasmatica, con necessità di evitare l’uso concomitante con esomeprazolo e omeprazolo; 54 • con antivirali – nelfinavir: possibile riduzione della concentrazione plasmatica con omeprazolo; • con antivirali – saquinavir: possibile aumento della concentrazione plasmatica con omeprazolo; • con glicosidi cardiaci – digossina: possibile modesto aumento della concentrazione plasmatica; • con immunosoppressori – ciclosporina: possibili modifiche della concentrazione plasmatica con omeprazolo; • con immunosoppressori – tacrolimus: possibile aumento della concentrazione plasmatica con omeprazolo. E inoltre: • lansoprazolo: possibile riduzione dell’assorbimento a opera di farmaci antiacidi e di farmaci antiulcera peptica quali il sucralfato; • omeprazolo: aumento della concentrazione plasmatica con necessità di ridurre la dose a opera di farmaci antimicotici quali il voriconazolo. Caratteristiche dei singoli principi attivi Una descrizione dei singoli principi attivi appartenenti alla classe dei farmaci inibitori della pompa protonica, in termini di: indicazioni, vie di somministrazione, ulteriori potenziali effetti collaterali, posologia nelle diverse indicazioni e riferimenti rilevanti relativi a popolazioni di pazienti particolari, quali pazienti con insufficienza epatica, pazienti con insufficienza renale, donne in gravidanza, donne in allattamento, bambini e anziani. ESOMEPRAZOLO INDICAZIONI • Trattamento sintomatico della malattia da reflusso gastro-esofageo. • Trattamento dell’esofagite da reflusso erosiva. • Trattamento di mantenimento a lungo termine per la prevenzione delle recidive nei pazienti in cui si è ottenuta la cicatrizzazione dell’esofagite. • Eradicazione dell’Helicobacter pylori. • Guarigione dell’ulcera duodenale associata a Helicobacter pylori. • Prevenzione delle recidive delle ulcere peptiche nei pazienti con ulcere associate a Helicobacter pylori. • Guarigione delle ulcere gastriche associate alla terapia con FANS. 55 • Prevenzione delle ulcere gastriche e duodenali associate alla terapia con FANS nei pazienti a rischio. • Trattamento della sindrome di Zollinger-Ellison. VIE DI SOMMINISTRAZIONE • Orale. • Endovenosa. ULTERIORI POTENZIALI EFFETTI COLLATERALI Dermatite, edema periferico, innalzamento dei valori degli enzimi epatici, parestesia. POSOLOGIA Adulti e adolescenti dai 12 anni di età. • Trattamento sintomatico della malattia da reflusso gastro-esofageo: nei pazienti che non sono affetti da esofagite, 20 mg 1 volta al giorno, fino a 4 settimane; eseguire ulteriori indagini cliniche, se il controllo sintomatologico non viene raggiunto dopo 4 settimane di terapia; una volta risolta la sintomatologia, per il controllo dei sintomi: 20 mg 1 volta al giorno; negli adulti si può adottare un regime di assunzione al bisogno, quando necessario, di: 20 mg • 1 volta al giorno. Trattamento dell’esofagite da reflusso erosiva: 40 mg 1 volta al giorno, per 4 settimane; prolungare il trattamento per altre 4 settimane, in caso di esofagite non cicatrizzata o di persistenza dei sintomi. • Trattamento di mantenimento a lungo termine per la prevenzione delle recidive nei pazienti in cui si è ottenuta la cicatrizzazione dell’esofagite: 20 mg 1 volta al giorno. Adulti. • Eradicazione dell’Helicobacter pylori. Guarigione dell’ulcera duodenale associata a Helicobacter pylori. Prevenzione delle recidive delle ulcere peptiche nei pazienti con ulcere associate a Helicobacter pylori. 20 mg 2 volte al giorno, per 7 giorni, in associazione a farmaci antibatterici in un appropriato regime terapeutico. • Guarigione delle ulcere gastriche associate alla terapia con FANS: 20 mg 1 volta al giorno, per 4-8 settimane. 56 • Prevenzione delle ulcere gastriche e duodenali associate alla terapia con FANS nei pazienti a rischio: 20 mg • 1 volta al giorno. Trattamento della sindrome di Zollinger-Ellison: come dosaggio iniziale, 40 mg 2 volte al giorno; adattare la dose su base individuale; proseguire il trattamento sino a quando sia clinicamente indicato; la maggior parte dei pazienti può essere controllata con dosi da 80 mg a 160 mg al giorno; dosi superiori a 80 mg al giorno devono essere suddivise in 2 somministrazioni giornaliere. POPOLAZIONI PARTICOLARI • Nei pazienti con insufficienza epatica lieve o moderata, non è necessario adattare il dosaggio; nei pazienti con insufficienza epatica grave, non superare la dose di 20 mg. • Nei pazienti con insufficienza renale lieve o moderata, non è necessario adattare il dosaggio; nei pazienti con insufficienza renale grave, trattare con cautela a causa della limitata esperienza clinica. • Nelle donne in gravidanza, trattare con cautela a causa degli insufficienti dati clinici. • Nelle donne che allattano, non impiegare a causa della mancanza di studi condotti e della mancata conoscenza se il farmaco venga escreto nel latte materno. • Nei bambini di età inferiore a 12 anni, non impiegare perché non sono disponibili dati a riguardo. • Negli anziani, non è necessario adattare il dosaggio. LANSOPRAZOLO INDICAZIONI • Malattia da reflusso gastro-esofageo sintomatica. • Trattamento dell’esofagite da reflusso. • Profilassi dell’esofagite da reflusso. • Trattamento dell’ulcera duodenale. • Trattamento dell’ulcera gastrica. • Eradicazione dell’Helicobacter pylori per il trattamento delle ulcere associate a Helicobacter pylori. • Trattamento delle ulcere gastriche benigne e delle ulcere duodenali associate all’uso di FANS, in pazienti che richiedono un trattamento continuo con FANS. 57 • Profilassi delle ulcere gastriche e duodenali associate all’uso di FANS, in pazienti a rischio (età superiore a 65 anni o storia di ulcera gastrica o duodenale) che richiedono una terapia continua. • Sindrome di Zollinger-Ellison. VIE DI SOMMINISTRAZIONE • Orale. ULTERIORI POTENZIALI EFFETTI COLLATERALI Astenia, depressione, edema, eosinofilia, innalzamento dei valori degli enzimi epatici, leucopenia, trombocitopenia. POSOLOGIA • Malattia da reflusso gastro-esofageo sintomatica: 15-30 mg 1 volta al giorno, fino a 4 settimane; considerare l’eventuale aggiustamento individuale del dosaggio; eseguire ulteriori indagini cliniche, se i sintomi non si risolvono entro 4 settimane con una dose giornaliera di 30 mg. • Trattamento dell’esofagite da reflusso: 30 mg 1 volta al giorno, per 4 settimane; prolungare eventualmente il trattamento per altre 4 settimane, in pazienti non completamente cicatrizzati entro questo periodo. • Profilassi dell’esofagite da reflusso: 15-30 mg 1 volta al giorno. • Trattamento dell’ulcera duodenale: 30 mg 1 volta al giorno, per 2 settimane; prolungare il trattamento per altre 2 settimane, in pazienti non completamente cicatrizzati entro questo periodo. • Trattamento dell’ulcera gastrica: 30 mg 1 volta al giorno, per 4 settimane; prolungare eventualmente il trattamento per altre 4 settimane, in pazienti non completamente cicatrizzati entro questo periodo. • Eradicazione dell’Helicobacter pylori per il trattamento delle ulcere associate a Helicobacter pylori: 30 mg 2 volte al giorno, per 7 giorni, in associazione a farmaci antibatterici in un appropriato regime terapeutico. • Trattamento delle ulcere gastriche benigne e delle ulcere duodenali associate all’uso di FANS, in pazienti che richiedono un trattamento continuo con FANS: 58 30 mg 1 volta al giorno, per 4 settimane; proseguire eventualmente il trattamento per altre 4 settimane, in pazienti non completamente cicatrizzati; per pazienti a rischio o con ulcere difficili da cicatrizzare, considerare di prolungare il trattamento e/o utilizzare una dose più elevata. • Profilassi delle ulcere gastriche e duodenali associate all’uso di FANS, in pazienti a rischio (età superiore a 65 anni o storia di ulcera gastrica o duodenale) che richiedono una terapia continua: 15-30 mg 1 volta al giorno. • Sindrome di Zollinger-Ellison: come dosaggio iniziale, 60 mg 1 volta al giorno; adattare la dose su base individuale; prolungare il trattamento per il tempo necessario; sono state usate dosi fino a 180 mg al giorno; dosi superiori a 120 mg al giorno devono essere suddivise in 2 somministrazioni giornaliere. POPOLAZIONI PARTICOLARI • Nei pazienti con insufficienza epatica moderata o grave, trattare con cautela e ridurre il dosaggio giornaliero del 50%. • Nei pazienti con insufficienza renale, non è necessario adattare il dosaggio. • Nelle donne in gravidanza, non impiegare a causa della non disponibilità di dati clinici. • Nelle donne che allattano, non impiegare a causa della mancata conoscenza se il farmaco venga escreto nel latte materno. • Nei bambini, non impiegare perché i dati clinici sono limitati. • Negli anziani, eventualmente adattare il dosaggio su base individuale a causa della clearance ridotta e non superare la dose giornaliera di 30 mg salvo indicazioni cliniche impellenti. OMEPRAZOLO INDICAZIONI Bambini. • Trattamento dell´esofagite da reflusso gastro-esofageo severa. Adulti. • Trattamento della malattia da reflusso gastro-esofageo. • Prevenzione della malattia da reflusso gastro-esofageo. • Trattamento dell’esofagite da reflusso gastro-esofageo. 59 • Trattamento delle recidive dell’esofagite da reflusso gastro-esofageo. • Prevenzione delle recidive dell’esofagite da reflusso gastro-esofageo. • Trattamento dell’ulcera gastrica. • Trattamento a breve termine dell’ulcera duodenale. • Trattamento dell’ulcera peptica associata a infezione da Helicobacter pylori. • Trattamento delle ulcere gastriche e duodenali e della gastropatia erosiva associate all’assunzione continuativa di FANS. • Profilassi delle ulcere gastriche e duodenali e della gastropatia erosiva associate all’assunzione continuativa di FANS. • Sindrome di Zollinger-Ellison. • Trattamento della dispepsia funzionale non ulcerosa. VIE DI SOMMINISTRAZIONE • Orale. • Endovenosa. ULTERIORI POTENZIALI EFFETTI COLLATERALI Innalzamento dei valori degli enzimi epatici, parestesia. POSOLOGIA Bambini dai 2 anni di età. • Trattamento dell’esofagite da reflusso gastro-esofageo severa: 10-20 mg per un peso tra 10 e 20 kg, per un periodo non superiore a 2 mesi; 20-40 mg per un peso superiore a 20 kg, per un periodo non superiore a 2 mesi. Adulti. • Trattamento della malattia da reflusso gastro-esofageo: a breve termine e per il mantenimento della remissione, 10-20 mg 1 volta al giorno; adattare la dose su base individuale. • Trattamento dell’esofagite da reflusso gastro-esofageo: 20 mg 1 volta al giorno, per 4 settimane; prolungare il trattamento a 6-8 settimane, nei casi resistenti; elevare la dose a 40 mg 1 volta al giorno, nei pazienti non responsivi, per ottenere la cicatrizzazione generalmente in 8 settimane. • Prevenzione delle recidive dell’esofagite da reflusso gastro-esofageo: 10-20 mg 1 volta al giorno. • Trattamento dell’ulcera gastrica: 20 mg 1 volta al giorno, per 4 settimane; 60 prolungare il trattamento a 6-8 settimane, nei casi di ulcere non completamente cicatrizzate; 40 mg 1 volta al giorno, in pazienti affetti da ulcera gastrica severa, per ottenere la cicatrizzazione generalmente in 8 settimane. • Trattamento dell’ulcera duodenale: 20 mg 1 volta al giorno, per 2 settimane; nella maggior parte dei pazienti si ottiene un rapido miglioramento della sintomatologia dolorosa nell'arco di 24-48 ore e la cicatrizzazione dell’ulcera entro 2 settimane dall’inizio del trattamento; prolungare il trattamento per altre 2 settimane, nel caso di ulcere non completamente cicatrizzate per ottenere la cicatrizzazione; 40 mg 1 volta al giorno, in pazienti affetti da ulcera duodenale severa, per ottenere la cicatrizzazione generalmente in 4 settimane. • Trattamento dell’ulcera peptica associata a infezione da Helicobacter pylori: 20 mg 2 volte al giorno, per 1 settimana (triplice terapia), 40 mg 2 volte al giorno, per 2 settimane (duplice terapia), in associazione a farmaci antibatterici in un appropriato regime terapeutico. • Trattamento delle ulcere gastriche e duodenali e della gastropatia erosiva associate all’assunzione continuativa di FANS: 20 mg 1 volta al giorno, per 4 settimane; nella maggior parte dei pazienti si ottiene un rapido miglioramento della sintomatologia e la cicatrizzazione entro 4 settimane; prolungare il trattamento per altre 4 settimane, nei pazienti non completamente guariti per ottenere la cicatrizzazione. • Profilassi delle ulcere gastriche e duodenali e della gastropatia erosiva associate all’assunzione continuativa di FANS: 20 mg • 1 volta al giorno. Sindrome di Zollinger-Ellison: come dosaggio iniziale, 60 mg 1 volta al giorno; adattare la dose su base individuale; proseguire il trattamento sino a quando sia clinicamente indicato; la maggior parte dei pazienti con malattia severa, che rispondono scarsamente alle altre terapie, può essere controllata con dosi tra 20 mg e 120 mg al giorno; dosi superiori a 80 mg al giorno devono essere suddivise in 2 somministrazioni giornaliere. • Trattamento della dispepsia funzionale non ulcerosa: come dosaggio iniziale, 61 10-20 mg 1 volta al giorno, per 4 settimane; nei soggetti con età non superiore a 45 anni, senza indici di allarme, con dispepsia con problemi di sintomi simil-ulcerosi; nei soggetti con età superiore a 45 anni, in presenza di indici di allarme, effettuare una indagine endoscopica per escludere la presenza di una patologia organica. POPOLAZIONI PARTICOLARI • Nei pazienti con insufficienza epatica, è in genere sufficiente la dose di 10-20 mg al giorno, in quanto la biodisponibilità e l’emivita plasmatica sono aumentate in questi pazienti. • Nei pazienti con insufficienza renale, non è necessario adattare il dosaggio. • Nelle donne in gravidanza, impiegare nei casi di assoluta necessità e non impiegare nel primo trimestre di gravidanza, a causa della non esclusione del rischio di effetti dannosi a carico del feto. • Nelle donne che allattano, non impiegare a causa della non esclusione del rischio di effetti dannosi a carico del lattante e della mancata conoscenza se il farmaco venga escreto nel latte materno. • Nei bambini, può essere utilizzato come riportato nelle indicazioni. • Negli anziani, non è necessario adattare il dosaggio. PANTOPRAZOLO INDICAZIONI • Trattamento della malattia da reflusso gastro-esofageo lieve e dei sintomi correlati. • Trattamento dell’esofagite da reflusso di grado moderato e grave. • Trattamento a lungo termine delle recidive delle esofagiti da reflusso gastro-esofageo. • Prevenzione delle recidive delle esofagiti da reflusso gastro-esofageo. • Trattamento dell’ulcera gastrica. • Trattamento dell’ulcera duodenale. • Eradicazione dell’Helicobacter pylori in pazienti con ulcera peptica, allo scopo di ridurre le recidive di ulcera gastrica e duodenale causate da questo microrganismo. • Prevenzione delle ulcere gastriche e duodenali indotte da FANS non selettivi in pazienti a rischio che necessitino di un trattamento continuativo con FANS. • Sindrome di Zollinger-Ellison. • Altri stati patologici caratterizzati da ipersecrezione acida. VIE DI SOMMINISTRAZIONE 62 • Orale. • Endovenosa. CONTROINDICAZIONI Non impiegare in terapia combinata per l’eradicazione dell’Helicobacter pylori, nei pazienti con disfunzioni epatiche o renali da moderate a gravi, perché non sono disponibili dati di efficacia e di sicurezza in terapia combinata per questi pazienti. ULTERIORI POTENZIALI EFFETTI COLLATERALI POSOLOGIA Adulti e adolescenti dai 12 anni di età. • Trattamento della malattia da reflusso gastro-esofageo lieve e dei sintomi correlati: 20 mg 1 volta al giorno, per 4 settimane; prolungare eventualmente il trattamento per altre 4 settimane, se necessario; una volta risolta la sintomatologia, per il controllo dei sintomi: 20 mg 1 volta al giorno, al bisogno, ma valutare il passaggio a una terapia continuativa, se la somministrazione “al bisogno” non permette un adeguato controllo della sintomatologia. • Trattamento dell’esofagite da reflusso di grado moderato e grave: 40 mg 1 volta al giorno, per 4 settimane; raddoppiare eventualmente la dose in casi particolari, specialmente quando non si è ottenuta risposta ad altri trattamenti; prolungare eventualmente il trattamento per altre 4 settimane, per ottenere la cicatrizzazione. • Trattamento a lungo termine delle recidive delle esofagiti da reflusso gastro-esofageo: 20-40 mg 1 volta al giorno. • Prevenzione delle recidive delle esofagiti da reflusso gastro-esofageo: 20 mg 1 volta al giorno. Adulti. • Trattamento dell’ulcera gastrica: 40 mg 1 volta al giorno, per 4 settimane; raddoppiare eventualmente la dose in casi particolari, specialmente quando non si è ottenuta risposta ad altri trattamenti; prolungare eventualmente il trattamento per altre 4 settimane, per ottenere la cicatrizzazione. • Trattamento dell’ulcera duodenale: 40 mg 1 volta al giorno, per 2 settimane; raddoppiare eventualmente la dose in casi particolari, specialmente quando non si è 63 ottenuta risposta ad altri trattamenti; prolungare eventualmente il trattamento per altre 2 settimane, per ottenere la cicatrizzazione. • Eradicazione dell’Helicobacter pylori: 40 mg 2 volte al giorno, per 1 settimana, in associazione a farmaci antibatterici in un appropriato regime terapeutico; prolungare eventualmente il trattamento per 1 altra settimana. • Prevenzione delle ulcere gastriche e duodenali indotte da FANS non selettivi in pazienti a rischio che necessitino di un trattamento continuativo con FANS: 20 mg • 1 volta al giorno. Sindrome di Zollinger-Ellison. Altri stati patologici caratterizzati da ipersecrezione acida. Come dosaggio iniziale, 80 mg 1 volta al giorno; adattare la dose su base individuale; dosi superiori a 80 mg devono essere suddivise in 2 somministrazioni giornaliere; eventualmente incrementare temporaneamente la dose giornaliera al di sopra di 160 mg per periodi non superiori a quelli necessari per ottenere un controllo adeguato della secrezione acida; la durata della terapia non ha restrizioni e deve essere adattata secondo le necessità cliniche. POPOLAZIONI PARTICOLARI • Nei pazienti con insufficienza epatica grave, il dosaggio deve essere ridotto a 20 mg al giorno o a 40 mg a giorni alterni; inoltre, durante la terapia, eseguire controlli periodici degli enzimi epatici; in caso di aumento dei livelli sierici di questi enzimi, sospendere il trattamento. • Nei pazienti con insufficienza renale, non si deve superare la dose di 40 mg al giorno. • Nelle donne in gravidanza, trattare con estrema cautela e solo quando il beneficio per la madre sia superiore al rischio potenziale per il feto, in quanto l’esperienza clinica su queste pazienti è limitata. • Nelle donne che allattano, trattare con estrema cautela e solo quando il beneficio per la madre sia superiore al rischio potenziale per il lattante, in quanto non sono disponibili dati sull’escrezione del farmaco nel latte materno. • Nei bambini di età inferiore a 12 anni, non impiegare perché sono disponibili solo dati limitati a riguardo. • Negli anziani, non si deve superare la dose di 40 mg al giorno; un’eccezione è nella terapia combinata per l’eradicazione dell’Helicobacter pylori, nella quale anche i pazienti anziani devono assumere la dose usuale (40 mg 2 volte al giorno). 64 RABEPRAZOLO INDICAZIONI • Trattamento della malattia da reflusso gastro-esofageo sintomatica erosiva o ulcerativa. • Terapia a lungo termine di mantenimento della malattia da reflusso gastro-esofageo. • Trattamento dei sintomi della malattia da reflusso gastro-esofageo da moderata a molto severa. • Trattamento dell’ulcera gastrica benigna attiva. • Trattamento dell’ulcera duodenale attiva. • Eradicazione dell’infezione da Helicobacter pylori in pazienti con ulcera peptica. • Sindrome di Zollinger-Ellison. VIE DI SOMMINISTRAZIONE • Orale. ULTERIORI POTENZIALI EFFETTI COLLATERALI • Astenia, bronchite, crampi alle gambe, dispepsia, eruttazioni, faringite, innalzamento dei valori degli enzimi epatici, nervosismo, rinite, sinusite, tosse. POSOLOGIA • Trattamento della malattia da reflusso gastro-esofageo sintomatica erosiva o ulcerativa: 20 mg • 1 volta al giorno, per 4-8 settimane. Terapia a lungo termine di mantenimento della malattia da reflusso gastro-esofageo: 10-20 mg 1 volta al giorno, a seconda della risposta del paziente. • Trattamento dei sintomi della malattia da reflusso gastro-esofageo da moderata a molto severa: in pazienti senza esofagite, 10 mg 1 volta al giorno, fino a 4 settimane; eseguire ulteriori indagini cliniche, se il controllo sintomatologico non viene raggiunto dopo 4 settimane di terapia; una volta risolta la sintomatologia, per il controllo dei sintomi: 10 mg • 1 volta al giorno, al bisogno. Trattamento dell’ulcera gastrica benigna attiva: 20 mg 1 volta al giorno, per 6 settimane; prolungare eventualmente il trattamento per altre 6 settimane, per raggiungere la guarigione nei pazienti più difficili da trattare. • Trattamento dell’ulcera duodenale attiva: 20 mg 1 volta al giorno, per 4 settimane; 65 prolungare eventualmente il trattamento per altre 4 settimane, per raggiungere la cicatrizzazione nei pazienti più difficili da trattare. • Eradicazione dell’infezione da Helicobacter pylori: 20 mg 2 volte al giorno, per 7 giorni, in associazione a farmaci antibatterici in un appropriato regime terapeutico. • Sindrome di Zollinger-Ellison: come dosaggio iniziale, 60 mg 1 volta al giorno; adattare la dose su base individuale; proseguire il trattamento sino a quando sia clinicamente indicato; la posologia può essere aumentata fino a raggiungere la dose di 120 mg al giorno; la dose da 120 mg al giorno può essere frazionata in 2 somministrazioni giornaliere. POPOLAZIONI PARTICOLARI • Nei pazienti con insufficienza epatica, non è necessario adattare il dosaggio; tuttavia nei pazienti con insufficienza epatica grave, trattare con cautela quando il farmaco è somministrato per la prima volta a questi pazienti. • Nei pazienti con insufficienza renale, non è necessario adattare il dosaggio. • Nelle donne in gravidanza, non impiegare in quanto non vi sono dati sulla sicurezza del farmaco in questa popolazione di pazienti. • Nelle donne che allattano, non impiegare a causa della mancanza di studi condotti in questa popolazione di pazienti e della mancata conoscenza se il farmaco venga escreto nel latte materno. • Nei bambini, non impiegare a causa della mancata esperienza sull’uso del prodotto in questa popolazione di pazienti. • Negli anziani, non è necessario adattare il dosaggio. TRATTAMENTI ALTERNATIVI PER CONDIZIONI PATOLOGICHE CORRELATE ALL’ACIDITÀ GASTRICA Cenni di possibili trattamenti alternativi per trattare condizioni patologiche che possono essere correlate all’acidità gastrica, con brevi riferimenti nello specifico all’omeopatia, agli oligoelementi, e alla fitoterapia. Esistono vari tipi di disturbi che concorrono nel provocare fastidi e bruciori allo stomaco o nel punto in cui le persone ritengono sia localizzato lo stomaco. 66 La credenza popolare è che, quando fa male lo stomaco, il problema sia localizzato esclusivamente a livello di questo organo. Numerose connessioni sono invece state dimostrate tra l’equilibrio psico-emotivo di una persona e le forme patologiche digestive. Pertanto riequilibrando la funzione di organi quali la colecisti, il fegato e il pancreas, se anche non si ottiene la guarigione della sintomatologia relativa al problema digestivo, si può tuttavia a volte ottenere un beneficio; dal punto di vista anatomico, questi organi non sono localizzati distanti dallo stomaco, e anzi lo circondano; dal punto di vista fisiologico, se lo stomaco ha il compito di produrre l’acido, questo deve essere neutralizzato anche dalle sostanze prodotte proprio dalla colecisti, dal fegato e dal pancreas. In conclusione quindi l’eventuale problema associabile alla secrezione gastrica acida può essere trattato anche riequilibrando la funzione di tutti quegli organi digestivi che producono naturalmente sostanze ad azione antiacida e non è quindi sempre necessario assumere sostanze esogene a questo scopo; così come peraltro non è sempre un approccio corretto cercare unicamente di contrastare la produzione di acido a livello gastrico. Un ultimo punto da considerare è che le persone che hanno avuto una storia pregressa di ulcera scambiano spesso qualsiasi bruciore di nuova generazione per un segnale del precedente disturbo. Questo non è sempre vero, in quanto un bruciore insorto per esempio dopo un attacco d’ira potrebbe dipendere anche solo da uno spasmo locale o da una contrattura. L’omeopatia prevede un trattamento che agisca su tutti gli aspetti sia fisici che psichici dell’organismo, dato che il problema correlato all’eccessiva acidità gastrica si dimostra spesso una forma patologica complessa. È possibile comunque utilizzare anche alcuni rimedi che svolgono un’azione mirata, da soli o in associazione tra loro, sfruttandone basse diluizioni (5 CH o 7 CH), ripetendone l’assunzione più volte al giorno (2 o 3 volte), e utilizzandoli indicativamente per un periodo di tempo di almeno 15-20 giorni, prima dell’eventuale periodo di ricaduta della sintomatologia (se ricorrente) e durante il periodo stesso. Esclusivamente a scopo indicativo e non esaustivo, i rimedi utilizzabili possono comprendere: Argentum nitricum, Kali bichromicum, Lycopodium, Nux vomica. Per quanto riguarda l’utilizzo di oligoelementi, un potenziale rimedio sfruttabile è il Manganese-Cobalto, con un’assunzione protratta per almeno due mesi oppure con un regime inizialmente continuativo e quindi periodico (per esempio un mese di terapia ogni trimestre). Nella fase iniziale può essere auspicabile associare anche altri oligoelementi, quali il Litio, il Magnesio e lo Zinco, con l’obiettivo di favorire la disintossicazione ed eventualmente la riparazione di lesioni già in atto. 67 La fitoterapia prevede infine l’utilizzo di un discreto numero di rimedi, sia a scopo preventivo che come ausilio terapeutico. Esclusivamente a scopo indicativo e non esaustivo, i rimedi utilizzabili possono comprendere: Angelica archangelica (l’angelica), Calendula officinalis (la calendula), Ficus carica (il fico), Glycyrrhiza glabra (la liquirizia), Juniperus communis (il ginepro), Urtica dioica (l’ortica). I CONSIGLI DEL FARMACISTA Brevi suggerimenti informativi e consigli che la figura professionale del farmacista può fornire ai pazienti che si presentino in farmacia lamentando condizioni patologiche correlate all’acidità gastrica. In conclusione si riportano le note AIFA alla prescrizione che riguardano i farmaci inibitori della pompa protonica. La figura professionale del farmacista, nella sua attività quotidiana, può trovarsi a dover affrontare pazienti che lamentino problematiche inerenti l’acidità gastrica. Le informazioni e i consigli che possono essere forniti dal farmacista si possono brevemente riassumere come segue. • Innanzitutto è importante che il farmacista faccia comprendere al paziente la necessità di rivolgersi in tempi brevi al proprio medico di medicina generale, con il quale discutere in dettaglio la sintomatologia, concordare un eventuale percorso diagnostico e stabilire un appropriato piano terapeutico. • È quindi fondamentale che il farmacista ascolti quanto il paziente riferisce in termini di tipologia dei sintomi che lo affliggono, periodo di tempo da cui si trova ad affrontare questa situazione anomala e qualsiasi altro aspetto anamnestico venga da esso riferito. • Al fine di avere un quadro ancora più completo, il farmacista potrebbe eventualmente indagare un aspetto significativo, quale l’eventuale assunzione di FANS da parte del paziente; questo può risultare un fattore importante, tenuto conto della possibile correlazione di questi farmaci con la sintomatologia riferita, dell’estrema diffusione del loro utilizzo spesso come automedicazione e del non sempre corretto uso che se ne fa. • In un tentativo di informare il paziente, può essere utile che il farmacista sottolinei tutte le buone norme relative a una corretta alimentazione, sia in termini di qualità e quantità dei cibi assunti, che in termini di assicurare un adeguato processo digestivo. Per quanto riguarda quest’ultimo, se è vero che esso avviene principalmente a livello dello stomaco e dell’intestino, non si può sottovalutare l’importanza del tratto gastro-intestinale superiore. Infatti l’assunzione di cibo in piccole quantità, che vengano accuratamente 68 masticate e impastate con la saliva prima della deglutizione, può incidere sul successivo processo di digestione e assimilazione dei nutrienti, sia dal punto di vista qualitativo che quantitativo. • Allo scopo di controllare i sintomi, il farmacista può suggerire al paziente di effettuare nel corso della giornata, invece di pasti abbondanti, una serie di piccoli pasti leggeri che, assicurando la presenza di cibo nello stomaco, possano contrastare l’azione dell’acido gastrico; come già sottolineato, è necessario masticare adeguatamente ogni boccone per facilitare il successivo processo digestivo ed evitare qualsiasi possibile sovraccarico di lavoro per lo stomaco. • A seconda delle informazioni fornite dal paziente, sempre tenendo presente l’importanza che lo stesso faccia riferimento prima possibile al medico di medicina generale, il farmacista può quindi proporre tutta una serie di rimedi di automedicazione, che possono andare a controllare temporaneamente la sintomatologia riferita. • Infine il farmacista deve ricordare al paziente l’importanza di utilizzare gli eventuali trattamenti suggeriti con buon senso e rispettando l’equilibrio dell’organismo. Un esempio pratico riguarda i farmaci antiacidi che spesso i pazienti assumono al solo bisogno, cioè durante il singolo momento di sofferenza. Soprattutto quando questi momenti di sofferenza si ripetono, i farmaci antiacidi dovrebbero essere assunti come prescritto e utilizzati a pieno dosaggio per un periodo di tempo adeguato, al fine che la mucosa digestiva, lasciata a riposo, possa riequilibrarsi e riparare eventuali lesioni; dopo questo periodo iniziale, si potrà quindi effettuare un periodo di trattamento più breve a dosi ridotte, a cui infine seguirà la sospensione della terapia. Questo approccio terapeutico ha un suo razionale al contrario dell’utilizzo dei farmaci antiacidi solo durante il singolo episodio sintomatico, che può determinare degli sbalzi di acidità intensi al termine dell’effetto dei farmaci e rivelarsi quindi persino più dannoso. Si ricordano infine le note AIFA alla prescrizione che riguardano i farmaci inibitori della pompa protonica. Nota 1 – Gastro-protettori: misoprostolo, esomeprazolo, lansoprazolo, omeprazolo, pantoprazolo, misoprostolo + diclofenac*. “La prescrizione a carico del SSN è limitata: alla prevenzione delle complicanze gravi del tratto gastro-intestinale superiore: 69 • in trattamento cronico con FANS, • in terapia antiaggregante con acido acetilsalicilico a basse dosi, purché sussista una delle seguenti condizioni di rischio: • storia di pregresse emorragie digestive o di ulcera peptica non guarita con terapia eradicante, • concomitante terapia con anticoagulanti o cortisonici, • età avanzata.” * La prescrizione dell’associazione misoprostolo + diclofenac è rimborsata alle condizioni previste dalla Nota 66. Nota 48 – Farmaci antiulcera: cimetidina, famotidina, nizatidina, ranitidina, roxatidina; esomeprazolo, lansoprazolo, omeprazolo, pantoprazolo, rabeprazolo. “La prescrizione a carico del SSN è limitata ai seguenti periodi di trattamento e alle seguenti condizioni: • durata di trattamento 4 settimane (occasionalmente 6 settimane): − ulcera duodenale o gastrica positive per Helicobacter pylori, − per la prima o le prime due settimane in associazione con farmaci eradicanti l’infezione, • − ulcera duodenale o gastrica Helicobacter pylori-negativa (primo episodio), − malattia da reflusso gastro-esofageo con o senza esofagite (primo episodio); durata di trattamento prolungata, da rivalutare dopo un anno: − sindrome di Zollinger-Ellison, − ulcera duodenale o gastrica Helicobacter pylori-negativa recidivante, − malattia da reflusso gastro-esofageo con o senza esofagite (recidivante).” 70
Scaricare