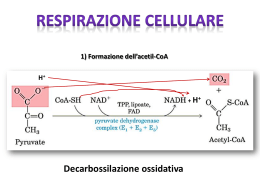
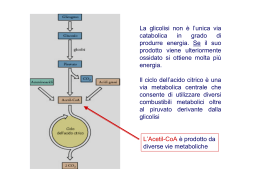
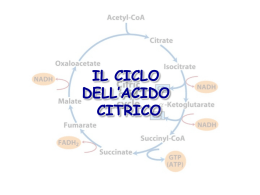
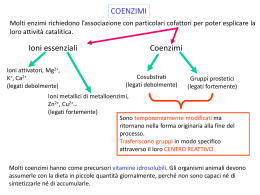
Enzimi REDOX Gli enzimi coinvolti in processi redox possono essere classificati in tre categorie: deidrogenasi, deidrogenasi, ossigenasi e ossidasi Deidrogenasi Riciclo del cofattore Nei processi redox enzimatici deve essere utilizzato un cofattore, cofattore, solitamente la nicotammide adenin dinucleotide [NAD(H)] (80%) e il corrispettivo fosfato [NADP(H)] (10%). Altri cofattori quali le flavine (FMN e FAD) e il pirrolo chinolin chinone (PQQ) si incontrano più raramente. Ossidazione di alcoli ad opera di NAD+ (alcol deidrogenasi) deidrogenasi) Tutti i cofattori sono molecole instabili e troppo costose per essere utilizzate in quantità stechiometrica. Non possono essere sostituite sostituite da analoghi artificiali. Possono però essere rigenerato utilizzando una seconda reazione redox. redox. L’efficienza di un processo di riciclo viene espressa dal TTN (numero (numero totale di cicli catalitici, total turnover number) ) che indica il numero di number volte che il cofattore può essere rigenerato prima di decomporsi. Per processi di laboratorio TTN = 103-104 processo produttivo sono necessari TTN > sono accettabili, per un 105. Se si utilizzano cellule intere il problema del riciclo del cofattore non sussiste. Riciclo del NAD+ (forma ridotta) Storicamente NAD+ è stato riciclato utilizzando sodio ditionito (Na2S2O4) come agente riducente (TTN ≤ 100). Altri metodi elettrochimici o fotochimici forniscono TTN maggiori (≤ (≤ 1000) ma basse regioselettività regioselettività. Risultati nettamente migliori sono stati ottenuti con metodi enzimatici enzimatici sia con il NAD+ e il NADP+. I metodi di riciclo enzimatico possono essere suddivisi in due classi: classi: Metodi con substrati accoppiati (coupled -substrate process) (coupledprocess) Il cofattore è costantemente rigenerato per aggiunta di un secondo substrato ausiliario trasformato dallo stesso enzima, ma nel senso senso inverso Metodi con enzimi accoppiati (coupled -enzyme process) (coupledprocess) In questo caso i due processi, conversione del substrato principale principale e riciclo del cofattore, cofattore, sono catalizzati da due diversi enzimi Metodi con substrati accoppiati (coupled -substrate process) (coupledprocess) Il cofattore è costantemente rigenerato per aggiunta di un secondo substrato ausiliario trasformato dallo stesso enzima, ma nel senso senso inverso. Per spostare il secondo equilibrio a destra si utilizza il substrato substrato ausiliario in largo eccesso ottenendo TTN = 103 Metodi con substrati accoppiati (coupled -substrate process) (coupledprocess) Il riciclo del cofattore con lo stesso enzima è elegante ma ha alcuni inconvenienti piuttosto severi: 1. L’efficienza globale del sistema è limitata poiché poiché l’enzima lavora in entrambi i processi 2. Il prodotto deve essere separato dal substrato ausiliario in eccesso eccesso 3. Può esserci disattivazione dell’ dell’enzima se si utilizzano composti carbonilici molto reattivi quali acetaldeide o cicloesanone come donatori redox 4. Può anche esserci inibizione dell’ dell’enzima a causa dell’ dell’elevato eccesso di substrato ausiliario. Metodi con enzimi accoppiati (coupled -enzyme process) (coupledprocess) I due processi, conversione del substrato principale e riciclo del del cofattore, cofattore, sono catalizzati da due diversi enzimi. Per ottenere i risultati migliori i due diversi enzimi devono avere avere specificità specificità sufficientemente diverse per i rispettivi substrati in modo tale che le due reazioni possano procedere indipendentemente e che quindi i due substrati non debbano competere con il sito attivo di un singolo enzima. Sono stati sviluppati diversi esempi eccellenti di rigenerazione del NADH anche a livello industriale mentre per il NADPH sono disponibili metodi a livello laboratorio ma non su larga scala. Il metodo migliore e più più largamente utilizzato per riciclare il NADH usa la formiato deidrogenasi (FDH) per catalizzare l’l’ossidazione del formiato a CO2 Il vantaggio principale è che sia il substrato ausiliario che il prodotto non sono innocui per l’ l’enzima e facili da rimuovere dall’ dall’ambiente di reazione. FHD è commerciale, facilmente immobilizzabile e stabile, se protetta dall’ dall’autoossidazione. autoossidazione. E’ costosa e ha una bassa attività attività specifica (3U/mg). Può però essere immobilizzata o trattenuta in membrana. TTM 103-105. Un altro metodo utilizza l’ l’ossidazione del glucosio, catalizzata dalla glucosio deidrogenasi (GDH) In questo caso l’ l’equilibrio è spostato a destra perché perché il gluconolattone si idrolizza spontaneamente ad acido gluconico. gluconico. Il metodo è efficace sia per il NADH che il NADPH. La GHD è piuttosto costosa e la separazione dal gluconato non è particolarmente agevole Etanol e Alcol Deidrogenasi (ADH) sono anche utilizzate per rigenerare il NADH e NADPH. Il basso costo dell’ dell’ADH e la volatilità volatilità dell’ dell’etanolo e dell’ dell’acetaldeide rendono questo metodo attraente per utilizzi su larga scala. A causa del basso potenziale redox possono essere ridotti solo derivati carbonilici reattivi quali aldeidi o chetoni ciclici. Con altri substrati di deve forzare a destra l’l’equilibrio utilizzando etanolo in eccesso o rimuovendo l’aldeide. Quest’ Quest’ultimo risultato può essere ottenuto ossidando l’ l’aldeide ad acetato con un aldeide deidrogenasi, deidrogenasi, con conseguente rigenerazione di un secondo equivalente di cofattore ridotto. Tutti questi sistemi forniscono bassi TTN e richiedono sistemi multi multienzimatici complessi. Riciclo del NADH (forma ossidata) Il miglior metodo per riciclare i cofattori NAD(P) nella loro forma ossidata utilizza la glutammato deidrogenasi (GluDH) GluDH) che catalizza la amminazione riduttiva dell’ ’ α cheto glutarrato a Ldell L-glutammato. Può anche essere utilizzato il piruvato insieme alla lattato deidrogenasi (LDH). La LDH è economica e ha una più più elevata attività attività specifica. Ha però un potenziale redox inferiore ed accetta solo il NADH. Riduzione di aldeidi e chetoni ad alcoli Lo ione idruro (H(H-) è un nucleofilo ed è in grado di portare un attacco al carbonio elettrofilo del carbonile riducendolo ad alcol I due reagenti più più comunemente utilizzati per tale reazione sono il NaBH4 (sodio boroidruro) boroidruro) e il LiAlH4 (litio alluminio idruro). Il NaBH4 è un riducente più più blando e viene solitamente utilizzato in solventi alcolici acquosi. Il LiAlH4 è un riducente più più energico, si usa in etere o THF e reagisce violentemente con l’ l’acqua Riduzione di aldeidi e chetoni ad alcoli Riduzione di aldeidi e chetoni ad alcoli con NaBH4 L’ idrolisi avviene nel mezzo di reazione che contiene acqua Riduzione di aldeidi e chetoni ad alcoli con LiAlH4 Tutti i quattro idruri sono in grado di reagire Riduzione di aldeidi con NaBH4 Riduzione di chetoni Si forma un nuovo stereocentro: stereocentro: processo stereoselettivo Idruri chirali enantiopuri: complessi del borano con ossoazaborolidine Complessi del borano con ossoazaborolidine: ossoazaborolidine: configurazione assoluta del prodotto R>>R’ R>>R’ ( R) Complessi del borano con ossoazaborolidine: ossoazaborolidine: Modelli di stato di transizione Complessi del borano con ossoazaborolidine: ossoazaborolidine: Processo catalitico Il BH3 non deve essere in grado di reagire da solo (fornirebbe un processo non stereoselettivo) stereoselettivo) Ruolo del boro dell’ dell’ossoazaborolidina come acido di Lewis nell’ nell’ attivare il composto carbonilico Determinazione della configurazione relativa di un alcol: Regola di Prelog O O H3C O L SM PhMgBr Ph OH H3C O O L SM Idrolisi Ph OH H3C OH O (-)-(R)-acido atrolattico Il fenil magnesio bromuro attacca preferenzialmente la faccia del carbonile (Re o Si) dalla parte del gruppo Small portando, dopo idrolisi, all’ all’acido atrolattico (R) o (S) rispettivamente. Riduzione di aldeidi e chetoni con enzimi isolati Il decorso stereochimico dipende fortemente dal substrato: Regola di Prelog: Prelog: si basa sulla sterochimica della riduzione che si ottiene con cellule di Curvularia falcata, nella quale si ottiene prevalente riduzione alla faccia Re Strutture preferenziali per le deidrogenasi YADH: yeast alcohol dehydrogenase HLADH: horse liver alcohol dehydrogenase TBADH: Thermoanaerobium brockii alcohol dehydrogenase HSDH: Hydroxysteroid dehydrogenase Regola dell’interazione a tre punti (Ogston 1948) Poiché l’interazione del substrato con il sito attivo è tridimensionale, il sito attivo deve avere almeno tre punti di contatto per poter raggiungere un elevato livello di stereoselezione R Interazione di A,B,C ottimale Orientazione ottimale di D Elevata stereoselezione D= gruppo reattivo S Interazione di A,B,C non ottimale Orientazione non ottimale di D Bassa stereoselezione Regola dell’interazione a tre punti (Ogston 1948) Riduzione del piruvato con liver dehydrogenase per ottener l’(S)l’(S)-acido lattico Nella reazione inversa l’(S)l’(S)-acido lattico viene ossidato selettivamente Risoluzione di chetoni policiclici con HLADH uso combinato di bio e chemo catalizzatori Alcol Deidrogenasi di fegato di cavallo (HLADH) Deidrogenasi commerciale, la più utilizzata in biotrasformazioni. biotrasformazioni. La struttura ai raggi X è stata risolta ed è un dimero con due subsub-unità quasi identiche contenenti due atomi di zinco. La struttura tridimensionale tridimensionale è simile a quella della alcol deidrogenasi di leivito (YADH) anche se la sequenza primaria è alquanto diversa. E’ efficace nel catalizzare la riduzione di chetoni ciclici con un anello di dimensioni non troppo elevate Alcol Deidrogenasi di fegato di cavallo (HLADH) Riduzione stereoselettiva di 22-alchiltiopiranialchiltiopirani-4-oni Risoluzione dei due chetoni Alcol Deidrogenasi di fegato di cavallo (HLADH) Asimmetrizzazione di dichetoni achirali Riduzioni di aldeidi e chetoni con lievito di birra (saccharomyces cerevisiae) Il lievito di birra è il microorganismo più utilizzato per la riduzione di stereoselettiva di composti carbonilici. E’ ideale per i nonnon-microbiologi perché è facilmente disponibile e non richiede fermentatori sterili. sterili. Riduzioni di chetoesteri con lievito di birra Riduzioni di chetoesteri con lievito di birra Inibizione dell’ LL-enzima Riduzioni di chetoesteri con lievito di birra Inibizione del DD-enzima
Scaricare