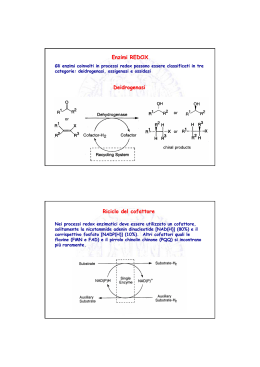
COENZIMI Molti enzimi richiedono l’associazione con particolari cofattori per poter esplicare la loro attività catalitica. Ioni essenziali Ioni attivatori, Mg2+, K+, Ca2+ (legati debolmente) Coenzimi Cosubstrati (legati debolmente) Gruppi prostetici (legati fortemente) Ioni metallici di metalloenzimi, Zn2+, Cu2+… (legati fortemente) Sono temporaneamente modificati ma ritornano nella forma originaria alla fine del processo. Trasferiscono gruppi in modo specifico attraverso il loro CENTRO REATTIVO Molti coenzimi hanno come precursori vitamine idrosolubili. Gli organismi animali devono assumerle con la dieta in piccole quantità giornalmente, perché non sono capaci né di sintetizzarle né di accumularle. Coenzimi nicotinammidici NAD+ (NICOTINAMMIDE ADENINA DINUCLEOTIDE) NADP+ (NICOTINAMMIDE ADENINA DINUCLEOTIDE FOSFATO) Derivano dall’acido nicotinico (niacina) o dalla nicotinammide (vitamina B3) Niacina Ac. nicotinico Sono coinvolti nelle reazioni di ossido-riduzione catalizzate dalle DEIDROGENASI, trasferiscono 2 elettroni e 1 protone dal o al substrato sottoforma di ione idruro :H- Sono associati al sito attivo dell’enzima attraverso interazioni elettrostatiche (debolmente) NAD+ (ossidato) 4 :H- + H+ + NADH (NADPH) (ridotto) + H+ (OPO32-) NADP+ ossidato fosfato in posizione 2 Attacco dello ione idruro può avvenire sopra (A) o sotto (B) il piano dell’anello nicotinammidico SPETTRO DI ASSORBIMENTO DEL NAD OSSIDATO RIDOTTO La misura dell’assorbimento a 340 nm consente di seguire il decorso di molte reazioni catalizzate dalle deidrogenasi NAD(P)+ dipendenti e costituisce la base per la determinazione di molti enzimi. Uno ione idruro :H- è trasferito dal C-4 del NADH al C-2 del piruvato + Lattato deidrogenasi Piruvato L-lattato Uno ione H+ è trasferito da un residuo di His del sito attivo dell’enzima sull’ossigeno carbonilico che diventa un ossidrile COENZIMI FLAVINICI FAD (FLAVINA ADENINA DINUCLEOTIDE) FMN (FLAVINA MONONUCLEOTIDE) Derivano dalla riboflavina (vitamina B2) 7 7,8-dimetil-isoallossazina 8 10 Ribitolo legato in N-10 Sono saldamente associati (in qualche caso anche covalentemente) al sito attivo di deidrogenasi chiamate flavoproteine. Partecipano a reazioni di ossidoriduzione in cui possono accettare o rilasciare 2 elettroni e 2 protoni (due atomi di idrogeno) Forma completamente ossidata 5 +H+ + e- 1 Centri reattivi: N-5 e N-1 .+ - +H+ + e- Semichinone Forma completamente ridotta + H+ + H:Accetta 1 atomo di idrogeno alla volta oppure 2 insieme COENZIMA A (HS-CoA) Deriva dalla vitamina B3 (ac. pantotenico) Trasferimento di gruppi acilici in reazioni di ossidazione di molecole energetiche e di biosintesi di carboidrati e lipidi. β-mercaptoetilammina Centro reattivo: gruppo tiolico –SH con cui forma il legame tioestere con i gruppi acilici che trasferisce. O ll H3C―C―S―CoA Acetil-CoA 3’-P-ADP (3’-fosfoadenosinadifosfato) TIAMINA PIROFOSFATO (TPP) Deriva dalla tiamina (vitamina B1) È il gruppo prostetico delle decarbossilasi (decarbossilazione degli α-chetoacidi). È anche il gruppo prostetico delle transchetolasi (trafserimento di gruppi a 2 atomi di Carbonio contenenti una funzione C=O) Protone dissociabile Centro reattivo: C-2 dell’anello tiazolico 2 + Il carbonio 2 dell’anello tiazolico è molto acido a causa dell’effetto elettronattrativo esercitato dall’N con carica positiva e dallo zolfo in 1 R3 2 R1 + R2 Piruvato α-chetoacido H+ rimosso da un residuo basico dell’enzima Enz-B: TPP (carbanione dipolare) Idrossietil-TPP Enz-B―H + carbanione stabilizzato da risonanza BIOTINA Sintetizzata dai batteri intestinali e poi assorbita H 1 3 H Centro reattivo H -CH2-CH2-CH2-CH2-COOH Biotina Lys-Enz. È il gruppo prostetico di enzimi che catalizzano reazioni di carbossilazione ATPdipendenti. Si lega al sito attivo attraverso un legame carboammidico con un residuo di Lys dell’enzima. ADP ATP + HCO3¯ carbossifosfato O O ll ll ¯O—C—O—P—O¯ l O¯ PO431 3 H .. H H 1 3 H H Enz Enz carbossibiotina Piruvato-carbossilasi CH2 O ll ¯O—C— 1 3 H Piruvato (forma enolica) H Enz .. H+ + 2 | COOOssalacetato H 1 3 H H Enz PIRIDOSSALE-FOSFATO (PLP) Deriva dalla famiglia delle Vitamine B6 (piridossale, piridossina) Il PLP è il gruppo prostetico di enzimi che catalizzano transamminazione, decarbossilazione, racemizzazione (L→D) che coinvolgono amminoacidi. Centro reattivo Centro reattivo Piridossalfosfato Piridossammina fosfato Quando l’enzima è “a riposo” Il PLP è legato all’enzima mediante un Base di Shiff che si forma fra il gruppo aldeidico del PLP e l’ε-amminogruppo di un residuo di Lys del sito attivo (Aldimmina interna) Il passaggio iniziale di tutte le reazioni enzimatiche PLPdipendenti che coinvolgono gli aminoacidi prevede l’ingresso dell’amminoacido nel sito attivo dell’enzima e la formazione di un’aldimmina esterna (1a base di Schiff). Il gruppo aldeidico del PLP si lega al gruppo α-amminico dell’amminoacido. α Aldimmina interna + aldimmina esterna - 1a base di Schiff Nelle reazioni di TRANSAMMINAZIONE catalizzate dalle transamminasi o amminotransferasi il gruppo α-chetoglutarato amminico di un amminoacido è trasferito su un α-cheto acido α-amminoacido L-glutammato α-chetoacido Le transamminasi rimuovono il protone H+ dal C-α per mezzo di un residuo di Lys del sito attivo dell’enzima. Si forma un Carbanione Enz ˡ Lys l ..NH2 stabilizzato per risonanza .. L’Enz. rilascia un H+ al C del centro reattivo del PLP +H H-N—Lys-Enz H riarrangiamento + Aldimmina esterna 1a base di Schiff L’anello piridinico positivo funziona da trappola di elettroni e stabilizza il carbanione che si forma. Chetimmina 2a base di Schiff Idrolisi della 2a base di Shiff Chetimmina α-cheto acido che si dissocia Piridossamminafosfato Il gruppo amminico della piridossammina-fosfato viene trasferito in una seconda fase su un secondo α-cheto acido attraverso una serie di passaggi inversi a quelli visti sinora: si ottiene un nuovo aminoacido e si rigenera il PLP COBALAMMINA Vitamina B12 Sintetizzata da alcune specie di batteri e assunta dall’uomo con alimenti di origine animale. È assorbita dalla mucosa intestinale grazie ad un fattore intrinseco. Prende parte a reazioni di ri-arrangiamento intramolecolare di tipo radicalico, catalizzate da mutasi o transferasi cobalammina Mutasi LIPOAMMIDE Forma Acido LIPOICO: acido carbossilico a ossidata 8 atomi di carbonio con due gruppi tiolici in C-6 e C-8. Viene sintetizzato dagli animali. Si lega con legame ammidico all’εamminogruppo di una Lys del sito attivo. È il gruppo prostetico delle diidrolipoammidi acetiltransferasi, enzimi che fanno parte di complessi multienzimatici (piruvato-deidrogenasi, α-chetoglutarato deidrogenasi) Forma ridotta Funziona come un braccio oscillante che trasferisce gruppi acilici Forma acetilata VITAMINE idrosolubili Vitamina C Vit. Complesso B Tiamina (B1) Riboflavina (B2) Niacina (B4) Biotina Ac. Pantotenico (B5) Ac. Folico Piridossina (B6) Cobalamina (B12) Ac. Lipoico liposolubili Vitamina A (retinolo, β-carotene) Vitamina D (colecalciferolo) Vitamina K (fillochinone) Vitamina E (tocoferolo) Coenzima Q (Ubichinone) Altamente idrofobiche, contengono anelli e lunghe catene alifatiche (costituite dal ripetersi di unità isoprenoidi). Sono assunte con la dieta Sono modificate e attivate nell’organismo VITAMINA A (retinolo): lipide a 20 atomi di carbonio con una catena poliinsatura a doppi legami coniugati, ottenuto direttamente dalla dieta o tramite il β-carotene. Taglio ossidativo Ossidazione (alcool > aldeide) in C-15 -retinolo deidrogenasi- Impulso nervoso al cervello > visione tutto-trans- luce buio È il gruppo prostetico delle opsine con cui costituisce le rodopsine, proteine dei fotorecettori della retina; l’assorbimento della luce converte il retinale cis in retinale tutto-trans RETINOLO Retinolo deidrogenasi RETINALE Retinale deidrogenasi AC. RETINOICO tutto-trans- Ossidazione (aldeide > acido) in C-15 Segnale ormonale che modula la trascrizione genica (cellule epiteliali) e controlla la differenziazione cellulare. VITAMINE D: gruppo di lipidi correlati. D3 (colecalciferolo): si forma in modo non-enzimatico nella pelle in presenza della luce solare a partire dal 7-deidrocolesterolo, D2: derivato metilato della D3, attivata in modo simile 2 reazioni di idrossilazione 7-deidrocolesterolo Colecalciferolo (D3) 1,25-diidrossicolecalciferolo Azione ormonale nel controllo dell’omeostasi del calcio (assorbimento intestinale, deposizione nelle ossa) Attivazione fotosensibile nella pelle D3 aumenta i livelli plasmatici di Ca2+ favorendo la decalcificazione dell’osso e l’assorbimento intestinale di Ca2+. Promuove la sintesi di proteine che trasportano il calcio. La sua azione sul tessuto osseo è finemente bilanciata da due altri ormoni: paratormone (agonista) e calcitonina (antagonista). 2a idrossilazione nel rene 1a idrossilazione nel fegato D3 attiva VITAMINA K (fillochinone). Richiesta per la sintesi di proteine coinvolte nella coagulazione del sangue. Nei mammiferi agisce da coenzima della CARBOSSILASI che catalizza la carbossilazione di residui di glutammato dei fattori di coagulazione. Carbossilasi Vit. K CO2 H+ P. Champe, R.Harvey, D.R. Ferrier, Le basi della biochimica, Zanichelli Ed. S.p.A. Copyright © 2006 UBICHINONE (COENZIMA Q): benzochinone con 4 sostituenti uno dei quali è una lunga catena isoprenoide (6-10 unità). Si solubilizza nel doppio strato lipidico delle membrane e essendo un forte agente ossidante ha un ruolo chiave nel trasporto di elettroni attraverso i complessi della catena respiratoria mitocondriale. O e 2)nH CH3O CH3 2H , 2e- CH 3 2 CH (CH O OH O CH3 O CH O CH +33O 1H+, 1eCH2)nH CH3O C coenzymeCHQ • CH3 e semichinone CH3 3 CH e3O+ 2 H+ O OH CH3O (CH2 CH C CH2)nH CH3O O coenzyme Q 1H+, 1e CH3 (CH2 CH OH C CH2)nH coenzyme Q • e + 2 H+ CH3 CH3O (CH2 CH C CH2)nH CH3O coenzyme QH2 OH Ossido-riduzione in 2 tappe CH3 oppure in un’unica tappa CH
Scaricare