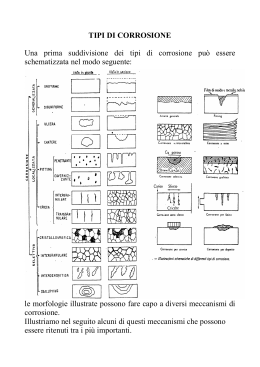
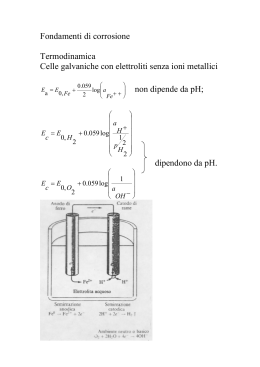
A Po P C l PL iL E a iv P or P no Corrosione e protezione in acqua di mare Luciano Lazzari PoliLaPP Laboratorio di Corrosione dei Materiali P. Pedeferri Dip. Chimica, Materiali e Ingegneria Chimica “G. Natta” Politecnico di Milano A Po P C l PL iL E a iv P or P no Le strutture Le strutture A Po P C l PL iL E a iv P or P no Strutture offshore Tubazioni sottomarine Imbarcazioni, mezzi navali, semisommergibili Porti, pontili, banchine, piattaforme Forme di degrado A Po P C l PL iL E a iv P or P no Corrosione da ossigeno Corrosione batterica Corrosione localizzata leghe resistenti a corrosione (CRA, es. acciai inossidabili) Corrosione delle armature del calcestruzzo armato Meccanismo di corrosione A Po P C l PL iL E a iv P or P no Processo di corrosione un metallo in una soluzione può subire corrosione attraverso una reazione di ossido-riduzione. Esempio: Fe + O2 + H2O = ruggine la reazione è spontanea in quanto ∆G < 0 avviene con meccanismo elettrochimico: Fe = Fe2+ + 2e (reazione anodica di ossidazione) O2 + 4e + H2O = 4OH- (reazione catodica di riduzione) 5 A Po P C l PL iL E a iv P or P no Meccanismo di corrosione il processo catodico (di riduzione) è in generale fornito da: O2 + 4e + H2O = 4OH- (riduzione di ossigeno) 2H+ + 2e = H2 (riduzione di idrogenioni) gli elettroni prodotti dalla reazione anodica sono “consumati” dalla reazione catodica i due processi (anodico e catodico) sono contemporanei e avvengono con la stessa velocità 6 Meccanismo di corrosione A Po P C l PL iL E a iv P or P no Processo di corrosione può essere schematizzato da quattro processi: lato anodico lato catodico lato metallo lato elettrolita “resi disponibili” elettroni “utilizzo” degli elettroni trasporto degli elettroni trasporto di ioni 7 Meccanismo di corrosione Im Corrente nell’elettrolita Ia = Iel = Ic = Im = ICORR Corrente nel metallo A Po P C l PL iL E a iv P or P no Ia Reazione Anodica Iel Reazione Catodica Ic 8 A Po P C l PL iL E a iv P or P no Profilo concentrazione ossigeno Ruolo dell’ossigeno Acqua dolce A Po P C l PL iL E a iv P or P no Solubilità O2 (mg/L) 10 8 Acqua di mare 6 4 2 0 0 50 100 150 200 Salinità (NaCl g/L) 250 300 A Po P C l PL iL E a iv P or P no Disponibilità dell’ossigeno Andamento qualitativo di iL Disponibilità dell’ossigeno ( ) A Po P C l PL iL E a iv P or P no i L = 10[O 2ppm] 1 + v 2 T − 20 20 iL (mA/m2 ≅ µm/anno) v (m/s) T ( C) iL = iprot A Po P C l PL iL E a iv P or P no Corrosione delle armature del C.A. A Po P C l PL iL E a iv P or P no Sono resistenti alla corrosione perchè si passivano (elevata alcalinità) Subiscono corrosione generalizzata Per carbonatazione (copriferro) Subiscono corrosione localizzata (pitting) Tenore critico di cloruri (≅ 600 ppm nel CLS) Gli acciai ad alta resistenza sono suscettibili di stress corrosion cracking (infragilimento da idrogeno) A Po P C l PL iL E a iv P or P no A Po P C l PL iL E a iv P or P no A Po P C l PL iL E a iv P or P no A Po P C l PL iL E a iv P or P no Pedeferri Diagram Potential (mV SCE) 400 200 Pitting can initiate and propagate Corrosion A Imperfect passivity B Pitting does not initiate but can propagate -800 Perfect passivity C Pitting does not initiate nor propagate -1000 Immunity D 0 -200 -400 -600 -1200 0 0.5 1 Chlorides (%) 1.5 2 Acciai inossidabili A Po P C l PL iL E a iv P or P no Sono resistenti alla corrosione perchè si passivano Subiscono corrosione localizzata pitting e crevice PREN index (Cr, Mo, N) Gli acciai inossidabili Austenitici sono suscettibili di stress corrosion cracking (T > 60 C) Acciai inossidabili Concentrazione critica dei cloruri A Po P C l PL iL E a iv P or P no PREN pH T PREN 7 − pH T − 20 − − K3 Log [Cl ] = 20 K2 K1 PREN = Cr% +3,3Mo% + X⋅N% (con X = 16-30) A Po P C l PL iL E a iv P or P no Pedeferri Diagram Potential (mV SCE) 400 200 Pitting can initiate and propagate Corrosion A Imperfect passivity B Pitting does not initiate but can propagate -800 Perfect passivity C Pitting does not initiate nor propagate -1000 Immunity D 0 -200 -400 -600 -1200 0 0.5 1 Chlorides (%) 1.5 2 Fouling Crescita di macro e micro organismi A Po P C l PL iL E a iv P or P no Zone sommerse Talvolta possono svolgere un’azione protettiva riducendo la diffusione di ossigeno Più frequentemente sono causa di corrosione localizzata Promuovono condizioni anaerobiche (batteri SRB) Corrosione per aerazione differenziale Degrado dei rivestimenti A Po P C l PL iL E a iv P or P no Fouling A Po P C l PL iL E a iv P or P no Fouling Le zone di corrosione marina Atmosferica A Po P C l PL iL E a iv P or P no Sopra la zona degli spruzzi Il meccanismo di corrosione è specifico (corrosione atmosferica) e dipende da: Formazione di un film di “elettrolita” • RH • Inquinanti (cloruri) • Vento • Temperatura La protezione dell’acciaio si realizza mediante rivestimenti (pitture) A Po P C l PL iL E a iv P or P no San Francisco – Golden gate Le zone di corrosione marina Esposta alle onde (Splash zone) A Po P C l PL iL E a iv P or P no Dal livello minimo di mare fino alla zona atmosferica • Zona inferiore (effetto delle maree) con immersione alternata • Zona superiore sempre bagnata (ma non immersa) a causa degli spruzzi Velocità di corrosione • Un ordine di grandezza superiore alla zona immersa per la maggiore ossigenazione Protection • Rivestimenti organici alto spessore • Rivestimenti metallici (leghe di rame) Le zone di corrosione marina A Po P C l PL iL E a iv P or P no Immersa Sempre a contatto con l’acqua di mare aerata La velocità di corrosione è uguale alla disponibilità di ossigeno: •Concenrazione di ossigeno •Velocità dell’acqua •Temperatura Metodo di protezione •Protezione catodica A Po P C l PL iL E a iv P or P no Piattaforma Tiffany Le zone di corrosione marina A Po P C l PL iL E a iv P or P no Zona del fango Ossigeno quasi assente Corrosione microbiologica (batteri SBR) Protezione: protezione catodica I metodi di prevenzione A Po P C l PL iL E a iv P or P no Materiali resistenti Scelta onerosa Raccomandata la PC (per passività) Rivestimenti Zona atmosferica Protezione catodica Zone immerse di tutte le strutture Acciaio: PC per immunità Inox e Calcestruzzo: PC per passività
Scaricare