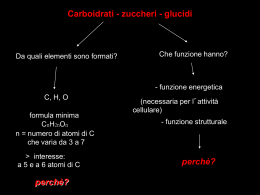
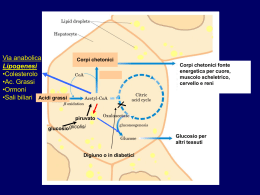
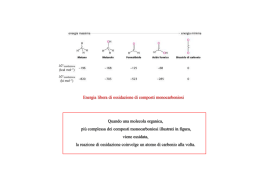
Il Fegato • Il fegato svolge una funzione preminente nel metabolismo generale. • Essendo a cavaliere tra circolo portale e circolo generale è in grado di smistare, modificandole o non modificandole le sostanze nutritizie. • Ha come funzione principale il controllo della glicemia Funzioni - E’ fonte costante di glucosio per l’organismo attraverso il glicogeno epatico - sintetizza il colesterolo e i grassi - sintetizza urea, corpi chetonici - sintetizza la maggior parte delle proteine plasmatiche (albumina) - regola il trasporto dei grassi e del colesterolo attraverso le lipoproteine - elimina le sostanze non escrete dal rene • Il fegato è l’unico organo che riceve oltre al: • Sangue arterioso (arteria epatica, proveniente dal cuore) che fornisce l’organo di ossigeno Sangue venoso (vena porta, proveniente dall’intestino) che porta le sostanze nutritizie assorbite a livello intestinale e gli ormoni prodotti dal pancreas Dotto epatico da cui defluisce la bile Morfologia • E’ formato da due tipi di cellule: Cellule parenchimatose o epatociti, circa il 70 % delle cellule epatiche, responsabili della maggior parte delle funzioni cellulari • Cellule di Kupfer, circa il 30 % delle cellule epatiche, adibite alla degradazione dell’emoglobina e a funzioni protettive (contengono un’elevata quantità di lisosomi, deputati ad una intensa fagocitosi) Gli epatociti hanno una grande capacità rigenerativa 4) Glicogenosintesi Metabolismo glucidico • Il fegato è il primo organo che ha la possibilità di utilizzare il glucosio proveniente dalla dieta. • Il fegato trattiene circa il 60% del glucosio proveniente dagli alimenti e lo trasforma in: • Glicogeno Destino Glucosio • Il glucosio entra nell’epatocita senza bisogno dell’intervento dell’insulina ma sfruttando dei trasportatori di membrana, sempre attivi. GLUT2 Glucosio Trasferisce il glucosio dal sangue quando è in eccesso Glucosio6P Glucosio ATP ADP Cinasi • La reazione è irreversibile ed è catalizzata da una esocinasi, enzima ha alta affinità per il glucosio, ma con una particolarità: è inibito dal prodotto della reazione, glucosio 6P (--) esochinasi (--) Glucosio Glucosio6P ATP ADP • Quando il Glu-6P all’interno dell’epatocita è a concentrazione elevata blocca la reazione e il glucosio potrebbe riuscire dalla cellula! Glucosio Glucosio • A livello epatico è presente un altro enzima la glucocinasi che catalizza la stessa reazione ma non viene inibita dal glucosio 6P Differenze nelle cinasi • Il fegato è l’unico organo ad avere l’enzima glucocinasi. • Questo enzima non viene: • Inibito da un eccesso di glucosio 6P come la esochinasi • Ha una specificità assoluta per il solo glucosio, ma affinità minore • E’ un enzima inducibile, sintetizzato sotto stimolo di insulina. Meccanismo operato dall’insulina Insulina RNAm Nucleo Recettore Insulina Glucocinasi Enzima induttivo Epatocita • La disponibilità da parte del fegato ad avere due cinasi (eso e glucocinasi) assicura a questo tessuto la capacità di estrarre dal sangue quantità rilevanti di glucosio rispetto ad altri tessuti e di immagazzinare quantità elevate di glicogeno. • La esochinasi è adibita alla glicolisi, la glucocinasi alla sintesi del glicogeno La sintesi del glicogeno nel muscolo è indipendente dalla glicemia e dipende dall’insulina Nel fegato la sintesi del glicogeno è dipendente dalla aumento della glicemia ovvero da un eccesso di glucosio Glicogeno sintetasi • L’enzima che sintetizza il glicogeno è la glicogeno sintetasi: • UDPG + Glicogenon Glicogeno sintetasi • UDP + Glicogenon+1 • L’enzima è attivo in forma defosforilata, ma a livello epatico, anche la forma fosforilata può funzionare in presenza di un eccesso di glucosio 6P, viene perciò indicato come glicogeno sintetasi dipendente Destino del Glucosio 6P Glicogeno Glucosio1P Glicogeno sintesi Glucosio Glucosio 6P ATP Ac Piruvico 6P gluconolattone NADPH.H+ Glicolisi Ciclo dei Pentosi Funzionalità epatica Il fegato può modificare il proprio metabolismo in funzione di differenti situazioni fisiologiche: Ø Dopo un pasto abbondante Ø In stato di digiuno breve o prolungato Buona alimentazione • Dopo una buona alimentazione il fegato metabolizza gli zuccheri ottenuti dalla dieta e ne ricava energia per fare la sintesi di: • Glicogeno • Acidi grassi e poi Trigliceridi • Proteine tissutali e plasmatiche • Colesterolo Buona alimentazione Insulina Vena porta Glucosio Glucosio Esocinasi Glucocinasi Glucosio 6P Intestino Il glicogeno epatico può raggiungere concentrazioni elevate Glicogeno ATP Ac Piruvico Acetil CoA CO2 Fegato Altri zuccheri • Anche il fruttosio e il galattosio, introdotti con la dieta possono essere trasformati in glicogeno: Galattosio Galattocinasi UDPUDP-Glucosio UMP – 1P Glucosio Galattosio 1P + Glicogeno Epimerasi Uridil UMPUMP-1P Galattosio UDPUDP-Galattosio Transferasi Glucosio1P Fruttosio Fru6P Cinasi ATP Fosfatasi Fruttosio 1,6 di P ADP Fruttosio 6P Pi Glucosio 6P Eccesso di fruttosio Glucosio 1P Glicogeno Eccesso di alimenti • Il fegato trasforma tutti gli alimenti introdotti in eccesso in grassi. • Per far funzionare la sintesi degli acidi grassi è necessario che siano disponibili nel citoplasma anche dei NADPH.H+, che si ottengono principalmente dal Ciclo dei Pentosi. Ciclo dei Pentosi Glu 6P deidrogenasi Glucosio 6P NADP+ 6 Fosfo Gluconolattone NADPH.H+ Sintesi Acidi grassi e Colesterolo Fruttosio 6P Lattonasi 6P Gluconato NADP+ 6P gluconato deidrogenasi NADPH.H+ CO2 Ribulosio 5P Ribosio 5P Biosintesi degli acidi grassi • Il fegato sintetizza gli acidi grassi a partire da un eccesso di glucosio nella dieta! • Il momento migliore si ha: • quando vi è un’abbondante riserva di ATP, in tal caso viene modificato il percorso del ciclo di Krebs: • il citrato viene trasferito nel citoplasma! Acidi Grassi (Acil (Acil CoA) CoA) Malonil CoA Acetil CoA Ossalacetato Glucosio Citrato liasi NADH.H+ Malato NAD+ Citrato NADPH.H+ Ac piruvico NADP+ Ac piruvico Ossalacetato Acetil CoA Citrato Isocitrato Isocitrato Deidrogenasi Inibito da eccesso di ATP Sintesi dei grassi • Il fegato formati gli acidi grassi li trasforma in trigliceridi (o grassi neutri): Glucosio 6P Diidrossiaceton fosfato (glicolisi) Dal Glucosio o dai Grassi della dieta NADH.H+ NAD+ Glicerolo 3P Tri-gliceride 2 Acil CoA CoA Acil CoA Pi DiDi-gliceride 2 CoA Acido fosfatidico Fosfatasi Acil CoA Sintetasi Sintesi del colesterolo • Questo composto viene sintetizzato quando il citrato viene esportato nel citoplasma: NADPH.H+ Acetil CoA Colesterolo Citrato liasi ATP Acil CoA ACAT Colesterolo esterificato Ossalacetato Citrato Sintesi delle lipoproteine • Il trasporto dei trigliceridi e del colesterolo, entrambi composti idrofobici, dal fegato agli altri tessuti avviene da parte delle: • Lipoproteine • Composti formati da un alto contenuto di lipidi (trigliceridi, colesterolo libero ed esterificato, fosfolipidi) e proteine (chiamate apo-proteine). Composizione lipoproteine • Le lipoproteine plasmatiche responsabili della veicolazione dei lipidi sono suddivisibili in 4 classi: Lipoproteina Origine Trigliceridi % Fosfolipidi % Colesterolo Lib, e Ester. Proteine % Intestino 83 - 88 4-7 4-8 1 -2 Fegato 50 – 60 18 - 20 14 - 18 8 - 12 Catabolismo 9 – 11 22 – 24 42 – 49 20 - 22 Fegato Intestino 2–8 26 – 30 17 – 20 50 - 52 Chilomicroni VLDL LDL HDL VLDL Struttura LDL • Hanno forma globulare, dove le apo-proteine, colesterolo libero e fosfolipidi formano uno strato entro il quale sono racchiusi i trigliceridi e il colesterolo esterificato Apo - proteine • Le apoproteine vengono sintetizzate dal fegato e non sono soltanto dei componenti strutturali, ma agiscono anche: Øda cofattori degli enzimi adibiti al metabolismo delle lipoproteine Øda strumenti di riconoscimento dei recettori per le lipoproteine Principali apo - proteine Apo proteina Componente Funzione A HDL Attiva l’enzima LCAT B - 100 VLDL e LDL Interagisce con il recettore delle LDL B -48 Chilomicroni Serve per il rilascio dei chilomicroni dall’intestino Attiva l’enzima lipoprotein lipasi CII Chilomicroni, VLDL HDL E VLDL e LDL e HDL Interagisce con il recettore epatico e ne favorisce la endocitosi Biosintesi VLDL • La biosintesi avviene nel fegato, la loro principale funzione è il trasporto dei trigliceridi (e in minor percentuale) del Colesterolo entrambi sintetizzati dal fegato. • Sono due le fonti degli acidi grassi che vanno a costituire i trigliceridi epatici: Ø quelli sintetizzati ex-novo dall’eccesso di glucosio Ø gli acidi grassi provenienti dall’alimentazione • Le apo-proteine A, B100, C ed E (sintetizzate dal fegato) si combinano con trigliceridi, fosfolipidi e colesterolo (libero ed esterificato) e vengono riversate in circolo. • Possono andare incontro a scambi con altre lipoproteine presenti nel sangue (ad esempio le HDL) ed acquisire la apoproteina CII che funziona da attivatore dell’enzima Lipo-protein Lipasi. B100, A, E VLDL TG Ch PL B100, A, E HDL CII B100, A, E Fegato TG Ch PL A, CII Pareti dei capillari Cellule adipose TG Ch PL CII Lipo pro tein lipasi Mono gliceride e Acidi grassi Meccanismo della Lipo protein lipasi • E’ un enzima che viene prodotto dalle cellule adipose e si fissa sulla membrana delle cellule dei capillari. L’insulina ne favorisce la sintesi. 2 Acidi Grassi O – CO- (CH2)n – CH3 OH O – CO- (CH2)n – CH3 O – CO- (CH2)n – CH3 2 H2 0 O – CO- (CH2)n – CH3 Trigliceride (delle VLDL) OH Monogliceride Destino delle VLDL • Le VLDL, per azione dell’enzima, si svuotono di Trigliceridi e (dopo contatti con HDL) anche di apo proteine A ed E, diventano un nuovo tipo di lipoproteine: le LDL. TG B100, A, E VLDL B100 LDL TG Ch PL A, E A, CII Ch PL • Le LDL contengono solamente fosfolipidi, colesterolo (libero o esterificato) e hanno il compito di trasferirlo ad altri tessuti, comprese le cellule endoteliali. • Circa i 2/3 viene trasferito agli altri tessuti, il rimanente va al fegato. • La captazione delle LDL da parte dei tessuti dipende dalla presenza di un recettore che interagisce con l’apoproteina B100 presente sulle LDL. Funzione delle HDL • Le HDL vengono sintetizzate dal fegato, ed hanno una forma discoidale, dovuta all’elevata quantità di fosfolipidi (intorno al 26-30%) e proteine (tra il 40 e il 50%) • Hanno il compito di rimuovere il colesterolo dalle membrane delle arterie e delle cellule endoteliali, trasferirlo al loro interno trasformandolo in colesterolo esterificato (per mezzo dell’enzima LCAT lecitina colesterolo acil – transferasi) e poi trasportarlo al fegato Colesterolo libero Rimozione Colesterolo HDL Col. Fosfolipidi O – P – Colina OH E O – CO - R Lisolecitina co--R1 -O-co O – P – Colina O – CO – R1 + Colesterolo esterificato E Si lega all’Apo A O – CO - R LCAT di i p i fol s Fo -OH -OH A, CI -OH A, CI Cellula endoteliale Col. Fosfolipidi HDL • La reazione catalizzata dalla LCAT avviene su un colesterolo presente sulla superficie delle HDL. • Per azione della LCAT il colesterolo viene esterificato, perde l’idrofilia e non può più rimanere sulla superficie. • Si internalizza e va a sistemarsi nel “core” della lipoproteina HDL HDL Globulari • Le HDL inizialmente hanno una forma discoidale, ma trasferendo il colesterolo in forma esterificata all’interno (core) ne modificano la struttura: • Le HDL da discoidali diventano globulari Colesterolo Esterificato Fegato Sintesi acidi biliari • Il colesterolo esterificato che raggiunge il fegato tramite le HDL viene utilizzato per la sintesi degli acidi biliari: • Acido Colico • Colesterolo Acido Cheno deossi Colico • Acidi Biliari Secondari Acidi Biliari Primari • Gli acidi biliari primari e secondari vengono immessi nella bile e inviati all’intestino, dove svolgono la loro azione emulsionante sui lipidi della dieta. • La maggior parte dei Sali biliari viene riassorbita a livello intestinale e ritorna al fegato. • La restante parte viene eliminata con le feci. Rappresenta l’unico modo per eliminare il colesterolo. Sintesi Proteine plasmatiche • Il fegato riceve gli aminoacidi provenienti dall’assorbimento intestinale e quelli prodotti dall’idrolisi proteica dei tessuti extraepatici, in particolare come abbiamo visto dai muscoli scheletrici sotto forma di: • Alanina • Glutammina • Qualsiasi sia la fonte, il fegato li utilizza per: Amino acidi Proteine ed enzimi epatici Proteine plasmatiche (Albumina, Globuline, fibrinogeno Fattori per la coagulazione (protrombina, ecc) Proteine trasporto (es: transferrina) Stato di digiuno breve • Dalle 4 alle 6 ore dopo un pasto • Non sono più disponibili alimenti! • Il principale problema per il fegato è mantenere costante il livello della glicemia, che nel periodo del digiuno: cala • in quanto i neuroni e i globuli rossi continuano a prelevare glucosio dal circolo. Glicogenolisi • In uno stato di ipoglicemia viene attivata la glicogenolisi ed inibita la glicogeno sintesi. • L’ormone coinvolto è il: • Glucagone • (prodotto dalle cellule α delle Isole del Langheras contenute nel pancreas) • L’ormone viene rilasciato nella vena porta che raggiunge subito il fegato Pancreas (cellule α) Glicogeno Glucagone Pi Fosforilasi Vena porta attiva Glucosio 1P Glucosio 6P Glucosio Glucosio 6P fosfatasi Azione del glucagone • L’azione del glucagone sulla cellula epatica è identico a quello operato dall’adrenalina sul muscolo scheletrico, il meccanismo prevede l’attivazione della adenilato ciclasi e con un meccanismo a cascata l’attivazione fosforilasi a che stacca il glucosio dal glicogeno. Adenilato ciclasi Glucosio Digiuno • Oltre alla glicogenolisi viene attivata anche la: Gluconeogenesi processo che prevede la sintesi di glucosio partendo da precursori non saccaridici La gluconeogenesi percorre le reazioni della glicolisi in direzione opposta: da fosfo enol piruvato PEP a glucosio Gluconeogenesi • Al fegato arriva attraverso il “Ciclo di Cori” sia il lattato proveniente dal catabolismo dei globuli rossi che l’alanina di origine muscolare. Fegato Gluconeogenesi Glucosio 6P Sangue Glucosio Globulo Rosso Glucosio Glucosio 6P Ac piruvico Ac. Piruvico Ac. Lattico Ac. Lattico Ac lattico Catabolismo Proteine muscolari Sangue Gluconeogenesi Glucosio Glu6P Glu.6P Glu.6P fosfatasi Frut. 6 P Piruvato Piruvato CO2 Frut.6P Frut.6P fosfatasi Piruvato Carbossilasi ATP Lattato Frut. 1,6 diP Aminoacidi Ossalacetato NADH.H+ NAD+ Acido Malico NAD+ CO2 Fosfo enol Piruvato (PEP) NADH.H+ ATP Ossalacetato PEP carbossi cinasi Acido Malico • Nel digiuno la lipogenesi è bloccata • Il fegato ricava energia cominciando a demolire gli acidi grassi (FFA) che provengono dal plasma • La glicolisi non funziona, è attiva invece come visto la gluconeogenesi • Gli aminoacidi provenienti dal plasma e dalle proteine tissutali vengono indirizzati verso la demolizione • La sintesi proteica è bloccata. Digiuno prolungato • Se il digiuno prosegue e supera le 12 ore le riserve di glicogeno epatico si sono quasi esaurite, i tessuti che utilizzano glucosio dipendono unicamente dalla gluconeogenesi epatica, che utilizza per fare glucosio: • Acido lattico (globuli rossi) • Alanina (muscolo scheletrico) • Glicerolo (dai trigliceridi del tessuto adiposo) • La gluconeogenesi utilizza in queste fasi principalmente aminoacidi (alanina, glutamina e glicina) che provengono principalmente dalla proteolisi delle proteine muscolari e altri aminoacidi che provengono dalla proteolisi delle proteine plasmatiche. • L’energia (ATP) che serve per far funzionare la gluconeogenesi proviene dalla demolizione epatica degli acidi grassi che provengono dal tessuto adiposo • La gluconeogenesi è stimolata dal glucagone e dagli ormoni glucocorticoidi (cortisolo) prodotti dalla ghiandola surrenale Cortisolo NH3 NH3 Ciclo Urea Ciclo Urea Sangue ATP per la gluconeogenesi • L’energia per far funzionare la gluconeogenesi proviene unicamente dalla demolizione degli: • Acidi Grassi • Provenienti dal tessuto adiposo e mobilitati sia dal glucagone che dall’adrenalina (liberata dallo stato di digiuno) Glucosio Glucosio 6P Gluconeogenesi Ac Lattico Ac. Ac. Piruvico Acil CoA Piruvico carbossilasi Oss Ac alac etat Piruvico o + Ac grassi Acil CoA Adipociti ox ß Fegato Acetil CoA ATP Krebs Citrato Eliminazione –NH2 • L’utilizzo dello scheletro carbonioso degli amino acidi per fare glucosio comporta che i meccanismi enzimatici preposti al distacco del gruppo –NH2 (trans-aminazione e desaminazione) siano particolarmente efficienti. • Il gruppo –NH2 staccato viene poi trasformato il urea nel processo denominato Ciclo dell’urea che è funzionante solo nel fegato Desaminazione α-Cheto Acido AA-NH2 Krebs NH3 + CO2 + 2ATP Carbammil Fosfato Ornitina Urea NH2 NH2 Ac fumarico -NH2 Acido Aspartico + ATP NH2 Ciclo dell’urea Se il Digiuno continua … ß - Ox Acetil CoA = 1000 = 600 ? = 1000 Ossalacetato Citrato = 400 Ac piruvico Glucosio Ma poiché poiché il glucosio esce dal fegato e pertanto molto poco diventa ac. ac. Piruvico ….. Corpi Chetonici Muscolo, Cuore, Cervello Chetogenesi • L’eccesso di Acetil CoA trasformato in Corpi chetonici: • 3 Acetil CoA viene HMGCoA Acetil CoA HMGCoA liasi Acetoacetato ß –idrossi butirrato • Nelle fasi di digiuno prolungato aumenta in circolo la concentrazione dei Corpi chetonici prodotti dal fegato. • L’aumentato livello di corpi chetonici nel sangue rappresenta per il cuore e per il cervello un compenso per la concomitanza diminuzione di glucosio • L’acidità dei Corpi chetonici (acidosi metabolica) viene ampiamente tamponata dalle riserve di bicarbonati che sono presenti nel plasma • Se il digiuno si prolunga (dopo le 24 ore) si osserva un calo della velocità della gluconeogenesi epatica, in quanto soprattutto il cervello utilizza preferibilmente i corpi chetonici e in minor quantità il glucosio. • Se il digiuno prosegue, è soprattutto a carico di questi composti che ricava energia il cervello. • Fino a quando ci sono Corpi chetonici, si risparmia anche sulle proteine muscolari. • Si consumano in tal modo le riserve adipose. Cellule non parinchematose • Sono le cellule del Kupfer, svolgono un’azione di degradazione di materiali estranei o di materiali da eliminare che viene indicata come processo di: • detossificazione • Per fare ciò devono il più delle volte rendere queste molecole più idrosolubili onde facilitarne la eliminazione renale Reazioni di detossificazione • Idrossilazione • Viene trasformato un C=O in un C-OH, la molecola è pertanto più solubile il donatore di H+ è il NADPH.H+ (Es: sintesi di derivati steroidei, viene utilizzato un particolare sistema enzimatico associato alla membrana del reticolo liscio detto Citocromo p450) • Coniugazione • Un composto non solubile viene coniugato con la glicina, o con un residuo di acido solforico (solfato), diventando più solubile (Es: inattivazione degli ormoni) Reazione di coniugazione • Con l’acido glucuronico • E’ il meccanismo più seguito nel fegato! • Sia sostanze di derivazione del colesterolo (derivati di origine steroidea) che la bilirubina, prodotta dal catabolismo dell’emoglobina vengono coniugate con l’acido glucuronico. Metabolismo dell’etanolo • A differenza delle droghe, l’etanolo viene considerato un “pseudo-alimento” • Ha un elevato contenuto energetico: 1g di etanolo produce 7 Kcal/g • Ma a differenza degli alimenti classici (glucidi, lipidi e proteine) che se introdotti in eccesso possono essere accumulati, l’etanolo non viene mai depositato, bensì catabolizzato o eliminato al più presto Alcool • Alcuni studi hanno rilevato che basse quantità di alcool, in un range di 10-30 g/die (2-3 bicchieri di vino al die) svolgono un’azione protettiva nei confronti della mucosa gastrica, con effetti protettivi. • Inoltre è bene ricordare che nel vino alcuni componenti minori (polifenoli e procianidine) hanno un’azione protettiva contro le malattie cardiovascolari. Etanolo • Mentre i comuni nutrienti vengono utilizzati da tutti i tessuti: l’etanolo è metabolizzato primariamente solo dal fegato L’etanolo viene assorbito dall’intestino tenue ed in parte anche dallo stomaco per libera diffusione. La barriera gastrointestinale non oppone alcun controllo al suo assorbimento • Viene trasferito al fegato che è l’organo maggiormente impegnato nel suo metabolismo. • Se introdotto in quantità limitate: • l’etanolo viene ossidato ad aldeide acetica nel citoplasma ad opera dell’Alcool deidrogenasi, deidrogenasi e poi trasferito nel mitocondrio, dove viene trasformato in acido acetico ad opera dell’acetaldeide deidrogenasi. • La quantità maggiore di acido acetico viene riversata nel sangue. • Una parte viene trasformato, ad opera della acetato tio-cinasi, in Acetil CoA che entra nel ciclo di Krebs per trasformarsi in CO2 ed acqua. Moderata introduzione di etanolo Etanolo Etanolo Alcool DH NAD+ NADH.H+ Aldeide Acetica Acetal deide DH NAD+ NADH.H+ Acido Acetico Acetil CoA Sangue Acetato tiochinasi CO2 Epatocita L’enzima l’acetato tio-cinasi è poco attivo nel fetato, mentre è molto attivo nei tessuti extraepatici (e in particolare nel miocardio) CO2 + H2O Via Alternativa • Esiste a livello epatico una via ossidativa alternativa che l’etanolo può seguire, in quanto viene considerato come un elemento estraneo e pertanto da eliminare. • Questa via è costituita dalle membrane del reticolo endoplasmatico ed è denominata come: • MEOS • Funzione poco quando vengono ingerite quantità limitate di etanolo, diventa predominante in presenza di eccesso di alcool. • Il sistema MEOS, ossida l’etanolo ad acetaldeide utilizzando il NADPH.H+ e una particolare proteina contenente il Ferro denominato: Citocromo p450. • La sintesi di questa proteina è indotta dallo stesso etanolo. • Funziona così: • CH3-CH2-OH CH3 - CHO NADPH.H+ NADP 2H+ + 2H+ Cit 450 Fe2+ 2H2O Fe3+ O2 Funzione del MEOS • Serve per metabolizzare e demolire sostanze estranee, anche di tipo farmacologico. • In presenza di un eccesso di alcool si impedisce l’azione sui farmaci. • Questo porta a gravi conseguenze in soggetti etilisti cronici, a cui non possono essere somministrati specifici farmaci. Metabolismo gastrico • L’alcool etilico può venir metabolizzato anche dalla muscosa gastrica dove è presente una Alcool deidrogenasi, molto attiva nell’uomo e meno nella donna. • Questo enzima perde la sua efficacia con l’aumentare dell’alcool ingerito. • Questo sistema ha la funzione di “barriera” nei confronti della penetrazione dell’etanolo nel circolo sistemico. Etanolo in eccesso • Gran parte delle alterazioni metaboliche del fegato indotte all’etanolo introdotto in eccesso, sono conseguenti all’eccessiva produzione di: • NADH.H+ • dovute all’ossidazione dell’etanolo ad aldeide acetica. • Questo comporta la conseguente scarsa o nulla disponibilità di: • NAD+ Dosi elevate di etanolo Etanolo Eccesso di NADH.H+ NAD+ Sangue NADH.H+ Aldeide Acetica Aldeide Acetica NAD+ Sangue NADH.H+ Acido Acetico Mancanza di NAD+ a livello del citoplasma: problemi per la glicolisi L’aldeide acetica aumenta, non tutta viene eliminata nel sangue e se rimane nell’epatocita può generare radicali liberi I radicali liberi prodotti possono bloccare il 1° complesso enzimatico della Catena respiratoria Blocco del Ciclo L’eccesso di di Krebs NADH.H+ Riossidazioni del NADH.H+ • In soggetti etilisti, l’NADH.H+ in eccesso nel citoplasma viene riossidato a NAD+: • 1° il piruvato viene trasformato in lattato: Ac piruvico NADH. H+ Ac. lattico NAD+ Sia il piruvato che il lattato non possono più essere utilizzati per fare glucosio: ipoglicemia • 2° Il NADH.H+ viene riossidato prelevando un componente della glicolisi: Diossiaceton fosfato glicerol Fosfato NADH.H+ NAD+ Acil Coa L’eccesso di aldeide acetica, che forma acido acetico (poi Acetil CoA), e la disponibilità di glicerol Fosfato porta alla formazione di Trigliceridi che si accumulano nel fegato: STEATOSI Trigliceridi
Scaricare