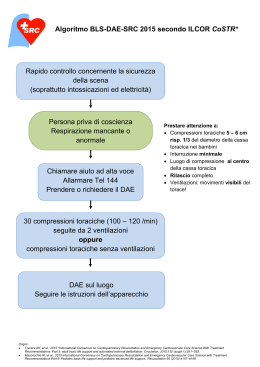
FAQ ALS 1) Che cosa è il “gasping”? Il “gasping” è un respiro agonico caratterizzato da atti respiratori occasionali, superficiali e non efficaci dal punto di vista ventilatorio, con assenza di movimenti della gabbia toracica; pertanto un paziente che presenta gasping si deve considerare in assenza di attività respiratoria. 2) Se il paziente non è cosciente, non respira e sono indeciso sulla presenza o meno del polso carotideo o dei segni di circolo (MO.TO.RE.), come devo procedere? È consigliato in tale situazione procedere senza indugio alle manovre rianimatorie iniziando con 30 compressioni e 2 insufflazioni; i danni che potrebbero essere arrecati al paziente praticando le compressioni toraciche in caso di cuore battente sono trascurabili rispetto ai danni conseguenti al mancato inizio delle manovre rianimatorie in un paziente in arresto cardio-circolatorio. 3) In caso non abbia un pallone AMBU, se trovo un paziente in arresto cardiocircolatorio posso effettuare solo le compressioni toraciche esterne? Se il soccorritore non possiede presidi atti a effettuare le ventilazioni senza contatto diretto, come si verifica in caso di ventilazione bocca a bocca, è consigliato procedere alle sole compressioni toraciche. Esistono evidenze scientifiche che dimostrano che la RCP effettuata anche solo con le compressioni toraciche esterne garantisce una sopravvivenza maggiore rispetto a un atteggiamento attendistico. 4) Nella paziente gravida (stato di gravidanza avanzato) la posizione delle mani per il massaggio cardiaco è la stessa? Nella paziente in fase di gravidanza avanzata (dopo la 20a settimana) l’utero gravido può comprimere la vena cava inferiore e l’aorta, ostacolando sia il ritorno venoso, sia la gittata cardiaca, per tale motivo è indicato lo spostamento manuale dell’utero gravido a sinistra e il posizionamento della paziente in lieve decubito laterale sinistro (angolo di 15-30° - utile posizionamento su tavola spinale). La posizione delle mani per le compressioni toraciche esterne deve essere sempre sulla linea mediana dello sterno, ma tra il terzo superiore e il terzo medio. 5) Se il paziente va in arresto cardio-circolatorio davanti a me (arresto cardiocircolatorio testimoniato) e inizio le manovre rianimatorie per quanto tempo devo andare avanti? Una volta confermato l’arresto cardiaco, quindi di fronte ad un paziente che non è cosciente, non respira e non ha polso, è necessario iniziare immediatamente le manovre rianimatorie con le compressioni toraciche esterne e le ventilazioni; tali manovre devono proseguire sino a quando non avremo a disposizione un monitor defibrillatore che ci consentirà di controllare il ritmo effettuando un “quick look” e provvedendo, in caso indicato, alla defibrillazione. Le linee guida 2010, al contrario delle precedenti, non consigliano mai di effettuare due minuti di rianimazione cardiopolmonare prima dell’analisi del ritmo, ma enfatizzano al contrario l’efficacia della defibrillazione precoce dei ritmi defibrillabili. IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 1 di 18 6) Quanto tempo posso impiegare per valutare il ritmo al monitor dopo i due minuti di RCP? Il tempo che si deve impiegare per la valutazione del ritmo dopo ogni ciclo di rianimazione cardiopolmonare è il minore possibile, ma comunque non superiore ai 5 secondi, tempo sufficiente per stabilire se si tratta di un ritmo defibrillabile o meno; evidenze scientifiche dimostrano infatti l’utilità di ridurre al minimo il periodo di assenza di compressioni toraciche esterne. 7) Se al monitor vedo una traccia e sono indeciso tra una FV a basso voltaggio e un’asistolia, come mi devo comportare? Capita talvolta che una FV a basso voltaggio possa essere confusa con un’asistolia, in quanto l’asistolia non si presenta con una linea perfettamente piatta. In tali situazioni la diagnosi di ritmo potrebbe essere più complicata, ma comunque il tempo utilizzato per effettuare una diagnosi non deve essere superiore ai 5 secondi: pertanto in caso di dubbio si deve procedere con le compressioni toraciche esterne e le ventilazioni. Infatti, la FV molto fine difficilmente può essere convertita dalla defibrillazione in un ritmo emodinamicamente valido. Una RCP ininterrotta e di buona qualità può invece aumentare l’ampiezza della FV migliorando la probabilità di convertirla con la defibrillazione in un ritmo emodinamicamente valido. 8) Durante la carica del defibrillatore bisogna continuare le compressioni toraciche esterne? Le linee guida 2010 enfatizzano l’importanza delle compressioni toraciche esterne immediate e ininterrotte. Le compressioni toraciche vanno, infatti, interrotte solo per controllare il ritmo al monitor e durante l’erogazione dello shock. Quando sono presenti due soccorritori, quello che usa il defibrillatore applica le piastre mentre è in corso la RCP. Con la defibrillazione manuale, è consigliabile effettuare la RCP durante la carica del defibrillatore riducendo così la pausa pre-shock a meno di 5 secondi. Per motivi di sicurezza, durante la carica del defibrillatore, gli altri componenti del team si devono allontanare dal paziente, contribuendo alla sicurezza dell’operazione, mentre chi effettua le compressioni toraciche esterne si allontanerà quando la carica del defibrillatore sarà completa. 9) Se non si conosce il defibrillatore che si ha a disposizione, quale energia devo usare per defibrillare? È buona norma conoscere sempre gli strumenti con i quali si lavora; se, per vari motivi, non si conosce il defibrillatore da utilizzare, poiché lo scopo è quello di interrompere il ritmo defibrillabile nel più breve tempo possibile, è consigliato utilizzare l’energia massima che il defibrillatore può erogare anche già a partire dal primo shock. 10) In caso di FV/TV refrattaria dopo aver somministrato 300 mg di amiodarone, se non si interrompe il ritmo defibrillabile, posso usare altri farmaci? Si parla di FV e TV refrattarie, quando, dopo aver erogato tre shock non si è riusciti ad interrompere questa aritmia; le linee guida consigliano, dopo il terzo shock, la somministrazione di 1 mg di adrenalina e di 300 mg di amiodarone durante i due minuti di IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 2 di 18 RCP; se dopo questo ciclo di rianimazione persiste ancora il ritmo defibrillabile, subito dopo aver erogato il quarto shock si può somministrare un altro bolo di 150 mg di amiodarone. La lidocaina è indicata solo se non si possiede l’amiodarone e comunque non deve essere praticata se si è già somministrato l’amiodarone; la dose di lidocaina consigliata è di 1-1.5 mg/Kg di peso corporeo, si può somministrare un bolo aggiuntivo di 50 mg, se necessario, tenendo però presente che la dose totale non può superare i 3 mg/Kg nella prima ora. 11) In caso di asistolia si può somministrare atropina? Le linee guida del 2010 non consigliano l’uso routinario di atropina in caso di asistolia e/o di PEA: durante l’arresto cardiaco, infatti, l’asistolia è in genere causata da una patologia primaria del miocardio piuttosto che da un ipertono vagale. 12) Se il paziente ha inizialmente un ritmo non defibrillabile e poi cambia in ritmo defibrillabile, quando si somministrano l’adrenalina e l’amiodarone? Se il paziente in arresto cardiocircolatorio presenta un ritmo non defibrillabile è indicata la somministrazione di 1 mg di adrenalina il prima possibile, vale a dire appena reperito un adeguato accesso venoso o intraosseo; la successiva dose di adrenalina verrà somministrata dopo 3-5 minuti dalla prima, indipendentemente dal ritmo presente al monitor, se il paziente continuerà ad essere in arresto cardiocircolatorio; i 300 mg di amiodarone dovranno essere somministrati solo in caso di FV/TV refrattarie, cioè dopo il terzo shock. Per fare un esempio pratico, se il paziente in arresto cardiocircolatorio presenta inizialmente una PEA si provvederà subito alla somministrazione di 1 mg di adrenalina seguito da due minuti di RCP; si valuterà il ritmo al monitor e se si dovesse osservare un ritmo defibrillabile si provvederà a defibrillare in sicurezza; si faranno altri due minuti di RCP poi si controllerà il monitor e se ad esempio fosse ancora presente un ritmo defibrillabile si erogherà il secondo shock seguito da 1 mg di adrenalina, dal momento che sono trascorsi circa 4-5 minuti dalla prima somministrazione di adrenalina. 13) Se durante la rianimazione cardiopolmonare posiziono una maschera laringea (LMA) posso ventilare in modo asincrono rispetto al massaggio cardiaco? Mentre la ventilazione asincrona con il massaggio è sempre possibile in caso intubazione tracheale, una volta posizionato un presidio sovraglottico, come la LMA, si può tentare di effettuare le compressioni toraciche continue senza interrompersi per le ventilazioni. Se durante le ventilazioni la perdita di gas è tale da rendere inadeguata la ventilazione è opportuno tornare ad effettuare la rianimazione cardiopolmonare effettuando le 2 ventilazioni alternate alle 30 compressioni toraciche. 14) Cosa succede se iperventilo il paziente? Il numero di ventilazioni ottimali in un paziente che ha ripreso un circolo spontaneo dopo un arresto cardiaco si aggira intorno ai 10-12 atti al minuto; ciò comporta una ventilazione ogni 5-6 secondi. Se si dispone di un ventilatore e il paziente è intubato si può connettere il tubo al ventilatore che verrà programmato per questo numero di atti respiratori al minuto. Nel caso in cui la ventilazione debba essere assicurata manualmente dall’operatore, è importante evitare di effettuare un numero di ventilazioni rispetto alle 10-12 consigliate. La PaCO2 (pressione parziale di CO2 nel sangue arterioso) è normalmente di 35-45 mmHg. Se IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 3 di 18 la produzione metabolica di anidride carbonica rimane costante, l’unico fattore che influisce sulla quantità nel sangue è la velocità alla quale viene rimossa dalla ventilazione alveolare. Una diminuzione della ventilazione alveolare riduce l’eliminazione di CO2 causando un aumento della PaCO2; al contrario se la ventilazione aumenta, al punto che la CO2 viene rimossa più velocemente, si ottiene una riduzione della PaCO2. Pagina | 4 di 18 Quello che è fondamentale tenere presente è che il livello di CO2 nel sangue regola anche il flusso ematico cerebrale; in caso di riduzione del livello di CO2 nel sangue arterioso si ha una vasocostrizione cerebrale con conseguente riduzione dell’apporto di ossigeno al tessuto cerebrale, verosimilmente già ipossico a causa dell’arresto cardiaco precedente al ROSC e che è particolarmente dannoso soprattutto nella fase post arresto cardiaco 15) Se posiziono un accesso intraosseo posso somministrare qualsiasi farmaco e/o soluzione o ci sono delle controindicazioni? L’accesso intraosseo è un’alternativa utile nel caso in cui non sia possibile reperire un accesso venoso periferico dopo due o tre tentativi; è fondamentale conoscere bene la procedura ed attenersi scrupolosamente ad essa; attraverso la via intraossea si possono somministrare tutti i farmaci e fluidi che si somministrano per via endovenosa, fatta eccezione per i chemioterapici e, secondo alcuni studi, anche le soluzioni ipertoniche; le dosi dei farmaci sono le stesse della via venosa periferica. E’ possibile somministrare anche emoderivati. 16) Si possono somministrare i farmaci per via endotracheale? L’utilizzo della via endotracheale non è più consigliato; in alternativa al mancato reperimento della via venosa periferica si preferisce utilizzare l’accesso intraosseo che offre maggiori garanzie sia in termini di sicurezza di assorbimento di farmaci, sia come possibilità di poter infondere anche grandi volumi di liquidi. Se l’accesso venoso periferico o l’accesso intraosseo non sono disponibili, farmaci liposolubili quali adrenalina, vasopressina, lidocaina e naloxone possono essere somministrati per via endotracheale durante arresto cardiaco (evidenza classe IIb); per via endotracheale bisogna somministrare dosi 2-2,5 volte superiori rispetto alla via venosa periferica e bisogna diluire i farmaci in 5 -10 ml di soluzione fisiologica; sarebbe opportuna la somministrazione attraverso un catetere che superi il tubo endotracheale in modo da favorire l’assorbimento attraverso la mucosa bronchiale. 17) Se si sospetta un’embolia polmonare si può fare la terapia trombolitica durante la rianimazione cardio-polmonare? Se si ritiene che la causa reversibile più probabile di arresto cardiocircolatorio del paziente possa essere una tromboembolia polmonare, bisogna considerare la possibilità di somministrare immediatamente un agente trombolitico quale alteplase alla dose di 50 mg a bolo. Il trombolitico deve essere somministrato senza interrompere le manovre rianimatorie. Dopo fibrinolisi bisogna continuare la RCP per almeno 60-90 minuti prima di interrompere i tentativi di rianimazione, in quanto è questo il tempo medio che impiega il farmaco per poter agire. Sono stati riportati casi di sopravvivenza con buon esito neurologico anche dopo 60 m IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 18) Durante le manovre rianimatorie in caso di arresto cardio-circolatorio si può fare anche l’ecografia? L’ecografia è ormai diventata sempre più un presidio diagnostico utile e indispensabile anche durante la gestione di un arresto cardiocircolatorio. In mani esperte può essere utile per l’individuazione di cause potenzialmente reversibili di arresto cardiaco, come il tamponamento cardiaco, l’embolia polmonare, la trombosi coronarica, l’ipovolemia o il pneumotorace iperteso. È raccomandata una posizione sottoxifoidea della sonda ecografica; è utile, per non interrompere le manovre rianimatorie, posizionare la sonda poco prima della pausa delle compressioni toraciche per la valutazione programmata del ritmo; in tale momento di assenza di manovre rianimatorie si possono ottenere immagini entro 10 secondi. 19) L’arresto cardio-circolatorio è sempre prevedibile? La maggior parte degli arresti cardiocircolatori che si verificano in ospedale non sono eventi improvvisi o imprevedibili; in circa l’80% dei casi si osserva un deterioramento clinico nelle ore immediatamente precedenti l’arresto. Questi pazienti spesso mostrano una lenta e progressiva alterazione dei parametri vitali, per lo più per problemi delle vie aeree (A), del respiro (B) o del circolo (C), che sfuggono all’attenzione del personale sanitario o non vengono adeguatamente trattati. Il riconoscimento precoce ed un trattamento adeguato dei pazienti critici possono consentire di prevenire un certo numero di arresti cardiaci, di decessi e di ricoveri imprevisti in terapia intensiva. 20) Che differenza esiste tra NSTEMI e Angina Instabile? Le SCA si presentano dal punto di vista clinico in modo analogo; il paziente riferisce spesso comparsa di dolore toracico di tipo oppressivo o costrittivo e talvolta dolore in sede epigastrica; tale sintomatologia dolorosa, di solito della durata di almeno 20-30 minuti, si irradia spesso alla gola, ad uno o ad entrambi gli arti superiori, al dorso o all’epigastrio. L’ECG occasionalmente può essere normale o presentare alterazioni aspecifiche sia per NSTEMI che per Angina Instabile (UA), quali un sottoslivellamento del tratto ST o l’inversione delle onde T. Nello NSTEMI è presente una positività della troponina con o senza innalzamento degli altri markers di necrosi miocardica, che indica che è avvenuto un danno miocardico; la troponina risulta invece normale nell’Angina Instabile. La quantità di troponina liberata riflette l’entità del danno miocardico. 21) In caso di SCA la somministrazione dei nitrati è sempre indicata? I nitrati causano rilasciamento della muscolatura liscia vascolare con conseguente dilatazione delle arterie coronariche e riduzione dello spasmo coronarico nel muscolo liscio. Per tale azione i nitrati trovano indicazione in tutte le sindromi coronariche acute purché la pressione arteriosa sistolica (PAS) sia superiore ai 90 mmHg; particolare cautela va posta nei pazienti con STEMI inferiore (ST sopraslivellato in DII D III AVF); in questo caso è indispensabile escludere la compromissione del ventricolo destro, che è irrorato in un terzo dei casi dalla coronaria destra, come lo è la parete inferiore del ventricolo sinistro. Il ventricolo destro viene studiato con le derivazioni destre V3R-V4R spostando cioè le derivazioni V3 e V4 da sinistra a destra negli spazi intercostali corrispondenti e valutando, in IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 5 di 18 queste derivazioni, l’eventuale presenza di ST sopraslivellato. L’evidenza di ST sopraslivellato in V3R-V4R è indice di infarto del ventricolo destro che, quando presente, controindica la somministrazione di nitrati, in quanto questi, determinando venodilatazione, riducono il precarico con rischio di grave ipotensione. 22) In caso di allergia all’aspirina quale farmaco può essere somministrato come alternativa? L’ASA agisce inibendo la sintesi delle prostaglandine. A basse dosi (40-325 mg/die) l’azione dell’ASA risulta selettiva a livello piastrinico, dove inibisce in modo irreversibile la sintesi di trombossano A2, potente vasocostrittore e aggregante piastrinico (effetto antitrombotico). In caso di IMA, l’ASA è risultato efficace sia nella prevenzione primaria, in caso di paziente con sospetto infarto acuto, sia nella prevenzione secondaria. L’importanza dell’impiego dell’ASA in pazienti con sospetto infarto è stato evidenziato nello studio ISIS-2. In questo studio la somministrazione di ASA è risultata efficace nel ridurre la mortalità, sia in monoterapia che in associazione con eparina senza incrementare il rischio di emorragie gastro-intestinali. Il problema sorge qualora il paziente riferisca una sicura o probabile allergia all’aspirina; in tali situazioni la somministrazione di ASA è da bandire e si preferisce utilizzare solo il secondo antiaggregante piastrinico (il più indicato a seconda delle caratteristiche del paziente tra Prasugrel, Clopidogrel o Ticagrelor) alla dose di carico. 23) Se il paziente ha una SCA, la somministrazione di ossigeno è sempre indicata? Nelle SCA la somministrazione di O2 è indicata e volta a mantenere una SpO2 di 94-98% nel soggetto normale e di 88-92% nel soggetto ipercapnico, ad esempio affetto da BPCO. Diversi studi su animali indicano che l’iperossiemia causa stress ossidativo che danneggia i neuroni nella fase post-ischemica. Uno studio clinico ha mostrato che l’iperossiemia postrianimazione è associata a prognosi peggiore rispetto alla normossiemia. In caso non si disponga di un saturimetro è consigliata la somministrazione di ossigeno sino a che non si sia in grado di valutare la saturazione ed eventualmente sospenderne la somministrazione. 24) Come si somministra la morfina? La morfina è un potente antidolorifico e trova indicazione nel trattamento del dolore da moderato a grave. Gli effetti della morfina a livello cardiovascolare sono determinati dall’induzione di liberazione di istamina con conseguente vasodilatazione arteriolare e venosa. È pratica comune la somministrazione di morfina in caso di insufficienza ventricolare sinistra acuta al fine di ottenere una riduzione del precarico ventricolare. La somministrazione di morfina in caso di infarto acuto del miocardio con interessamento del ventricolo destro è controindicata, in quanto in tale situazione una marcata riduzione del ritorno venoso può determinare effetti emodinamici sfavorevoli. Per la somministrazione, si consiglia di prendere una fiala di morfina da 10 mg/ml e diluirla con 9 ml di soluzione fisiologica in siringa da 10 ml; si ottiene così una concentrazione di 1 mg/ml; si somministrano per via e.v. lenta 2-4 ml della soluzione ogni 5-20 minuti sino all’ottenimento dell’effetto desiderato o alla comparsa di effetti indesiderati, anche se si consiglia di non superare la dose massima di 20 mg. Bisogna fare attenzione soprattutto ai pazienti con BPCO, grave cifoscoliosi, obesità grave e comunque a tutti quei pazienti che IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 6 di 18 presentano una ridotta riserva respiratoria, per la possibile depressione dei centri respiratori. È utile, quando si somministra la morfina, avere a disposizione l’antidoto specifico (Naloxone). 25) Perché un BBsx di nuova insorgenza deve essere considerato alla stregua di uno STEMI? Pagina | 7 di 18 Per “blocco di branca” intendiamo il rallentamento o l’interruzione della propagazione dell’impulso a livello di branca destra o sinistra del fascio di His. La cardiopatia ischemica, acuta e cronica, le miocardiopatie e altre patologie possono essere alla base di un blocco di branca. Non sempre il blocco di branca è segno di cardiopatia. Anche nel cuore normale può verificarsi un ritardo di attivazione senza che questo comprometta la salute del paziente; questa affermazione, è valida soprattutto per il BBD e lo è meno per il BBS che, molto frequentemente, è segno di cardiopatia anche importante o incipiente. Dal punto di vista ECG il tratto ST nel BBS non è valutabile, per cui un BBSx di nuova insorgenza viene considerato equivalente a uno STEMI. 26) La terapia trombolitica in caso di STEMI può essere iniziata sul territorio? È ormai appurato che il paziente che presenta uno STEMI, debba arrivare nel laboratorio di emodinamica nel più breve tempo possibile, per essere sottoposto ad angioplastica primaria, qualora questa sia prevista. Per tale motivo in gran parte del territorio nazionale si è sviluppata la “rete cardiologica dello STEMI” che prevede il trasporto del paziente con STEMI direttamente dal territorio al laboratorio di emodinamica senza passare per il Pronto Soccorso dell’Ospedale. Il trattamento preospedaliero dello STEMI dovrebbe prevedere la somministrazione, così come da linee guida internazionali, nel “più breve tempo possibile” di aspirina come primo antiaggregante piastrinico, di nitrati, se indicati, e di ossigeno, se indicato; è inoltre auspicabile la somministrazione, già sul territorio, del secondo antiaggregante piastrinico (Clopidogrel, Prasugrel Ticagrelor); si dovrebbe prevedere anche la somministrazione di eparina sodica o eparina a basso peso molecolare. 27) La terapia trombolitica in caso di STEMI quando trova indicazione? La fibrinolisi è una valida opzione terapeutica in caso di STEMI se i tempi di trasporto all’ospedale munito di emodinamica sono molto lunghi. Se il tempo per effettuare un’angioplastica primaria è superiore a due ore dal primo contatto medico, è indicata la terapia trombolitica. È indispensabile, però, che il trattamento non sia controindicato, vale a dire che il paziente non appartenga a quella categoria a rischio emorragico elevato, come in caso di pregresso ictus emorragico o altre situazioni. Per i pazienti che si presentano da meno di due ore dall’insorgenza del dolore, il tempo dal primo contatto medico alla PCI dovrebbe essere inferiore a 90 minuti. Se ciò non è realizzabile è indicata la terapia trombolitica. Dopo aver somministrato il trombolitico in circa 60-90 minuti la sintomatologia dolorosa deve ridursi sino quasi a scomparire e il sopraslivellamento del tratto ST deve ridursi di almeno la metà, altrimenti significa che la terapia trombolitica è stata inefficace e diventa necessario effettuare nelle 24 ore successive una angioplastica di salvataggio (PCI Rescue). Il trombolitico più comunemente utilizzato è il Tenecteplase, che viene somministrato in base al peso corporeo; è facile da usare in quanto nella siringa è indicato il peso del paziente a cui corrispondono i mg di farmaco da somministrare. Si va da un IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 minimo di 30 mg per peso inferiore ai 60 Kg ad un massimo di 50 mg per pazienti che pesano 90 Kg o più. 28) A proposito di ipotermia terapeutica dopo ROSC. Sulla base delle evidenze scientifiche attualmente disponibili, l’ipotermia terapeutica è consigliata per tutti i pazienti che, dopo essere stati rianimati da un arresto cardiaco, rimangano in coma, indipendentemente dal ritmo ECG di presentazione. Il Comitato Scientifico di IRC, in accordo con il Consiglio Direttivo, ha pubblicato sul sito IRC nel dicembre 2013 alcuni aggiornamenti e indicazioni sulla gestione della temperatura in ambito pre e intraospedaliero, dopo revisione della letteratura sull’argomento: 1. La gestione della temperatura rimane un obiettivo importante nell’ambito di un protocollo standardizzato del trattamento post-rianimazione. 2. L’infusione di cristalloidi freddi (2 l a 4°C in sacca a pressione) come metodo di induzione dell’ipotermia preospedaliera post-ROSC non venga effettuata, in quanto di utilità non dimostrata e potenzialmente gravata da effetti collaterali. 3. I singoli centri sono liberi di scegliere se mantenere i pazienti a 33° C o 36°C per 24 ore dal raggiungimento della temperatura target; protocolli di trattamento post-rianimazione già in uso possono essere mantenuti inalterati in attesa della pubblicazione di nuove Linee Guida o di interim statements dell’ILCOR. 4. La gestione della temperatura in pazienti che rimangano privi di coscienza dopo il graduale riscaldamento deve proseguire avendo come obiettivo la normotermia (37°C di temperatura centrale) almeno per 72 ore dopo il ROSC ed evitando rigorosamente l’ipertermia. 29) In caso di bradicardia sintomatica se non si raggiungono gli effetti desiderati dopo la somministrazione di 3 mg di atropina si può continuare la somministrazione di altri boli da 0,5 mg? L’atropina antagonizza l’azione dell’acetilcolina a livello dei recettori muscarinici. Blocca, pertanto, l’effetto del nervo vago sia a livello del nodo seno-atriale (SA) sia del nodo atrioventricolare (AV), aumentando l’automaticità del nodo del seno e facilitando la conduzione AV. Dal momento che la dose di 3 mg serve per bloccare tutti i recettori muscarinici, non trova indicazione l’ulteriore somministrazione di atropina dopo aver raggiunto la dose massima. Si possono prendere in considerazione farmaci cosiddetti alternativi. 30) In caso di bradicardia sintomatica in attesa di posizionamento del pacing è indicata la somministrazione di atropina? In presenza di bradicardia sintomatica il pacing transvenoso rappresenta l’opzione terapeutica principale; in attesa del posizionamento del pacing stesso le opzioni terapeutiche prevedono la somministrazione di atropina di 0.5 mg (ripetibile fino ad un massimo di 3 mg), l’uso di farmaci alternativi quali isoprenalina o adrenalina ed il posizionamento temporaneo di pacing transtoracico. IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 8 di 18 31) Se il paziente che presenta una bradicardia è stato sottoposto a trapianto cardiaco è indicata la somministrazione di atropina? Il cuore trapiantato non presenta innervazione vagale e non risponde pertanto all’atropina, che peraltro può determinare in questi casi BAV di grado elevato, come anche arresto sinusale; i farmaci che trovano indicazione nei pazienti con bradicardia sintomatica dopo un trapianto cardiaco sono i così detti farmaci alternativi quali l’adrenalina, l’isoprenalina, la dopamina, la teofillina ed il glucagone. 32) Se dopo somministrazione di atropina non si ha una risposta soddisfacente si possono utilizzare farmaci alternativi? In alcune situazioni cliniche può essere appropriato l’uso di farmaci di seconda linea; considerare ad esempio il glucagone per via endovenosa in caso di intossicazione da betabloccanti o calcio-antagonisti; considerare l’utilizzo di frammenti anticorpali specifici per la digossina in caso di intossicazione da digitale. Considerare anche l’uso di teofillina, se la bradicardia insorge come complicanza di un IMA inferiore, di un trauma midollare o di un trapianto cardiaco. Altri farmaci di seconda linea sono l’isoprenalina, l’adrenalina e la dopamina. La dose di glucagone da somministrare è di 50-150 μg/Kg per via endovenosa in media dai 3 ai 10 mg (3-10 fl), l’isoprenalina si somministra al dosaggio iniziale di 5 μg/min, la teofillina 100-200 mg in infusione lenta, l’adrenalina alla dose di 2-10 μg/min e la dopamina alla dose di 2.5-10 μg/Kg/min. 33) Se dopo aver posizionato il pacing il paziente lamenta dolore per la contrazione muscolare, quali farmaci si possono utilizzare per la sedazione? I pazienti coscienti solitamente avvertono un notevole fastidio durante la stimolazione transcutanea soprattutto se questa dura molto tempo e viene impiegata ad un’energia elevata. In tali condizioni sarebbe opportuna la somministrazione di analgesici e sedativi, quali il midazolam, che è più indicato rispetto al propofol, in quanto presenta una ridotta azione sull’apparato cardiocircolatorio. La somministrazione di midazolam viene fatta alla dose di 0.1-0.3 mg/Kg effettuata con boli piccoli, sino al raggiungimento dell’effetto desiderato. 34) Quali sono i segni che fanno capire che il pacing transcutaneo sta funzionando? Dopo aver selezionato una frequenza di stimolazione adeguata, che di solito corrisponde a 60-90/battiti al minuto, bisogna selezionare il livello minimo di energia ed iniziare la stimolazione; si prosegue poi incrementando progressivamente il livello di energia tenendo sotto controllo il paziente e il tracciato ECG. Sul tracciato comparirà un artefatto di stimolazione: lo “spike”. Bisogna aumentare ulteriormente l’energia fino a quando ogni “spike” sarà seguito da un complesso QRS, espressione di cattura elettrica. I segni elettrocardiografici che indicano l’efficacia del pacing sono: la presenza dello “spike”, del complesso QRS e dell’onda T di ripolarizzazione. Dal punto di vista clinico il segno che indica un buon funzionamento del pacing è rappresentato dalla presenza del polso palpabile che conferma la presenza di “cattura meccanica”. Una buona “cattura elettrica” senza “cattura meccanica” configura una condizione di PEA e la causa più probabile di ciò è un grave danno del miocardio. Con un’adeguata cattura meccanica ci si aspetta un IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 9 di 18 miglioramento della perfusione e delle condizioni cliniche del paziente che vanno rivalutate secondo lo schema ABCDE. 35) In caso di rischio di asistolia è preferibile posizionare direttamente il pacing o tentare prima con la somministrazione di atropina? Il rischio di asistolia esiste in caso di asistolia recente, di BAV di II grado Mobitz 2, di BAV di III grado, oppure in presenza di pause ventricolari maggiori di 3 secondi. In queste circostanze è indicato il posizionamento del pacing transvenoso, che può essere preceduto (soprattutto per questioni di tempi organizzativi) dalla somministrazione di un bolo di 0.5 mg di atropina eventualmente ripetibile, sino ad una dose massima di 3 mg, dall’uso di farmaci di seconda linea (isoprenalina, adrenalina, dopamina, teofillina e glucagone), oppure dall’uso di pacing transtoracico. 36) Quando è indicata la cardioversione sincronizzata in caso di TV con polso? La TV è un’aritmia particolarmente temibile e grave che, se non trattata prontamente, può evolvere in ARRESTO CARDIO-CIRCOLATORIO. Le opzioni terapeutiche dipendono dalle condizioni cliniche del paziente. Per frequenze cardiache elevate, in genere superiori a 150/min, si possono creare situazioni emodinamiche sfavorevoli dovute al ridotto riempimento ventricolare diastolico che, a sua volta, comporta una riduzione della gittata sistolica; in conseguenza di ciò compaiono i segni e i sintomi di instabilità emodinamica del paziente. L’ipoperfusione cerebrale è all’origine dell’obnubilamento del sensorio e/o della sincope; il paziente può presentare dispnea a causa dell’ipoperfusione sistemica, così come dolore toracico secondario all’ipoperfusione coronarica; la riduzione della gittata sistolica è alla base dell’ipotensione. Se sono presenti questi sintomi, anche solo in parte, il paziente si può considerare instabile dal punto di vista emodinamico e, pertanto, il trattamento più indicato della tachicardia ventricolare è rappresentato dalla cardioversione elettrica sincronizzata che richiede meno tempo di quella farmacologica e garantisce una maggiore efficacia con minori effetti collaterali. Bisogna ricordare che si tratta di pazienti coscienti, pertanto è indispensabile prima di tutto provvedere ad un’efficace sedazione ed eventuale analgesia; il farmaco più indicato per la sedazione è il midazolam alla dose di 0.1-0.3 mg/Kg in bolo. È sconsigliato l’uso del propofol in quanto determina una marcata vasodilatazione periferica con conseguente riduzione della pressione arteriosa e peggioramento della perfusione. 37) Esistono delle situazioni in cui si possono effettuare tre defibrillazioni consecutive per una FV/TV senza polso senza fare i 2 minuti di RCP tra una scarica e l’altra? Se il paziente ha un ARRESTO CARDIO-CIRCOLATORIO testimoniato e monitorizzato in sala di emodinamica o subito dopo un intervento di cardiochirurgia, si deve confermare l’arresto cardiaco e, se il ritmo è una FV o una TV senza polso, si possono erogare sino a tre shock consecutivi. Dopo l’erogazione della tripletta di shock si deve procedere con le compressioni toraciche esterne per due minuti. Nell’ambito dell’algoritmo ALS questi tre shock sono conteggiati come primo shock. Si può prendere in considerazione questa strategia a tre shock consecutivi anche per un ARRESTO CARDIO-CIRCOLATORIO in FV/TV senza polso monitorizzato e testimoniato, se il paziente è già connesso ad un defibrillatore. Questa circostanza però è rara. Non ci sono dati a sostegno di questa strategia a tre shock in nessuna di queste circostanze, ma è improbabile che le IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 10 di 18 compressioni toraciche esterne migliorino la possibilità già molto elevata di ROSC quando la defibrillazione venga effettuata all’inizio della fase elettrica, subito dopo la comparsa dell’FV. 38) In ambiente extraospedaliero quali sono le manovre vagali consigliate? Le manovre vagali sono indicate nelle tachicardie a complessi stretti regolari, vale a dire in caso di QRS la cui durata è inferiore ai 0,12 sec. (meno di tre quadratini piccoli all’ECG). Le manovre vagali utili sono la manovra di Valsalva e il massaggio del seno carotideo. Quest’ultima manovra è riservata soprattutto all’ambiente intraospedaliero, in quanto, dopo tale manovra, sono stati osservati casi di ictus secondari alla mobilizzazione di placche ateromasiche. Per tale motivo in ambiente extraospedaliero è indicata l’esecuzione della manovra di Valsalva, che consiste nel far effettuare al paziente un’espirazione forzata a glottide chiusa. Nella pratica clinica è utile far eseguire questa manovra invitando il paziente a soffiare energicamente in una siringa da almeno 20 ml dal beccuccio, dal quale è stato rimosso l’ago, nel tentativo di spostare lo stantuffo. Il paziente effettuerà così la manovra di Valsalva. 39) Che grado di attendibilità può avere un paziente che riferisce che la FA è insorta al momento se non possiede un ECG precedente? La FA è senza dubbio una delle aritmie più frequenti. Capita talvolta che il paziente riferisca di una recentissima insorgenza dell’aritmia stessa senza però alcuna documentazione ECGgrafica che possa datarla con assoluta sicurezza. Questo può comportare delle difficoltà nelle scelte terapeutiche in quanto, come accade spesso in soggetti anziani o comunque poco attenti, il sintomo “fastidio” può comparire quando vi è un aumento della frequenza ventricolare media, pur essendo la FA presente da tempo senza essere avvertita dal paziente stesso. Bisognerebbe, pertanto, fare riferimento a ECG recenti per tentare di collocare la FA in un periodo di tempo certo rispetto alle 48 ore precedenti. 40) La FA deve sempre essere trattata? Il trattamento della FA dipende dalle condizioni cliniche del paziente. Se il paziente ha segni di allarme ed è a rischio di deterioramento a causa della tachiaritmia, è indicato il trattamento nel più breve tempo possibile indipendentemente dal tempo di insorgenza dell’aritmia stessa; in tutti gli altri casi l’esperto valuterà il trattamento più indicato che potrà essere rinviato nel tempo dopo un periodo adeguato di terapia anticoagulante. 41) Quali sono le strategie terapeutiche in caso di FA? Il trattamento della FA dipende principalmente dalle condizioni cliniche del paziente. Se il paziente è emodinamicamente instabile a causa dell’aritmia, è indicata la cardioversione elettrica sincronizzata, preceduta da sedazione; si prevede in questi casi anche la somministrazione di un bolo di eparina sodica non frazionata di 5.000 U.I. o meglio di 60-70 U/Kg di peso corporeo oppure di eparina a basso peso molecolare. Se non ci sono segni di allarme che obblighino alla cardioversione elettrica sincronizzata in urgenza, le opzioni terapeutiche sono: IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 11 di 18 • Controllo della sola frequenza cardiaca • Controllo del ritmo mediante cardioversione farmacologica • Controllo del ritmo mediante cardioversione elettrica Se la FA non è facilmente databile o se è presente da più di 48 ore, è indicato il solo controllo della frequenza cardiaca con farmaci quali i beta-bloccanti (metoprololo), i calcioantagonisti (verapamil e diltiazem) o digossina. Il controllo del ritmo con la cardioversione farmacologica e/o elettrica si farà solo dopo aver “scoagulato” il paziente, avendo cioè praticato, per almeno tre settimane, una terapia anticoagulante efficace (documentazione di INR in range terapeutico). L’uso dell’amiodarone è indicato solo se la FA è insorta da meno di 48 ore in quanto, in una percentuale non trascurabile di casi, l’amiodarone cardioverte farmacologicamente l’FA in RS; la digitale è indicata soprattutto nei pazienti con insufficienza cardiaca. Per quanto riguarda i beta-bloccanti, il farmaco più frequentemente utilizzato è il metoprololo alla dose di 2-5 mg e.v., ripetibile ogni 5 minuti sino al raggiungimento della dose massima di 15 mg. Tra i calcio-antagonisti i farmaci consigliati sono il verapamil, alla dose di 2.5-5 mg in due minuti con eventuali dosi ripetute di 5-10 mg ogni 15-30 minuti sino ad una dose massima di 20 mg e il diltiazem, alla dose di 0,25 mg/kg, seguita da una seconda dose di 0,35 mg/kg. La digossina si somministra alla dose di 0.5 mg per via endovenosa in 3-5 minuti; la digitalizzazione rapida prevede una dose totale di 1-1.5 mg; metà dose (0.5 mg) vengono somministrati al tempo zero, poi ¼ della dose totale dopo 4-6 ore e ¼ dopo altre 4-6 ore. 42) Un complesso ventricolare (QRS) >0,12 sec è sempre di origine ventricolare? Il complesso QRS corrisponde alla depolarizzazione dei ventricoli. In condizioni di integrità del sistema di conduzione dell’impulso elettrico, la durata del complesso ventricolare è al massimo di 0,12 sec, che all’ECG corrisponde a tre quadratini piccoli. La presenza di un complesso QRS di tale durata ci fa stabilire che l’origine dell’impulso è certamente sopraventricolare. Quando una delle due branche delle vie di conduzione (destra o sinistra) è mal funzionante, la conduzione rapida al ventricolo si interrompe. L’impulso di depolarizzazione viaggia velocemente verso il ventricolo non interessato dal blocco, mentre raggiunge l’altro ventricolo più lentamente attraverso le fibre di Purkinjie ed il miocardio comune. Questa situazione è chiamata blocco di branca e la depolarizzazione dei ventricoli richiede più tempo del normale; ciò si evidenzia all’ECG con un complesso QRS largo della durata superiore a 0,12 sec. In questo caso l’origine dell’impulso è sopraventricolare, ma con un’aberranza di conduzione. Il complesso QRS largo, pertanto, non è sempre indicativo di origine ventricolare. IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 12 di 18 43) In caso di TV con polso cosa si deve fare se dopo i tre shock non avviene la cardioversione? Dopo aver valutato il paziente secondo il metodo ABCDE, se è presente una TV emodinamicamente instabile, è indicata la cardioversione elettrica sincronizzata da effettuare nel più breve tempo possibile non dimenticando la sedazione del paziente, ad esempio con midazolam alla dose di 0.1-0.3 mg/Kg di peso corporeo. L’energia consigliata per la cardioversione sincronizzata dipende fondamentalmente dal tipo di defibrillatore utilizzato. In genere la prima scarica consigliata per una TV o una FA è di 120-150 J se si tratta di un defibrillatore bifasico, mentre è di 200 J con un defibrillatore monofasico; se dopo aver erogato il primo shock non si riesce ad interrompere la TV si effettua un secondo shock utilizzando una energia di livello intermedio tra quella iniziale e, se inefficace, una terza ed ultima scarica, che deve essere erogata alla massima energia permessa dal defibrillatore. Dopo il terzo shock si somministrano 300 mg di amiodarone in 10-20 minuti ed eventualmente, se ancora la TV non è stata interrotta, si può procedere con un altro shock all’energia massima erogabile dal defibrillatore, seguito da infusione di 900 mg di amiodarone nell’arco delle 24 ore. Va sottolineata l’importanza di controllare la presenza di polso dopo ogni scarica per rilevare l’eventuale comparsa di arresto cardiaco 44) Se mi trovo di fronte ad una Tachicardia a complessi larghi irregolare come mi devo comportare? In presenza di tachicardia a complessi larghi irregolare, il trattamento consigliato dipende sempre dalle condizioni cliniche del paziente; se è emodinamicamente instabile è indicata la cardioversione elettrica sincronizzata; diversa è la situazione in cui il paziente sia emodinamicamente stabile. La diagnosi più probabile è che si tratti di una FA con blocco di branca e l’esecuzione di un ECG a 12 derivazioni potrebbe aiutarci nella diagnosi. Se la diagnosi fosse confermata, il trattamento sarà quello previsto per la FA. Altra situazione potrebbe essere una FA con pre-eccitazione ventricolare in paziente con WPW: in tal caso è indicata la somministrazione di amiodarone. Infine potrebbe trattarsi, anche se difficilmente in assenza di segni di allarme, di una TV polimorfa, come una torsione delle punte in cui è indicata la somministrazione di 2 gr di solfato di magnesio in 10 minuti. 45) In caso di arresto cardio-circolatorio testimoniato l’algoritmo cambia rispetto alle situazioni in cui l’arresto cardiocircolatorio non è testimoniato? Se il paziente dovesse andare incontro a un arresto cardio-circolatorio testimoniato, l’algoritmo di trattamento non cambia rispetto al caso di arresto cardio-circolatorio non testimoniato; dopo aver confermato l’arresto cardio-circolatorio si inizieranno immediatamente le compressioni toraciche esterne e le ventilazioni sino a quando non sarà disponibile un defibrillatore per l’analisi del ritmo. In caso si abbia a disposizione un defibrillatore manuale, lo si potrà utilizzare per effettuare un “Quick Look”, interrompendo le manovre rianimatorie per un periodo massimo di 5 secondi; se invece si dispone di un DAE si provvederà all’applicazione delle piastre adesive e solo dopo si interromperanno le compressioni toraciche esterne per consentire al defibrillatore di analizzare il ritmo. IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 13 di 18 46) In caso di anafilassi qual è il trattamento farmacologico più indicato? L’anafilassi è una reazione di ipersensibilità generalizzata o sistemica grave e potenzialmente mortale. L’anafilassi è caratterizzata dallo sviluppo molto rapido di ostruzione delle vie aeree e di problemi respiratori e circolatori solitamente associati ad alterazione della cute e delle mucose. La maggior parte delle reazioni si sviluppa nel giro di alcuni minuti. Raramente può verificarsi un esordio più lento. Poiché si tratta di un quadro rapidamente evolutivo, è assolutamente indispensabile instaurare una terapia aggressiva nel più breve tempo possibile. Il farmaco più importante per il trattamento della reazione anafilattica è l’adrenalina, somministrata per via intramuscolare alla dose di 0.5 mg, eventualmente ripetibile dopo 5 minuti in assenza di scomparsa dei sintomi; il sito migliore per l’iniezione intramuscolare è la parte antero-laterale della coscia con un ago sufficientemente lungo per garantire che l’adrenalina venga iniettata nel muscolo. La somministrazione per via endovenosa è sconsigliata, in quanto può causare ipertensione arteriosa pericolosa per la vita, tachicardia, aritmie ed ischemia miocardica e comunque non deve essere mai usata alla concentrazione di 1:1000. Raramente e con particolare cautela si possono usare piccoli boli di adrenalina diluita 1:10.000. Per ottenere ciò si utilizza una fiala di adrenalina 1:1000 e si porta in siringa a 10 ml con soluzione fisiologica, ottenendo così una concentrazione di 100 μg/ml; la dose da somministrare è di 50 μg, cioè 0.5 ml per volta. Oltre all’adrenalina, farmaco principale nel trattamento dello shock anafilattico, altri farmaci che si devono somministrare sono: ossigeno ad alti flussi e un bolo endovenoso rapido di 1000 ml di cristalloidi, da preferire ai colloidi, in quanto questi ultimi possono essere allergizzanti. È indicata inoltre la somministrazione di 200 mg di idrocortisone e.v. per ridurre o evitare la reazione prolungata, così come la somministrazione di 10 mg di clorfenamina per via endovenosa lenta. 47) Quando si usa il glucagone nell’anafilassi? In caso di anafilassi per i pazienti insensibili all’adrenalina, specialmente quelli trattati con beta-bloccanti, è indicata la somministrazione di glucagone alla dose di 1-2 mg per via endovenosa, che si può ripetere ogni 5 minuti, sino alla risoluzione dell’ipotensione. 48) In caso di arresto cardiocircolatorio per anafilassi si possono somministrare anche cortisonici e antistaminici? L’anafilassi può evolvere in arresto cardio-circolatorio soprattutto se il paziente non è stato adeguatamente trattato; in caso di arresto cardio-circolatorio, oltre al protocollo standard ALS, è indicata la somministrazione di 200 mg di idrocortisone e di 10 mg di clorfenamina, in associazione a ampi volumi di fluidi. Può essere necessaria una rianimazione prolungata. 49) In caso di iperkaliemia certa o fortemente sospetta (pazienti dializzati) è consentita la somministrazione di bicarbonato di sodio? L’iperpotassiemia solitamente è causata da un’aumentata liberazione di K dalle cellule o da una ridotta eliminazione del K da parte dei reni. Questa condizione viene definita da una potassiemia superiore a 5.5 mmol/L. Man mano che la kaliemia aumenta, aumenta anche il rischio di eventi avversi e quindi la necessità di trattamento urgente. L’iperpotassiemia grave è stata definita come una potassiemia superiore a 6.5 mmol/L. La somministrazione IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 14 di 18 di bicarbonato di sodio è indicata solo per condizioni di iperkaliemia grave, vale a dire quando la kaliemia è superiore a 6.5 mmol/L. Questo parametro diventa difficile da valutare in ambiente extraospedaliero quando non è disponibile il valore di kaliemia: la somministrazione di bicarbonato è comunque consigliata in caso di situazioni fortemente sospette (e.g, paziente con IRC). Pagina | 15 di 18 La dose di bicarbonato da somministrare è 50 mmol di bicarbonato di sodio, cioè 84 ml di bicarbonato al 5% o 50 ml di bicarbonato all’8.4%. 50) Come si costituisce una soluzione contenente 50 g di glucosio? 50 g di glucosio sono contenuti in una soluzione di 500 ml di glucosata al 10% o in 250 ml di soluzione glucosata al 20%. 51) In caso di arresto cardiocircolatorio per iperkaliemia quali sono i farmaci specifici che si utilizzano oltre quelli previsti per l’arresto? L’iperkaliemia grave e persistente, se non trattata, può portare ad arresto cardiocircolatorio; anche in questo caso, dopo aver confermato l’arresto cardio-circolatorio, bisogna procedere con la rianimazione cardiopolmonare secondo l’algoritmo ALS. In aggiunta a ciò bisogna prevedere una strategia terapeutica che consenta da una parte di favorire l’eliminazione del potassio e lo spostamento del potassio stesso all’interno delle cellule e dall’altra di proteggere il cuore dall’azione tossica e lesiva che il potassio stesso può provocare. Per proteggere il cuore occorre somministrare calcio cloruro al 10%, 10 ml in bolo endovenoso. Al fine di spostare il potassio all’interno delle cellule è utile infondere per via endovenosa rapida una soluzione costituita da 10 UI di insulina e 50 gr di glucosio; è altresì indicata la somministrazione di bicarbonato di sodio 50 mmol per via endovenosa rapida. Inoltre, si può prendere in considerazione la somministrazione durante la ventilazione di salbutamolo (6-8 puff) attraverso l’Ambu. 52) Cos’è il P/F, come si determina e quale utilità ha? Il P/F è il valore ottenuto mettendo in rapporto la pressione parziale di O2 nel sangue arterioso (al numeratore), con la frazione inspiratoria di O2 (al denominatore). Per la corretta determinazione la PaO2 deve essere espressa in mm di Hg e la frazione inspiratoria di O2 come numero puro (ad esempio 0,21 per l’aria ambiente). Tale parametro è fondamentale per valutare la capacità di scambio di O2 del parenchima polmonare, in quanto rapporta la PaO2 misurata alla quantità di O2 somministrato nel gas inspirato. Il valore normale è >450 mmHg, anche se valori >300 vengono ritenuti accettabili. Valori <200 rappresentano un’importante compromissione della diffusione di O2 attraverso la membrana alveolo-capillare. Di fronte ad un valore assoluto di PaO2 normale, ad esempio 96 mmHg, ben diversa è la situazione se tale valore è ottenuto in aria ambiente (FiO2 0,21P/F 457 mmHg), con O2 al 50% (FiO2 0,5-P/F 192 mmHg) o al 70% (FiO2 0,7-P/F 137 mmHg); negli ultimi due casi il parenchima polmonare ha una capacità di scambio dell’O2 molto ridotta: situazione tipica, ad esempio, dell’ispessimento diffuso della membrana alveolo-capillare, come si verifica nell’edema polmonare cardiogeno e non cardiogeno, nelle interstiziopatie diffuse o nella polmonite grave. Il rapporto P/F rappresenta dunque un utile complemento nella valutazione dell’ossigenazione al momento della lettura dell’EGA, IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 in quanto consente di evidenziare un deficit di scambio del parenchima polmonare anche di fronte a valori assoluti di PaO2 normali. 53) Quando sospettare un disordine misto dell’equilibrio acido-base? Un disordine misto dell’equilibrio acido-base si verifica quando sono simultaneamente presenti due o più disturbi semplici. Dovrebbe essere sospettato quando: • pH normale in presenza di PaCO2 e/o HCO3- anormali (presenza di due disturbi che vanno in senso opposto) • Disturbo apparentemente semplice in cui non sia rispettata la regola del compenso; tale regola prevede che all’instaurarsi di un disturbo dell’equilibrio acido-base l’organismo metta in atto dei meccanismi di compenso (respiratori nei disturbi metabolici e renali nei disturbi respiratori), la cui entità è prevedibile e dovrebbe rispettare i seguenti valori: Disturbo primario Compenso atteso Acidosi respiratoria acuta 10 CO2 1 HCO3- Acidosi respiratoria cronica 10 CO2 3,5 HCO3- Alcalosi respiratoria acuta 10 CO2 2 HCO3- Alcalosi respiratoria cronica 10 CO2 4 HCO3- Acidosi metabolica 1 HCO3- 1,2 CO2 Alcalosi metabolica 1 HCO3- 0,5 CO2 • pH estremamente acido o alcalino, per mancanza di compenso o per presenza di due disturbi dello stesso segno, ad esempio acidosi metabolica e respiratoria presenti simultaneamente. 54) Cos’è il Gap Anionico, come si determina e quale utilizzo può avere? L’organismo umano rispetta il principio dell’elettroneutralità dei liquidi corporei, secondo cui il numero delle cariche elettriche positive deve essere uguale a quello delle cariche negative. Tuttavia, non tutte le molecole cariche elettricamente possono essere dosate e quantificate. Pertanto la differenza tra le cariche positive e negative non è nulla, ma risulta positiva, per l’incapacità di misurare alcune molecole dotate di carica negativa. A tale valore si dà il nome di “gap anionico”. Il gap anionico viene calcolato come segue: (Na+ +K+)-(Cl-+HCO3-). Di solito, per semplicità di calcolo, il potassio viene trascurato, quindi la formula diventa: Na +-(Cl-+HCO3-). Il suo valore normale è di 10 +/- 2. L’utilità di tale parametro risiede nel fatto che fornisce al clinico un orientamento diagnostico sull’eziologia dell’acidosi metabolica. Infatti, le acidosi metaboliche vengono distinte in acidosi a gap anionico aumentato e in acidosi a gap anionico normale. Le prime sono quelle in cui vengono prodotti degli anioni non compresi nel calcolo del gap anionico; come risposta, per mantenere l’elettroneutralità, la concentrazione di Cl- diminuisce in quanto l’eccesso di cariche negative è rappresentato da anioni non misurati, come succede in caso di chetoacidosi, acidosi lattica e acidosi associata ad insufficienza renale. Le acidosi metaboliche a gap anionico normale sono invece ipercloremiche, in questi casi il calcolo del gap anionico mostra valori non alterati, come nel caso di acidosi da diarrea profusa o nelle acidosi tubulari renali. IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 16 di 18 55) Quale farmaco vasoattivo è più utile nell’immediata fase post-ROSC? L’immediata fase post-arresto si caratterizza in genere per una grande instabilità emodinamica e non sono improbabili nuovi deterioramenti che, se non riconosciuti e trattati in tempo, possono evolvere verso un nuovo episodio di arresto cardio-circolatorio. Per tale ragione è fondamentale un’immediata rivalutazione dei parametri emodinamici e sin da subito una loro ottimizzazione. Il carico di fluidi è spesso il primo strumento a disposizione in questa fase, in cui non sono di solito disponibili strumenti di monitoraggio più approfondito. Talvolta anche l’ottimizzazione del riempimento delle camere cardiache non è sufficiente, o può non essere indicato; può essere quindi necessario il ricorso a farmaci vasoattivi. L’approccio ottimale all’uso dei farmaci inotropi e/o vasoattivi prevede l’utilizzo di strumenti di valutazione più o meno invasivi del riempimento delle camere cardiache, della performance miocardica, nonché delle resistenze vascolari. Purtroppo, tali strumenti sono solo raramente disponibili nell’immediato post-arresto, appartenendo a un impiego per lo più intensivistico. Si deve pertanto agire spesso in loro assenza. Farmaci come la noradrenalina, l’adrenalina, la dobutamina o altri inotropi andrebbero inoltre somministrati preferibilmente attraverso un accesso venoso centrale, la cui disponibilità è molto infrequente in un contesto di arresto cardiaco. Per tali ragioni, la dopamina rappresenta il farmaco più versatile e facilmente utilizzabile nell’immediata fase post-arresto. Il suo utilizzo è possibile attraverso accesso venoso periferico, benché anche con la dopamina siano possibili danni ischemici tessutali in caso di stravaso. Il dosaggio può essere modulato in modo da sfruttare l’effetto prevalente β1 (5-10 μg/Kg/min) o anche vasocostrittore α1 (>10 μg/Kg/min). Il dosaggio dovrà essere titolato in base all’effetto desiderato e a quello ottenuto, oltre che in considerazione dell’insorgenza di eventuali effetti avversi; non bisogna infatti dimenticare che la dopamina determina un aumento di consumo miocardico di O2 ed è aritmogena. Ai fini pratici, per la somministrazione attraverso un accesso venoso periferico è preferibile usare una soluzione contenente 200 mg di dopamina in 250 ml di fisiologica o glucosata al 5%, più diluita di quella solitamente somministrata attraverso un accesso venoso centrale. 56) Quali strumenti possono essere usati per indurre e mantenere l’ipotermia terapeutica? Esistono differenti modalità per indurre e mantenere l’ipotermia terapeutica. Esse differiscono per efficacia e complessità. Schematicamente possono essere suddivise in sistemi ad azione interna e sistemi ad azione esterna. Tra i primi si annoverano: • Sistemi basati su prelievo, raffreddamento e risomministrazione del sangue del paziente; il sangue viene fatto transitare attraverso scambiatori di calore; la forma più complessa di questo sistema consente anche un supporto all’ossigenazione e/o alla circolazione, rappresentando una vera e propria circolazione extracorporea. Grazie allo stretto controllo della temperatura, rilevata solitamente a livello esofageo o tracheale, tali metodiche rappresentano i sistemi più precisi e rapidi per indurre e mantenere l’ipotermia terapeutica. Sono tuttavia costosi e richiedono spesso l’uso di accessi vascolari dedicati di grosso calibro. IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 17 di 18 Tra i sistemi ad azione esterna si ricordano: • • Impacchi freddi nelle zone di superficializzazione dei principali vasi arteriosi, come il collo, ascelle, pieghe inguinali che offrono sicuramente il vantaggio della economicità, possono essere utili nella fase di induzione, ma sono difficilmente gestibili nella fase di mantenimento. Cuscini o corpetti ad acqua fredda, servocontrollati tramite termostato da una macchina dedicata che regola il flusso dei liquidi e a cui viene connessa la sonda di temperatura. IRC Commissione ALS-ILS: Frequently Asked Questions v. 1/2015 Pagina | 18 di 18
Scaricare