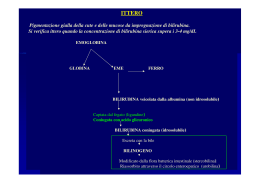
MINUTI 217_Layout 1 11/05/15 11:12 Pagina 5 Valutazione e trattamento dell’iperbilirubinemia neonatale KAREN E. MUCHOWSY Naval Hospital Camp Pendleton Family Medicine Residency Program, Camp Pendleton, California (USA) Mentre l’ittero neonatale è una condizione frequente, l’encefalopatia bilirubinica acuta ed il kernittero (encefalopatia bilirubinica cronica) sono evenienze rare. La necessità di eseguire uno screening universale per l’iperbilirubinemia neonatale rappresenta un argomento controverso. American Academy of Pediatrics consiglia lo screening universale dei livelli di bilirubina, oppure uno screening “selettivo” in base alla presenza di fattori di rischio. Secondo sia U.S. Preventive Services Task Force sia American Academy of Family Physicians, d’altro canto, le evidenze in favore di un miglioramento degli outcome in seguito allo screening sarebbero insufficienti. Lo screening universale determina un aumento dei trattamenti di fototerapia eseguiti, che a volte risultano inappropriati. I fattori di rischio più significativi per lo sviluppo di iperbilirubinemia sono l’età gestazionale alla nascita ed un allattamento esclusivo al seno. I neonati con ittero vanno sottoposti ad una valutazione che preveda la definizione di alcuni punteggi di rischio, oppure la misurazione della bilirubina sierica totale o della bilirubina transcutanea. La fototerapia rappresenta un trattamento efficace dell’iperbilirubinemia, anche se il numero di pazienti da trattare per prevenire un evento varia ampiamente in base a fattori come sesso del neonato, età gestazionale alla nascita, tempo trascorso dal parto. La decisione se procedere o meno alla fototerapia va presa in base all’età gestazionale alla nascita ed ai fattori di rischio. L’exsanguino-trasfusione causa complicanze in circa il 5% dei neonati trattati, e l’intervento è associato ad un tasso di mortalità pari a 3-4 casi ogni 1.000. Sono esposti ad un aumento del rischio di iperbilirubinemia i neonati allattati esclusivamente al seno, ed in particolare quelli con introduzione calorica insufficiente. L’interruzione temporanea dell’allattamento al seno, per procedere al trattamento dell’ittero, comporta tuttavia un rischio di interruzione precoce dell’allattamento al seno. In questi casi è importante, da parte degli operatori sanitari, l’incoraggiamento per promuovere l’allattamento al seno. (Am Fam Physician. 2014; 89 (11): 873-878. Copyright® 2014 American Academy of Family Physicians). L’ ittero neonatale interessa una percentuale pari fino all’84% dei neonati a termine1, e rappresenta la causa più frequente di un nuovo ricovero in ospedale nel periodo neonatale.2 Un’iperbilirubinemia grave (livelli sierici di bilirubina totale superiori a 20 mg/dL [342,1 µmol/L]) si manifesta in meno del 2% dei neonati a termine, e può portare a kernittero (encefalopatia bilirubinica cronica) ed a ritardo permanente dello sviluppo neurologico.2 È pertanto importante sottoporre sistematicamente tutti i neonati ad una valutazione per la ricerca di iperbilirubinemia. Un’encefalopatia bilirubinica acuta si sviluppa in un neonato ogni 10.000, e la condizione si manifesta con ipertonia, ipertonia dei muscoli estensori, retrocollo, opistotono, febbre, pianto acuto. 2 I dati riguardanti la progressione da encefalopatia bilirubinica acuta a kernittero sono limitati; secondo uno studio il 95% dei neonati con encefalopatia bilirubinica acuta presenta una completa risoluzione dei sintomi, e solo il 5% presenta segni di kernittero al momento della dimissione.3 Kernittero si sviluppa in un neonato ogni 100.000, e la condizione si manifesta con paralisi cerebrale atetoide, disfunzione uditiva, displasia dentale, paralisi dello sguardo verso l’alto, disabilità intellettiva di grado variabile. I fattori di rischio per lo sviluppo di una grave iperbilirubinemia comprendono cefaloematomi o facilità nello sviluppo di ecchimosi, prematurità, esclusivo allattamento al seno (in particolare nei casi di insufficiente introduzione calorica, e/o calo ponderale pari a 8-10%), anemia emolitica isoimmune o di altro tipo, fratelli o sorelle con una storia di ittero neonatale.4 In aggiunta all’iperbilirubinemia, i fattori associati allo sviluppo di encefalopatia bilirubinica comprendono prematurità, emolisi, sepsi, basso peso alla nascita. Secondo uno studio meno del 5% dei neonati a termine altrimenti sani con livelli sierici di bilirubina totale superiori a 30 mg/dL (513.1 µmol/L) sviluppa un’encefalopatia bilirubinica acuta o un kernittero.3 Quali sono le attuali indicazioni allo screening dell’iperbilirubinemia? American Academy of Pediatrics consiglia lo screening universale dell’iperbilirubinemia, con la determi5 - aprile 2015 - Minuti MINUTI 217_Layout 1 11/05/15 11:12 Pagina 6 Sistema SORT (Strength of Recommendation Taxonomy, Tassonomia della forza delle evidenze): Indicazioni per la pratica clinica Indicazione clinica Livello di Referenze evidenza bibliografiche C 5 B 3, 26 La fototerapia diminuisce l’incidenza di grave iperbilirubinemia neonatale Nei neonati con iperbilirubinemia grave la fototerapia diminuisce le necessità di ricorrere a exsanguino-trasfusione In un neonato con ittero l’interruzione temporanea dell’allattamento al seno diminuisce le B 28 probabilità complessive di un allattamento al seno efficace A = Evidenza coerente, di buona qualità ed orientata sul paziente; B = evidenza orientata sul paziente, scarsamente coerente o di qualità limitata; C = opinione generale, evidenza orientata sulla malattia, pratica clinica usuale, opinione di esperti, serie di casi clinici. Per informazioni sul sistema SORT di valutazione delle evidenze, si veda al sito http://www.aafp.org/afpsort.xml nazione dei livelli sierici di bilirubina totale o della bilirubina transcutanea, oppure uno screening mirato basato sull’analisi dei fattori di rischio.5 Lo screening universale è in grado di identificare in maniera accurata i neonati con rischio elevato di livelli sierici di bilirubina totale superiori al novantacinquesimo percentile per l’età.6,7 Secondo alcuni studi, nel definire il rischio di iperbilirubinemia la determinazione di alcuni punteggi di rischio sarebbe altrettanto accurata dello screening universale.8,9 Il metodo più efficace per identificare i neonati a rischio di iperbilirubinemia è costituito in realtà dall’associazione tra screening universale e determinazione di punteggi di rischio.1,7 Anche se lo screening è in grado di identificare i neonati con rischio elevato di superare il novantacinquesimo percentile dei livelli sierici di bilirubina totale, sia U.S. Preventive Services Task Force sia American Academy of Family Physicians sostengono la presenza di evidenze insufficienti in favore di un miglioramento degli outcome clinici in seguito allo screening dell’iperbilirubinemia.10,11 Lo screening consente di identificare più precocemente i pazienti che devono essere sottoposti a fototerapia, ma non esistono evidenze che indichino che la fototerapia o le exsanguino trasfusioni diminuiscano in effetti il rischio di encefalopatia bilirubinica.12 Lo screening universale determina, probabilmente in maniera inappropriata, un aumento dei tassi di esecuzione di fototerapia. Uno studio retrospettivo di grosse dimensioni, condotto su neonati ricoverati in ospedale e sottoposti a screening universale con la misurazione dei livelli sierici di bilirubina totale o della bilirubina transcutanea, ha riscontrato tassi di fototerapia più che doppi (9,1% rispetto a 4,2%; P<0,001) rispetto a quelli descritti in centri che non adottavano lo screening universale; inoltre, solo il 56% dei pazienti sottoposti a fototerapia ha 6 - aprile 2015 - Minuti presentato in realtà livelli sierici di bilirubina totale compresi nel range che indica la necessità dell’intervento.15 Lo screening ha peraltro ottenuto una diminuzione dei tassi di nuovi ricoveri per iperbilirubinemia. Come valutare i neonati con ittero? L’ispezione del paziente non rappresenta un metodo accurato per determinare i livelli di bilurubina, e spesso tale metodo non è in grado di identificare un’iperbilirubinemia grave.16 Tutti i neonati con ittero devono essere valutati con la determinazione di un punteggio di rischio o con la misurazione dei livelli sierici di bilirubina totale o di bilirubina transcutanea. I livelli di bilirubina vanno interpretati prendendo in considerazione l’età del paziente (espressa in ore). In base al rischio possono rendersi necessari ulteriori esami. Numerosi studi hanno dimostrato una relazione lineare tra i livelli di bilirubina transcutanea ed i livelli di bilirubina sierica totale, ma solamente in presenza di valori relativamente bassi; in presenza di valori relativamente elevati tale relazione sarebbe molto meno significativa.4 American Academy of Pediatrics consiglia di sottoporre tutti i neonati con ittero che necessitano di una fototerapia ai seguenti esami: gruppo sanguigno, test di Coombs diretto, emocromo completo ed esame di uno striscio di sangue periferico, livelli di bilirubina coniugata e diretta. Uno studio retrospettivo condotto su 282 neonati trattati con fototerapia, e sottoposti agli esami menzionati in precedenza, ha peraltro evidenziato risultati normali nell’88,3% dei casi.18 Tra i neonati con risultati abnormi, il 45% aveva iniziato la fototerapia meno di 48 ore dopo il parto. Tali neonati presentavano livelli sierici elevati di bilirubina totale anche dopo MINUTI 217_Layout 1 11/05/15 11:12 Pagina 7 Tabella 1. Effetti collaterali della fototerapia neonatale A breve termine Diarrea Interferenze con il rapporto madre-neonato Ipermotilità intestinale Instabilità della temperatura corporea A lungo termine Aumento del rischio di asma infantile (rischio relativo = 1,4) Aumento del rischio di diabete mellito di tipo 1 (rischio relativo = 3,79) Informazioni tratte dalle referenze bibliografiche 5, 22, 24-27 l’inizio della fototerapia, mentre tutti i pazienti con risultati normali hanno presentato, una volta iniziata la fototerapia, un’appropriata diminuzione della bilirubina sierica. Questi dati suggeriscono che esami ulteriori sarebbero necessari, in un neonato che soddisfa i criteri per la fototerapia, solo nei casi in cui l’ittero si manifesta nelle prime 48 ore di vita, oppure nei casi in cui il neonato non risponde in maniera appropriata alla fototerapia. Quanto è efficace il trattamento dell’iperbilirubinemia? E quali sono gli effetti collaterali? Fototerapia L’assorbimento della luce a livello della cute converte la bilirubina non coniugata nei foto-prodotti della bilirubina che vengono poi escreti con le feci e con le urine. American Academy of Pediatrics ha pubblicato delle linee-guida riguardanti la decisione di procedere alla fototerapia.5 Nei neonati pretermine o non in buone condizioni di salute la “soglia” per iniziare la fototerapia è più bassa. Dopo l’inizio del trattamento la velocità di discesa dei livelli sierici di bilirubina totale è variabile, ed il range di decremento atteso è compreso tra 6% e 20%.5 Nei neonati a termine senza emolisi, la fototerapia può essere continuata fino a quando i livelli di bilirubina raggiungono 13-14 mg/dL (222,4-239,5 µmol/L). Non è necessario mantenere i neonati in ospedale per controllare l’eventuale comparsa di un’iperbilirubinemia “da rimbalzo”, che rappresenta un’evenienza rara.19,20 Anche se per la fototerapia non esiste un protocollo standard, alcuni principi da seguire prevedono l’utilizzazione di lunghezze d’onda e di irradiazioni adeguate, cercando di massimizzare l’area cutanea esposta. La luce più efficace nel convertire la bilirubina non coniugata è la luce blu-verde, con lunghezze d’onda tra 460 e 490 nm. Questo trattamento viene considerato una fototerapia “intensiva”. Per massimizzare l’area cutanea esposta alla luce i neonati devono essere nudi, con l’eccezione del pannolino. I tipi di sorgenti luminose utilizzate per la fototerapia comprendono la luce convenzionale (alogena o a fluorescenza), diodi emettenti luce (light-emitting diodes, LED) e fibre ottiche. LED e la luce convenzionale sono egualmente efficaci; non esistono infatti differenze tra i due tipi di sorgenti luminose dal punto di vista della durata della fototerapia, della velocità di diminuzione dei livelli di bilirubina totale, dei tassi di insuccessi terapeutici.21 La luce con fibre ottiche standard (utilizzata nelle cosiddette “bili-coperte”) non è altrettanto efficace rispetto alla luce convenzionale, con l’eccezione dei casi di neonati pre-termine.22 Nei neonati a termine la luce con fibre ottiche doppie è altrettanto efficace di una singola sorgente di luce convenzionale. Non sono disponibili studi di confronto tra la fototerapia condotta a livello domiciliare e la fototerapia condotta in ospedale. Secondo alcuni studi la fototerapia otterrebbe una riduzione del 10-17% del rischio assoluto di sviluppare livelli di bilirubina sierica superiori a 20 mg/dL (numero di pazienti da trattare per prevenire un evento: tra 5 e 10)5; la fototerapia sarebbe inoltre efficace all’84% nel prevenire exsanguinotrasfusioni.23 Secondo studi più recenti, d’altro canto, il numero di pazienti da trattare per prevenire un evento può variare in maniera significativa, e dipende dall’età gestazionale alla nascita, dal sesso e dall’età del neonato (in ore).23 Ad esempio, in neonati maschi di età inferiore a 24 ore, nati dopo 35 settimane di gestazione, il numero di pazienti da trattare con fototerapia per prevenire una exsanguino-trasfusione è pari a 14; d’altro canto, in neonati femmine di età superiore a 72 ore, nate dopo 40 settimane di gestazione, il numero di pazienti da trattare per prevenire una exsanguino-trasfusione è di 2.176. La fototerapia presenta effetti collaterali a breve e a lungo termine (Tabella 1).5,22-24-27 L’intervento richiede la separazione fisica tra madre e neonato, l’ottenimento di campioni di sangue, ed in alcuni casi un prolungato ricovero in ospedale. Questi eventi possono essere emotivamente stressanti per il genitore. Diversi studi hanno osservato che i genitori di neonati con ittero significativo presentano maggiori problemi nel rapporto con il neonato, e richiedono un numero maggiore di visite ambulatoriali.28,29 Uno studio di coorte di grosse dimensioni ha descritto, in neonati sottoposti a fototerapia, tassi più 7 - aprile 2015 - Minuti MINUTI 217_Layout 1 11/05/15 11:12 Pagina 9 elevati di visite specialistiche e di visite da parte di medici di base durante i primi 60 giorni di vita (rischio relativo 1,07; intervallo di confidenza al 95% tra 1,05 e 1,10).30 Exsanguino-trasfusione Anche se la fototerapia è efficace nel trattamento dell’iperbilirubinemia, in alcuni casi è indicata una exsanguino-trasfusione. Nella decisione se intraprendere o meno l’exsanguino-trasfusione può essere utilizzato un nomogramma, basato sui livelli di bilirubina sierica totale.5 L’exsanguino-trasfusione è indicata nei neonati con livelli di bilirubinemia compresi nel range indicato nel nomogramma (superiori o uguali a 25 µmg/dL [427,6 mol/L]), con ittero e con segni di encefalopatia bilirubinica acuta.5 Nei neonati a termine i tassi di mortalità entro 6 ore dall’exsanguino-trasfusione sono di 3-4 casi ogni 1.000 pazienti trattati.6 Circa il 6% dei neonati sottoposti a exsanguino-trasfusione presenta complicanze associate al sangue trasfuso, complicanze di tipo cardiorespiratorio, alterazioni metaboliche, o complicanze associate al cateterismo.5 Nei neonati con ittero occorre modificare l’allattamento al seno? I neonati allattati al seno hanno una probabilità 3 volte più elevata di presentare livelli sierici di bilirubina totale superiori a 12 mg/dL (205,3 µmol/L), e 6 volte più elevata di presentare livelli superiori a 15 mg/dL (256,6 µmol/L).31 L’esatto meccanismo responsabile dell’associazione tra ittero ed allattamento al seno non è noto, ma potrebbe comprendere un insufficiente apporto calorico, l’inibizione dell’escrezione epatica della bilirubina, un aumento del riassorbimento intestinale della bilirubina. Uno studio ha messo a confronto neonati che venivano esclusivamente allattati al seno e neonati che ricevevano invece integrazioni con formule, per l’allattamento artificiale, in presenza di un significativo calo ponderale, nonché neonati nutriti esclusivamente con formule.32 I risultati ottenuti suggeriscono che la deprivazione calorica, e non l’allattamento al seno di per sé, aumenta il rischio di iperbilirubinemia. Un aumento della frequenza degli allattamenti al seno diminuisce il rischio di sviluppare un’iperbilirubinemia significativa.5 Nei neonati allattati al seno i segni di un’adeguata introduzione alimentare comprendono i seguenti: presenza di 4-6 pannolini completamente bagnati al giorno; emissione di feci 3-4 volte al giorno al raggiungimento del quarto giorno di vita; transizione all’emissione di feci più solide, color senape, entro il terzo o il quarto giorno di vita.5 Le mamme che allattano al seno bambini con ittero sono esposte ad un aumento del rischio di interruzione precoce della capacità di allattare. Rispetto a quanto descritto in mamme di neonati indenni da ittero, un numero doppio di mamme di neonati con ittero ha interrotto l’allattamento al seno dopo un mese (numero di pazienti per prevenire un evento = 4).28 I neonati il cui allattamento al seno era stato interrotto per procedere al trattamento dell’ittero hanno presentato un rischio più elevato di non essere allattati al seno ad un mese di età (numero di pazienti necessario per prevenire un evento = 4). Nei neonati con ittero una corretta interazione della madre con gli operatori sanitari coinvolti (che devono incoraggiare la madre, ed invitarla a continuare con l’allattamento al seno) rappresenta il più forte fattore predittivo per la continuazione dell’allattamento al seno.33 American Academy of Pediatrics consiglia di promuovere l’allattamento al seno dei neonati con ittero, di valutare l’adeguatezza dell’allattamento, nonché di aumentare la frequenza dell’allattamento fino a 812 volte al giorno.5 Se l’introduzione calorica risulta inadeguata, il calo ponderale è eccessivo, sono presenti segni di disidratazione, l’ittero è grave, occorre prendere in considerazione un’integrazione con formule per l’allattamento artificiale. La fototerapia dovrebbe essere interrotta per l’allattamento al seno, con l’eccezione dei casi in cui i livelli di bilirubina si stanno avvicinando a valori tali da richiedere una exsanguino-trasfusione. Esistono sequele a lungo termine sullo sviluppo nervoso attribuibili all’iperbilirubinemia? Uno studio prospettico caso-controllo, condotto su 146 neonati a termine o quasi a termine, con livelli sierici di bilirubina totale superiori a 25 mg/dL, non ha descritto differenze tra i gruppi per quanto riguarda i punteggi di valutazione delle funzioni cognitive, risultati abnormi all’esame neurologico, diagnosi neurologiche a 2 anni di età.34 Punteggi cognitivi più bassi (diminuzione media del Quoziente Intellettivo = 7) sono stati tuttavia descritti tra i pazienti con titoli anticorpali diretti positivi. Uno studio prospettico di coorte, di grosse dimensioni, condotto su bambini nati alla trentacinquesima settimana di gestazione o successivamente, ha messo a confronto pazienti con valori di bilirubina sierica totale superiori o inferiori a 13,5 mg/dL (230,9 µmol/L).35 Ad una valutazione di follow-up, 9 - aprile 2015 - Minuti MINUTI 217_Layout 1 11/05/15 11:12 Pagina 11 condotta dopo 2 anni, non sono state descritte differenze tra i due gruppi per quanto riguarda i tassi di paralisi cerebrale, sordità, ritardo di sviluppo, alterazioni visive. La coorte di pazienti con livelli di bilirubinemia superiori a 19 mg/dL (325,0 µmol/L) ha presentato un aumento del rischio del disturbo da deficit di attenzione (rischio relativo = 1,9; intervallo di confidenza al 95% tra 1,1 e 3,3). Quattro studi di elevata qualità, con un follow-up compreso tra 6,5 e 17 anni, non hanno descritto una relazione tra iperbilirubinemia e diminuzione dei punteggi del Quoziente Intellettivo.5 Fonti dei dati: È stata condotta una ricerca bibliografica sui database Ovid Medline, Cochrane Database of Systematic Reviews, Essential Evidence Plus, U.S. Preventive Services Task Force, Canadian Task Force on Preventive Health Care, utilizzando le parole chiave neonatal hyperbilirubinemia, neonatal jaundice, maternal experience, breastfeeding and jaundice. Date di esecuzione delle ricerche: tra gennaio 2012 e febbraio 2014. Gli autori ringraziano Larry Moore, bibliotecario presso il Naval Hospital Camp Pendleton, California, per l’aiuto fornito nella ricerca. Le opinioni espresse nell’articolo sono dell’autore, e non riflettono necessariamente la posizione ufficiale di Department of the Navy, Department of Defense, o in generale del Governo degli Stati Uniti. L’autore La Dr.ssa Karen E. Muchowski è Faculty Member presso Family Medicine Residency Program, Naval Hospital Camp Pendleton, California (Stati Uniti). Note bibliografiche 1. Bhutani VK, Stark AR, Lazzeroni LC, et al.; Initial Clinical Testing Evaluation and Risk Assessment for Universal Screening for Hyperbilirubinemia Screening Group. Predischarge screening for severe neonatal hyperbilirubinemia identifies infants who need phototherapy. J Pediatr. 2013;162(3):477482. 2. Sgro M, Campbell D, Shah V. Incidence and causes of severe neonatal hyperbilirubinemia in Canada. CMAJ. 2006;175(6):587-590. 3. Gamaleldin R, Iskander I, Seoud I, et al. Risk factors for neurotoxicity in newborns with severe neonatal hyperbilirubinemia. Pediatrics. 2011;128(4):e925-e931. 4. Maisels MJ, Bhutani VK, Bogen D, Newman TB, Stark AR, Watchko JF. Hyperbilirubinemia in the newborn infant > or = 35 weeks’ gestation: an update with clarifications. Pediatrics. 2009;124(4):1193-1198. 5. American Academy of Pediatrics Subcommittee on Hyperbilirubinemia. Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation [published correction appears in Pediatrics. 2004;114(4):1138]. Pediatrics. 2004;114(1):297-316. 6. Ip S, Chung M, Kulig J, et al.; American Academy of Pediatrics Subcommittee on Hyperbilirubinemia. An evidencebased review of important issues concerning neonatal hyperbilirubinemia. Pediatrics. 2004; 114(1):e130-e153. 7. Maisels MJ, Deridder JM, Kring EA, Balasubramaniam M. Routine transcutaneous bilirubin measurements combined with clinical risk factors improve the prediction of subsequent hyperbilirubinemia. J Perinatol. 2009;29(9):612617. 8. Keren R, Luan X, Friedman S, Saddlemire S, Cnaan A, Bhutani VK. A comparison of alternative risk-assessment strategies for predicting significant neonatal hyperbilirubinemia in term and near-term infants. Pediatrics. 2008;121(1):e170e179. 9. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. Identifying newborns at risk of significant hyperbilirubinaemia: a comparison of two recommended approaches. Arch Dis Child. 2005;90(4):415-421. 10. U.S. Preventive Services Task Force. Screening of infants for hyperbilirubinemia to prevent chronic bilirubin encephalopathy: U.S. Preventive Services Task Force recommendation statement. Pediatrics. 2009;124(4):1172-1177. 11. American Academy of Family Physicians. Clinical recommendations: hyperbilirubinemia, infants. http://www.aafp.org/patient-care/clinicalrecommendations/all/hyperbilirubinemia.html. Accessed March 10, 2014. 12. Trikalinos TA, Chung M, Lau J, Ip S. Systematic review of screening for bilirubin encephalopathy in neonates. Pediatrics. 2009;124(4):11621171. 13. Kuzniewicz MW, Escobar GJ, Newman TB. Impact of universal bilirubin screening on severe hyperbilirubinemia and phototherapy use. Pediatrics. 2009;124(4):1031-1039. 14. Petersen JR, Okorodudu AO, Mohammad AA, Fernando A, Shattuck KE. Association of transcutaneous bilirubin testing in hospital with decreased readmission rate for hyperbilirubinemia. Clin Chem. 2005; 51(3):540-544. 15. Suresh GK, Clark RE. Cost-effectiveness of strategies that are intended to prevent kernicterus in newborn infants. Pediatrics. 2004;114(4):917-924. 16. Barrington KJ, Sankaran K; Canadian Paediatric Society; Fetus and Newborn Committee. Guidelines for detection, management and prevention of hyperbilirubinemia in term and late preterm newborn infants. http://www.cps.ca/en/documents/position/hyperbilirubinemia-newborn. Accessed January 20, 2014. 17. Varvarigou A, Fouzas S, Skylogianni E, Mantagou L, Bou11 - aprile 2015 - Minuti MINUTI 217_Layout 1 11/05/15 11:12 Pagina 13 gioukou D, Mantagos S. Transcutaneous bilirubin nomogram for prediction of significant neonatal hyperbilirubinemia. Pediatrics. 2009;124(4):1052-1059. 18. Besser I, Perry ZH, Mesner O, Zmora E, Toker A. Yield of recommended blood tests for neonates requiring phototherapy for hyperbilirubinemia. Isr Med Assoc J. 2010;12(4):220224. 19. Maisels MJ, Kring E. Rebound in serum bilirubin level following intensive phototherapy. Arch Pediatr Adolesc Med. 2002;156(7):669-672. 20. Al-Saedi SA. Rebound hyperbilirubinemia in term infants after phototherapy. Saudi Med J. 2002;23(11):13941397. 21. Kumar P, Chawla D, Deorari A. Light-emitting diode phototherapy for unconjugated hyperbilirubinaemia in neonates. Cochrane Database Syst Rev. 2011;(12):CD007969. 22. Akobeng AK. Neonatal jaundice. Clin Evid Concise. 2004;12:84-85. 23. Newman TB, Kuzniewicz MW, Liljestrand P, Wi S, McCulloch C, Escobar GJ. Numbers needed to treat with phototherapy according to American Academy of Pediatrics guidelines. Pediatrics. 2009;123(5):1352-1359. 24. Aspberg S, Dahlquist G, Kahan T, Källén B. Confirmed association between neonatal phototherapy or neonatal icterus and risk of childhood asthma. Pediatr Allergy Immunol. 2010;21(4 pt 2):e733-e739. 25. Dahlquist G, Kallen B. Indications that phototherapy is a risk factor for insulin-dependent diabetes. Diabetes Care. 2003;26(1):247-248. 26. Matichard E, Le Hénanff A, Sanders A, Leguyadec J, Crickx B, Descamps V. Effect of neonatal phototherapy on melanocytic nevus count in children. Arch Dermatol. 2006;142(12):1599-1604. 27. Bauer J, Bü ttner P, Luther H, Wircker TS, Möhrle M, Garbe C. Blue light phototherapy of neonatal jaundice does not increase the risk for melanocytic nevus development. Arch Dermatol. 2004;140(4):493-494. 28. Kemper K, Forsyth B, McCarthy P. Jaundice, terminating breast-feeding, and the vulnerable child. Pediatrics. 1989;84(5):773-778. 29. Brethauer M, Carey L. Maternal experience with neonatal jaundice. MCN Am J Matern Child Nurs. 2010;35(1):814. 30. Usatin D, Liljestrand P, Kuzniewicz MW, Escobar GJ, Newman TB. Effect of neonatal jaundice and phototherapy on the frequency of first-year outpatient visits. Pediatrics. 2010;125(4):729-734. 31. Gourley GR. Breast-feeding, neonatal jaundice and kernicterus. Semin Neonatol. 2002;7(2):135-141. 32. Bertini G, Dani C, Tronchin M, Rubaltelli FF. Is breastfeeding really favoring early neonatal jaundice? Pediatrics. 2001;107(3):E41. 33. Willis SK, Hannon PR, Scrimshaw SC. The impact of the maternal experience with a jaundiced newborn on the breastfeeding relationship. J Fam Pract. 2002;51(5):465. 34. Newman TB, Liljestrand P, Jeremy RJ, et al.; Jaundice and Infant Feeding Study Team. Outcomes among newborns with total serum bilirubin levels of 25 mg per deciliter or more. N Engl J Med. 2006;354(18):1889-1900. 35. Jangaard KA, Fell DB, Dodds L, Allen AC. Outcomes in a population of healthy term and near-term infants with serum bilirubin levels of > or = 325 micromol/L (> or = 19 mg/dL) who were born in Nova Scotia, Canada, between 1994 and 2000. Pediatrics. 2008;122(1):119-124. 13 - aprile 2015 - Minuti
Scaricare