Cinetica
Prof.Graziano Guella
Dipartimento Fisica UNITN
Argomenti Trattati
Variabili cinetica e costanti specifiche di velocità
Leggi di velocità integrate - casi semplici
Meccanismo di Reazione - Stadi Elementari
Velocità di reazione dal meccanismo di reazione
Fasi determinanti la velocità
̇ Approssimazione dello Stato Stazionario
Teoria di Arrhenius delle Collisioni
̇ fattore A e en. attiv. E
Profilo di reazione
̇ Energia di attivazione e Distribuzione MB
Reazioni Auto catalitiche e cicliche (a catena)
Catalisi Enzimatica
Cinetica Chimica
La termodinamica ci dà informazioni sulle proprietà
all’equilibrio, ma non dice nulla sulla velocità di una
reazione.
La velocità delle reazioni è l’oggetto della cinetica chimica.
Velocità :
υ = f(concentrazioni) = d[c]/dt
La velocità di una reazione dipende dall’entità della
barriera di attivazione ΔGtr.:
Velocità di Reazione
4 In termini matematici la
velocità istantanea è la
derivata - limite del rapporto
incrementale Δ[C]/Δt
dc
v=
dt
aA + bB → cC + dD
x
[C](t)
4 La velocità di reazione è
definita come la variazione
della concentrazione di un
componente la miscela
nell’unità di tempo.
v = lim Δt →0
Δt
t(s)
Δc
Δt
Δ[C]
Velocità di Reazione - Esempio
Zn(s) + 2 HCl(aq) f Zn2+(aq) + 2 Cl-(aq) + H2(g)↑
H2 (ml)
60
40
20
15 ml
20 s
20
40
60
80
120 tempo
100
velocità di reazione = v =
d [H2 ]
dt
variazione della concentrazione nell'unità di tempo
Dipendenza della Velocità di Reazione dalla
Concentrazione
Zn(s) + 2 HCl(aq) f Zn2+(aq) + 2 Cl-(aq) + H2(g)↑
H2 (ml)
2 M HCl (20°C)
80
legge cinetica
60
40
20
v=
30 ml
1 M HCl (20°C)
15 ml
20 s
20 s
20
40
60
80
100
120
tempo
d [H2 ]
dt
= k [ HCl]
[X] = concentrazione
Dipendenza della Velocità di Reazione dalla
Temperatura
Zn(s) + 2 HCl(aq) f Zn2+(aq) + 2 Cl-(aq) + H2(g)↑
H2 (ml)
80
1M HCl (35°C)
60
40
20 s
v=
1M HCl (20°C)
15 ml
20 s
20
40
dt
= f [T]
T = temperatura
23 ml
20
d [H2 ]
60
80
100
120
tempo
Dipendenza della Velocità di Reazione
dall'Area Superficiale
Zn(s) + 2 HCl(aq) f Zn2+(aq) + 2 Cl-(aq) + H2(g)↑
H 2(ml)
80
Zn in 20 pezzi
60
v=
d [H2 ]
dt
= f [ As ]
A = area superficiale
40
20
15 ml
20 s
20 s
20
40
60
8 ml
80
Zn pezzo
unico
100
120
(sistema eterogeneo)
tempo
Dipendenza della Velocità di Reazione da
Catalizzatori o Inibitori
Zn(s) + 2 HCl(aq) f Zn2+(aq) + 2 Cl-(aq) + H2(g)↑
H2 (ml)
80
senza NaCl
60
40
20
15 ml
20 s
20
20 s
40
60
5 ml
80
con NaCl
100
v=
d [H2 ]
dt
= f [ NaCl]
Inibizione da
componente
estraneo
120 tempo
Misura delle Velocità di Reazione
0.0400
Velocità istantanea a 150 s
0.0326 - 0.0249
= 7.7 x 10-5 mol L-1s-1
=
200 - 100
NO2 + CO
[NO] (mol L-1 )
0.0326
0.0300
↓
0.0268
0.0249
NO + CO2
0.0200
0.0160
0.0100
0
0
0.0268 - 0.0160
150 - 50
= 1.28 x !0-4 mol L-1 s-1
Velocità media =
Tempo (s)
50
100
150
200
Energia di Attivazione
Cinetica
Termodinamica
stato di transizione
G
reagenti
ΔG°= - RT ln Keq
ΔGtr
G
ΔGreaz
ΔGreaz
prodotti
Coordinata di reazione
G°reagenti
G°prodotti
equilibrio
dG= 0
req.
dr
dG< 0
dr
Coordinata di reazione
In presenza di un catalizzatore la barriera diminuisce e la velocità
aumenta (fattore cinetico). Ciò non modifica le proprietà
termodinamiche della reazione.
Il Reale Cammino di Reazione
G
cinetica
Stato attivato
Energia di Attivazione
(non correlata al ΔG°)
G°
reagenti
ΔG 0 = − RT ln K eq
ΔG°
termodinamica
G°
prodotti
dG
<0
dr
dG
=0
dr
dG
>0
dr
req.
r (coordinata di reazione)
Equilibrio
(reagenti + prodotti)eq
Stechiometria e Velocità
aA + bB
1 d
−
A (t )
a dt
1 d
−
B (t )
b dt
→
cC + dD
1d
−
C (t )
c dt
1 d
−
D (t )
d dt
Ci si aspetta che queste quattro espressioni siano
uguali, ma questo non è necessariamente il caso
Meccanismo di reazione!
Legge Cinetica
Correla la velocità alle concentrazioni istantanee
aA + bB → cC + dD
Ci si aspetta che più A e B sono presenti più C verrà
prodotto in un certo tempo, cioè
La velocità è proporzionale alla concentrazione
La teoria delle Collisioni aiuta a razionalizzare tale relazione
Legge Cinetica e Ordine di Reazione
Correla la velocità υ con le concentrazioni istantanee
aA + bB → cC + dD
d[A]
d[D] ([D] aumenta col tempo)
υ=
υ= −
dt
dt
([A] diminuisce col tempo)
velocità = k [ A ] ( t )
na
[ B] ( t ) [ C ] [ D ]
nb
Ordine di reazione = na + nb + nc + nd
Costante di velocità non una funzione
del tempo ma
k(T,P)
nc
nd
Ordine di reazione
parziale rispetto a D
1 d
velocità ( t ) = −
A(t )
a dt
Per cui la legge cinetica è
equazione differenziale.
Reazioni Elementari
aA + bB → cC + dD
velocità = k [ A ] ( t )
na
[ B] ( t ) [ C ] [ D ]
nb
nc
nd
na = a nb = b nc = c nd = d
La Stechiometria determina la legge cinetica,
ma solo per reazioni elementari !!!
Reazioni Elementari e Complesse
L’ordine di una reazione non è determinato dalla stechiometria totale. Solo
per reazioni elementari la stechiometria determina la legge cinetica.
Esempio : H2 + Br2 → 2HBr , l’ordine sperimentale di questa
reazione non è ne 1 ne 2.
Le reazioni avvengono attraverso una serie di atti elementari; sono cioè il
risultato di numerose reazioni intermedie, che portano alla formazione di
composti intermedi attraverso una serie di stadi attivati (complessi attivati)
che non si accumulano. Il percorso è indicato come cammino di reazione.
G
complessi attivati
Eatt
ΔG
Gi
Intermedi
Gf
Coord. reazione
Reazioni di Ordine Zero
La velocità di una reazione di ordine zero è indipendente dalla
concentrazione, cioè resta costante:
d[A]
υ= −
= k0
dt
d[A]
υ= −
= k0
dt
( M·s-1 )
[A]t
d[A]= − k0 dt
tt
∫ d[A]= − ∫ k
[A]0
0
t0
[A]t = [A]0 − k0 t
Una reazione non può essere di ordine zero indefinitamente.
Molte reazioni catalizzate dagli enzimi sembrano di ordine zero
quando si opera con un grande eccesso di reagenti.
dt
,
Esempio: Ossidazione Catalitica dell’Etanolo
Pt
CH3CH2OH + O2 → CH3CHO + H2O
CH3CH2OH
c = c0 - k0·t
c0
CH3CHO
c = k0·t
c
0
0
Tempo, t
Reazioni del Primo Ordine
Per una reazione di primo ordine la velocità dipende solo dalla
concentrazione di uno dei reagenti :
A → prodotti
d
v = − [ A] ( t ) = k1 [ A] ( t )
dt
[A]t
tt
d[A]
,
∫[A] [A] = − t∫ k1 dt
0
0
k1 , ha unità s-1
[A]t
ln
= − k1 (t − t0 )
[A]0
Termine fondamentale: vita media
Reazioni del Primo Ordine
Si può sempre postulare t0 = 0 :
[A]t
ln
= − k1 (t − t0 )
[A]0
ln[A] = ln[A]0 − k1 t
ln[A]0
ln[A ] = ln[A ]0 − k1t
Un grafico di ln[A] contro t
permette di determinare
k1 (dalla pendenza della
retta interpolante i dati).
ln[A]
k1 = tang()
Tempo, t
Reazioni del Primo Ordine
e
ln[A]
=e
ln[A]0 − k1 t
=e
[A]=[A]0 e
ln[A]0
e
− k1 t
− k1 t
Per reazioni di primo ordine la diminuzione di concentrazione dei
reagenti nel tempo è esponenziale.
(La diminuzione per una reazione di ordine zero è invece lineare.)
Se k ha le unità di s-1, (ln 2)/k è la vita media in secondi (t1/2). In
corrispondenza ad ogni t1/2, la [A] si riduce sempre della metà.
Tempo di Semitrasformazione o Vita Media
(Reaz. 1° Ordine)
t = t1/2
[A]0
[A]=
2
[A]0
− k1 t1/2
=[A]0 e
2
⎛1⎞
− k1 t1/2
ln ⎜ ⎟ = ln e
⎝2⎠
(
)
⎛1⎞
ln ⎜ ⎟ ≡ − ln 2 = − k1 t1/2
⎝2⎠
ln 2
t1/2 =
k1
ln 2 = 0.6931
L’emi-vita per una reazione di primo ordine non dipende dalla [A]0.
Esempi di Reazioni di Primo Ordine
(i)
(i)
(i)
(i)
•
•
•
•
Dissociazioni unimolecolari;
Processi radioattivi
Metabolismo di farmaci
Degradazione inquinanti.
14
6
C nelle piante si accumula nei tessuti.
14
Quando una pianta o l’animale muore il 6 C comincia a
Esempio: L’isotopo
disintegrarsi a seguito della reazione nucleare :
14
6
C →
14
7
N + −10β
Datazione al Radiocarbonio
Raggi
cosmici
Azoto-14
protone
perso
Carbonio-14
Cattura
neutronica
Tutte e tre gli isotopi
del carbonio (C-12,
C-13 e C-14
(radioattivo)) vengono
assorbiti dagli
organismi viventi.
suolo
Dopo la morte e l’interramento, il legno e le ossa
perdono il C-14 per decadimento beta a N-14.
Carbonio-14
particella
beta
Dec. beta
protone
Azoto-14
neutrone
Il metodo della datazione al
radiocarbonio fu sviluppato nel 1940
da Willard F. Libby e colleghi
all’Università di Chicago.
Successivamente si sviluppo nel più
potente metodo di datazione di
manufatti ed eventi geologici del tardo
Pleistocene ed Olocene di circa 50,000
anni di età. Il metodo del radiocarbonio
si applica in molti e diversi campi
scientifici, inclusa l’archeologia, la
geologia, l’oceanografia, l’idrologia, la
scienza dell’atmosfera, e la
paleoclimatologia. Libby ricevette il
Premio Nobel in Chimica nel 1960.
Decadimento Radioattivo
14
6
C →
14
7
N + −10β
Si tratta di una reazione del primo ordine con un tempo di
semitrasformazione di 5770 anni. Se un reperto archeologico
contiene solo il 29% del
14
6
C
che conteneva quando era ancora in
vita, quanti anni sono passati dalla sua morte?
t1 / 2
ln 2
=
k1
k1 =
[146 C]
ln 14
= − k1t
[ 6 C]0
ln 2
ln 2
=
= 1.201 × 10− 4 anni −1
t1 / 2 5770 anni
[14
C]
ln 146
− ln 0.29
[ 6 C]0
t=−
=
= 10300 anni
4
−1
k1
1.201 × 10 anni
Reazioni di Secondo Ordine
2A → prodotti
Classe I.
A + B → prodotti
1) Classe I.
[A]t
t
υ = k2 [A]2
Classe II: υ = k2 [A] [B]
Unità di k2 : M-1·s-1
d[A]
υ= −
= k2 [A]2
dt
d[A]
,
=
−
k
dt
∫[A] [A]2 ∫0 2
0
1
1
−
= k2 t
[A]t [A]0
[A]0 k2 t +1)
(
1
=
[A]
[A]0
1
1
= k2 t +
[A]
[A]0
Reazioni di Secondo Ordine
Concentrazione [A]
[A]0
[A] =
([A]0 k2 t +1)
Un grafico di [A]−1 contro t fornisce una
retta con pendenza = k2
1.2
1
II°ordine
0.8
0.6
0.4
0.2
I°ordine
0
0
2
4
6
8
Tempo (s)
10
12
14
16
Diminuzione della concentrazione di [A] nel tempo: reazioni di 1°vs. 2°ordine.
Tempo di Semitrasformazione (2° Ordine)
L’emi-vita di A : il tempo t1/2 per cui
[A]0
[A] =
([A]0 k2 t +1)
t1/2
1
=
k2 [A]0
ln 2
t1/2 =
k1
[A]0
[A]=
2
2
1
= k2 t1/2 +
[A]0
[A]0
Per una reazione di secondo ordine
Per una reazione di primo ordine
Il tempo di semi-trasformazione di una reazione di secondo
ordine dipende dalla concentrazione iniziale dei reagenti.
Reazioni di Secondo Ordine (Classe II)
A + B
→ prodotti
c0A, c0B concentrazioni iniziali
x = (quantità / V) di A reagito
dx d [ A]
=
= k ( c0 A − x ) ⋅ ( c0 B − x )
dt
dt
dx
= k dt
( c0 A − x ) ⋅ ( c0 B − x )
(c0A – x) =
concentrazione
di A al tempo t
Reazioni di Secondo Ordine (Classe II)
1/ [(c0A - x)·(c0B - x)] = C/ [c0A - x] + D/ [c0B - x]
1 = D [c0A - x] + C [c0B - x]
1 = D c 0A + C c 0B
0=Dx+Cx
Per cui C = -D e 1/(c0A - c0B) = D (solo se le conc. iniziali distinte)
-dx / [c0A - x] + dx/ [c0B - x] = (c0A - c0B) kdt = kdt
dln [c0A - x] - dln [c0B - x ] = kdt
(c0A - x)/(c0B - x) = eKt per c0A ≠ c0B
La costante effettiva di velocità dipende dalla concentrazione
Determinazione Sperimentale dell’Ordine di
Reazione
I. Metodo grafico :
Ordine di reazione
Grafico tipo retta
0
[A] contro t
1
ln[A] contro t
2 (classe I)
1/[A] contro t
2 (classe II)
ln([A]/[B]) contro t
Cinetica del Primo Ordine
2 N2O5 (g) f 4 NO2 (g) + O2 (g)
tempo
(min)
20
16
[N2O5]
12
8
4
20
104 v
40 60 80 tempo
0
10
20
30
40
50
60
70
4
Pr
(mmHg)
[N2O5]
M
340.2
224.8
166.7
123.2
92.2
69.1
51.1
37.5
0.0172
0.0113
0.0084
0.0062
0.0046
0.0035
0.0026
0.0019
v
(M-1s-1)
-
3.4 x 10-4
2.5 x 10-4
1.8 x 10-4
1.3 x 10-4
1.0 x 10-4
0.8 x 10-4
0.6 x 10-4
tangenti alla curva
(M-1s-1) 3
Velocità = k [N2O5]
2
1
k = pendenza = 3.0 x 10-4 min-1
2
4
6
8
10
[N2O5]x103
Determinazione Sperimentale dell’Ordine di
Reazione
II. Metodo delle concentrazioni iniziali.
La velocità iniziale di una reazione è la velocità nell’instante in
cui si mescolano i reagenti.
υ 0 = k [A]0m [B]0n [C]0p
m = ordine di reazione
rispetto ad A
Se si varia [A]0 mantenendo costante la concentrazione di tutti gli
altri reagenti si può determinare una costante effettiva k’ :
υ0 = k ( [B]0n [C]0p ) [A]0m = k '[A]0m
ln v = ln k '+ m ln [ A ]
Un grafico del logaritmo della velocità (misurata a varie concentrazioni
di un reagente) in funzione del logaritmo della concentrazione del
reagente é una retta con pendenza m.
Esempio
Se [A] è in grande eccesso in rapporto a [B] la reazione
si comporta come una reazione di primo ordine:
υ = k2 [A][B] ≈ k’ [B] → pseudo-1° ordine.
Occorrono varie misure cinetiche a diverse
concentrazioni fisse del reagente in eccesso A per
determinare la vera costante di velocità k2 e il vero
ordine di reazione.
Metodo delle Velocità Iniziali
In generale durante una reazione variano contemporaneamente le
concentrazioni di più reagenti. Ciò impone una analisi più complessa
della cinetica di reazione. Si semplifica il problema misurando la velocità
nei primi attimi del processo, quando sono variate di poco le
concentrazioni, e si fa variare la concentrazione di un solo reagente
(metodo della velocità iniziale).
2 NO(g) + Cl2 (g) → 2 NOCl(g)
Concentrazioni iniziali (M)
[NO]
[Cl2]
0.010
0.010
0.020
Velocità = k
0.010
0.020
0.020
[NO]2 [Cl
2]
Velocità iniziali (M-1s-1)
1.2 x 10-4
2.3 x 10-4
9.6 x 10-4
secondo ordine rispetto a NO
primo ordine rispetto a Cl2
Metodo della Legge Integrata
In generale si possono recuperare le velocità per integrazione della
legge cinetica che, con il metodo dell’isolamento, ha la forma :
velocità = v =
Reazioni del primo ordine (n =1)
v = -d[A]/dt = k [A]
ln [ A ]t = −kt + ln [ A ]0
[ A ]0
ln
= k t1/ 2
1/ 2 [ A ]0
Reazioni del secondo ordine (n =2)
v = -d[A]/dt = k [A]2
1
1
=kt+
[ A ]t
[ A ]0
d [A]
dt
= k [A]
n
ln[A]t
pendenza = - k
ln[A]o
t
1
[A]t
1
[A]o
pendenza = k
t
Reazioni Dirette e Inverse
La velocità complessiva di una
singola reazione è la velocità diretta
ma in processi reversibili esiste
anche la velocità di reazione inversa
Cinetica ed Equilibrio - Bilancio Dettagliato
All’equilibrio le velocità diretta ed inversa di ogni reazione
elementare si bilanciano
k1
A+B a C+D
k-1
k1
2 HI(g) a H2 (g) + I2 (g)
k-1
v=
d [H2 ]
dt
=
d [ I2 ]
k1
K=
k−1
[H2]
2 HI → H2 + I2
dt
= k1 [ HI ] − k−1 [ H 2 ][ I 2 ]
2
k1 [ A ][ B] = k−1 [ C][ D ]
H2 + I2 → 2 HI
k1
K=
k−1
equilibrio
t
Riassunto Leggi Cinetiche per Reazioni Semplici
Reazione Ordine
Eq. cinetica
Forma integrata
Unità
AfB
Zero
− d [A] / dt = 0
[ A ] = [ A ]0 − kt
mol l-1
AfB
Primo
−d [A] / dt = k [ A ]
ln[A]t = − kt + ln[A]0
s-1
1
1
= k ⋅t +
[A]t
[A]0
l mol-1s-1
A + A f B Secondo −d [A] / dt = k [ A ]
2
Aa B
Primo
−d [A] / dt = k1 [ A ] − k−1 [ B]
A + B f P Secondo −d [A] / dt = k1 [ A ][ B]
ln
[A]0
= k ⋅ t1/ 2
1/ 2[A]0
t1/2 = ln(2)/k (tempo di dimezzamento)
s-1
l mol-1s-1
t1/2 =1/k[A]o
Meccanismo di Reazione
(Sequenza di Reazioni Elementari)
Come detto per le Reazioni Elementari
la stechiometria fornisce la legge cinetica
nA + mB → prodotti
velocità = k [ A ] [ B]
n
m
Ma la maggior parte delle reazioni hanno cinetiche complesse
perché si svolgono attraverso numerose strade parallele o
consecutive costituite da tante reazioni elementari.
Reazioni Parallele
k1
A → B
k2
[X]
A
A → C
B
C
D
k3
A → D
processi monomolecolari
Espressioni delle velocità
d [A]
−
= ( k1 + k2 ) [A]
dt
d [B]
−
= k1[A]
dt
d [C]
−
= k2 [A]
dt
t
Resa: Frazione di un reagente
convertito in un prodotto
Selettività : S0 =
χB
χC
Selettività istantanea: S0 =
χ B k1
= = Sp
χ C k2
xB = frazione del reagente A convertito a B
xC = frazione del reagente A convertito a C
Reazioni Consecutive
A
k1
B
k2
C
mol
%
prodotti (C)
prodotti (C)
80
A
Intermedio (B)
60
A
40
20
k2 ≈ k1
t
Intermedio labile (B)
k2 » k1
t
Assunti Semplificanti
• Fase determinante la velocità (pre-equilibrio)
• Approssimazione dello Stato Stazionario
Fasi Determinati la Velocità
Fasi lente in un meccanismo di reazione
Le fasi antecedenti raggiungono l’equilibrio
La fase(i) successive sono veloci/irrilevanti
CONCETTO CHIAVE: intermedi reattivi
Esempio (2NO + O2 → 2NO2) (O.R. = 3)
k1
Le collisioni a tre
corpi sono rare
NO + NO
a
k-1
k2
N2O2 (equilibrio veloce)
N2O2 + O2 → 2NO2
(lento)
Poiché la fase lenta determina la velocità complessiva, si può scrivere:
velocità = k2 [N 2 O 2 ] ⋅ [ O 2 ]
La concentrazione di un intermedio reattivo come N2O2 non può però essere
variata a piacere. Siccome N2O2 reagisce solo lentamente con O2, la
reazione inversa (a 2 NO) è possibile e si deve prendere in considerazione.
Esempio (2)
In effetti, è ragionevole assumere che tutte le reazioni elementari che
avvengono prima della fase determinante la velocità siano in equilibrio con
le reazioni diretta e inversa che avvengono alla stessa velocità. In tal caso,
si ha:
[N 2 O 2 ]
[ NO]
2
=
k1
= K1
k−1
[N 2 O 2 ] = K1 [ NO ]
2
velocità = k2 [N 2 O 2 ] ⋅ [ O 2 ]
Questo risultato è consistente con l’ordine di reazione osservato, con
k2 K1 = kobs
Esempio Classico - Sintesi HI
H2 + I2 a 2HI
velocità = k2 [H 2 ] ⋅ [ I 2 ]
Ma
hν + I2 f 2I
velocità drammaticamente aumentata!!!
M + I2 a I + I + M veloce
I + H2 a H2I
H2I + I f 2HI
K1 = [ I ] / [ I 2 ]
veloce
poco veloce
2
K 2 = [H 2 I] / ([ H 2 ][ I ])
k = [ H 2 I] ⋅ [ I]
Esempio Classico (2)
velocità = k2 [H 2 ] ⋅ [ I 2 ]
K 2 = [H 2 I] / ([ H 2 ][ I ])
K 2 [ H 2 ][ I ] = [H 2 I]
velocità = kK 2 [ H 2 ] ⋅ [ I ][ I ]
= kK 2 [ H 2 ][ I ]
2
= kK 2 K1 [ I 2 ][ H 2 ]
K1 [ I ] / [ I 2 ]
2
Approssimazione dello Stato Stazionario
Nessuna fase è determinante la velocità
Si applica a (un) intermedio I
d [I] ( t )
= formazione − distruzione = 0
dt
L’approssimazione dello stato stazionario è un approccio più
generale che si può usare quando non vi sia alcuna fase
determinante la velocità.
Approssimazione dello Stato Stazionario e
Meccanismo Lindemann del Complesso Attivato
d [ A*] ( t )
A + M a A* + M
A* f prodotti
dt
k1 [ A ][ M ] − k−1 [ A*][ M ] − k2 [ A*] = 0
[ A*] =
k1 [ A ][ M ]
{k [ M ] + k }
−1
2
velocità = k2 [ A*] = k2
k1 [ A ][ M ]
{k [ M ] + k }
−1
2
=0
Esempio N2O5 → 2NO2 + 1/2 O2
N2O5 + M a N2O5* + M
N2O5* f
k 2NO2 + 1/2 O2
2
d [ N 2 O5 *]
dt
= k1 [ N 2 O5 ][ M ] − k−1 [ N 2 O5 *][ M ] − k2 [ N 2 O5 *]
All’inizio della reazione, [N2O5*] è 0, ma la sua concentrazione cresce dopo
breve tempo ad un basso valore. L’approssimazione dello stato-stazionario
consiste nell’assunto che dopo poco tempo le velocità di produzione e
scomparsa di N2O5* diventano uguali e
d [ N 2 O5 *]
dt
=0
Esempio N2O5
[ N 2O2 *]{k2 + k−1 [ M ]} = k1 [ N 2O5 ][ M ]
[ N 2O2 *] =
k1 [ N 2 O5 ][ M ]
k2 + k−1 [ M ]
La velocità della reazione complessiva N2O5 → 2NO2 + 1/2 O2 è
k1k2 [ N 2 O5 ][ M ]
1 d [ NO 2 ]
= k2 [ N 2 O5 *] =
velocità =
2
dt
k2 + k−1 [ M ]
L’espressione presenta due casi limite :
1) Bassa pressione quando [M] è abbastanza piccolo, k2 >> k-1[M] e si può
usare l’approssimazione (cioè è la prima fase che determina la velocità)
velocità = k1k2 [ N 2 O5 ][ M ]
(secondo ordine)
1) Alta pressione Quando [M] è abbastanza alta, k-1[M] >> k2 e si può usare
l’ approssimazione (cioè è la seconda fase che determina la velocità)
velocità =
k1
k 2 [ N 2 O5 ]
k−1
(primo ordine)
Dipendenza della Costante di Velocità k da T
L’esperienza ci dice: c’è una relazione logaritmica tra la costante
di velocità di una reazione e T-1: Arrhenius-1889
⎛1⎞
ln k = pendenza × ⎜ ⎟ + ln A
⎝T ⎠
Pendenza = ?
Ma si trova che la reazione:
CH3• + CH3• non dipende da T
Perché CH3• + CH3• è differente?
Legge di Arrhenius
Legata al concetto di barriera (energia) di attivazione:
pendenza = − Ea/R
⎛1⎞
ln k = pendenza × ⎜ ⎟ + ln A
⎝T⎠
⎛ Ea ⎞
k = A exp ⎜ −
⎟
RT
⎝
⎠
(a) Analogie con l’espressione microscopica di Boltzmann
per W di un gas perfetto termostatato.
(b) Analogie con Keq :
K=e
ΔG 0
−
RT
Energia di Attivazione
stato di transizione
G
Ea
reagenti
DGreaz
fattore cinetico
fattore termodinamico
prodotti
Coordinata di reazione
In presenza di un catalizzatore la barriera diminuisce e la
velocità aumenta (fattore cinetico).
Legge di Arrhenius
⎛ Ea ⎞
k = A exp ⎜ −
⎟
RT
⎝
⎠
Ea è l’energia di attivazione, A è il fattore pre-esponenziale che
dipende dalla frequenza di collisioni tra i reagenti.
Un grafico di lnk contro 1/T fornisce una retta
con pendenza:
⎛1⎞
ln k = pendenza × ⎜ ⎟ + ln A
⎝T⎠
Ea
pendenza = −
R
Effetto di T sulla Velocità di Reazione
In base alla legge di Arrhenius è facile valutare la velocità di una
reazione a due diverse temperature k2 a T2 e k1 a T1:
Ea
R
⎛ 1 ⎞
⎜ ⎟ + ln A
⎝ T2 ⎠
Ea
ln k1 = −
R
⎛1⎞
⎜ ⎟ + ln A
⎝ T1 ⎠
ln k2 = −
−
E
(ln k2 − ln k1 ) = − a
R
⎛ k2 ⎞
Ea
⎛ 1 1⎞
ln
=
−
−
⎜ ⎟
⎜
⎟ →
R
T
T
1 ⎠
⎝ 2
⎝ k1 ⎠
⎛ 1 1⎞
⎜ − ⎟
⎝ T2 T1 ⎠
⎛ K2 ⎞
ΔH 0 ⎛ 1 1 ⎞
Analogie con Keq : ln ⎜ ⎟ = −
⎜ − ⎟
R ⎝ T2 T1 ⎠
⎝ K1 ⎠
Esempio
T(°C)
61.0
71.2
k (min-1)
0.71·10-5
2.77·10-5
Calcolare Ea, A, e k a 80°C.
⎛ k2 ⎞
Ea
ln ⎜ ⎟ = −
R
⎝ k1 ⎠
k2
k1
Ea =
⎛ 1 1⎞
⎜ − ⎟
⎝ T2 T1 ⎠
⎛ 1 1⎞
⎜ − ⎟
⎝ T2 T1 ⎠
− R ln
= 128 000 J (per mole di reazione)
Esempio
k1
k2
A=
=
= 7.26 × 1014 min -1
exp( − E a / RT1 ) exp( − E a / RT2 )
A T = 80°C :
-1
⎛
⎞
⎛
⎞
Ea
128000
J
mol
−
14
-1
k = A exp ⎜ −
⎟
⎟ = (7.26 × 10 min ) exp ⎜
-1
R(353K)
8.3145
J
K
(353.15
K)
⎝
⎠
⎝
⎠
= 8.49×10-5 min-1
à 353 K
Dipendenza della Velocità dalla Temperatura
v
v
v
vmax
(mol s-1)
T , °K
Cinetica di reazione
tipica (legge Arrhenius)
La velocità aumenta
di un fattore 2-3 ogni
aumento di 10 °C
della temperatura.
Tin. T , °K
T , °K
Cinetica di reazione
esplosiva
(Tin. = temp. innesco)
Cinetica di reazione
enzimatica (catalitica)
La velocità aumenta
normalmente fino a
Tin, dopo di che si
innalza bruscamente.
La velocità aumenta
fino a raggiungere
un valore massimo,
quindi cala.
Teoria dello Stato di Transizione
Analogie con Keq :
K=e
ΔG 0
−
RT
Lo stato di transizione: una struttura intermedia tra i
reagenti e i prodotti (al culmine del grafico energetico)
La frequenza di vibrazione che corrisponde al massimo
energetico è negativa → una struttura instabile.
Stato di Transizione
stato di transizione
G
ΔGtr
reagenti
ΔGtr
ΔGreaz
prodotti
Coordinata di reazione
Calcoli Teorici sui Cammini di Reazione
+
Chemin réactionnel
de l'insertion
linéaire de l'éthylène
sur DIP-Fe CH
3+
Cammino
di reazione
per l’inserimento
dell’etilene
sul DIP-Fe-CH
3
(Calcul DFT/BLAP3)
(calcoli DFT/BLAP3)
α ag =73°
R ag =2.07Å
α ag =58°
R ag =1.84Å
α ag =49°
+0.5
R ag =1.86Å
TS1
-7.3
complexe π π
Complesso
α ag =97°
R ag =2.38Å
-15.0
Intermedio
intermédiaire γ-agostico
γ− agostique
α ag =48°
R ag =2.04Å
Teoria dello Stato di Transizione
Nella (TET) si ipotizza che la struttura del transiente sia in
equilibrio chimico con i reagenti.
A+ B
k
C+D
complesso attivato
A+ B
K#
AB#
k#
C+D
#
[AB
]
#
→ [AB#] = K# [A][B]
K =
[A][B]
(Per υ attorno alla velocità iniziale υ0)
Teoria dello Stato di Transizione
Dissociazione unimolecolare dello stato di transizione: una reazione
di primo ordine con un k# che si suppone lo stesso per tutte le
reazioni.
A+ B
K#
AB#
k#
C+D
d[C] d[D] #
υ =
=
= k [AB# ] = k # K # [A][B]
dt
dt
#
La velocità di reazione:
υ = k[A][B]=
d[C] # #
= k K [A][B]
dt
→ k = k# K#
kB T
k =
h
#
Teoria dello Stato di Transizione
K# può esprimersi mediante la formula termodinamica:
#
⎛
⎞
Δ
G
#
K = exp ⎜ −
⎟ ,
⎝ RT ⎠
ΔG# = ΔH# − TΔS#
⎛ ΔS# ⎞
⎛ −ΔH # ⎞
kB T
k =k K =
exp ⎜
⎟ exp ⎜
⎟
h
R
RT
⎝
⎠
⎝
⎠
#
#
Questo rappresenta il principale risultato della teoria dello
stato di transizione.
Confronto tra TET e Arrhenius
Confronto con la formula di Arrhenius per la
stessa reazione A + B → C + D:
TET
Arrhenius
⎛ ΔS# ⎞
⎛ −ΔH # ⎞
kB T
k =k K =
exp ⎜
⎟ exp ⎜
⎟
h
R
RT
⎝
⎠
⎝
⎠
#
#
ΔH# ≈ Ea ;
⎛ Ea ⎞
k = A exp ⎜ −
⎟
RT
⎝
⎠
⎛ ΔS# ⎞
kB T
A≈
exp ⎜
⎟
h
R
⎝
⎠
Significato di A
La teoria dello stato di transizione fornisce una interpretazione
del fattore pre-esponenziale A nella formule di Arrhenius:
Ea
ln k = −
R
TET:
⎛1⎞
× ⎜ ⎟ + ln A
⎝T⎠
⎛ ΔS# ⎞
⎛ −ΔH # ⎞
kB T
k =k K =
exp ⎜
⎟ exp ⎜
⎟
h
R
RT
⎝
⎠
⎝
⎠
#
#
k BT
Quando A <
→ ΔS# < 0 → lo stato di transizione è
h
più ordinato dei reagenti (una reazione bi- molecolare in
fase gas).
Teoria delle Collisioni
Descrizione microscopica di
A + A → prodotti
Area x velocità = volume/tempo
t = u x l sec
u da MB
perso
coinvolto
d
d
V = π l2 u
d
coinvolto
perso
coinvolto
Una molecola in media (in
rosso) spazza un cilindro di
volume π l2 in un secondo.
Colliderà con qualsiasi
molecola il cui centro sta
all’interno del cilindro. Da
ciò, si può calcolare la
velocità delle sue collisioni
con le altre molecole
V x densità (quasi uguale) = N°di collisioni
Teoria delle Collisioni (2)
Le molecole si assumono approssimativamente sferiche con diametro d,
dell’ordine di 10-10 m. Si suppone che
si muovano in un gas di molecole
stazionarie delle stesse dimensioni.
Queste spazzano un cilindro di area
πd2 e collidono con tutte quelle
all’interno al cilindro. In un secondo,
la lunghezza di un tale cilindro
u x Δt = u x1s, con u velocità media.
In 1 secondo, le molecole coprono un
volume di V = πd2u. Se N/V è il
numero di molecole per unità di
volume (dgas), il numero di collisioni al
secondo circa è
Inserendo il risultato per
u dalla teoria cinetica
8RT
= u si ha:
Mπ
Z1 =
N 2 π RT
d
V
M
Volume spazzato/tempo
{⎣⎡π d
4d ρ
2
N
Z1 = 2 π d 2u
V
Velocità media
2
Particelle nel
volume spazzato
}
u ⎦⎤ densità 2 = Z1 =
π RT
M
Frequenza di collisione = collisioni/tempo Z1
Teoria delle Collisioni (3)
Z1 = 2π d 2u
π RT
N
= 4d 2
V
M
d : diametro molecolare
u : velocità media
M : peso molecolare
N/V : densità di molecole nel gas
velocità di collisioni per unità di volume
1 NZ1
velocità totale di
Collisioni /volume 2 V
Z AA = 2d 2
1 N
1
=
ρ Z1
Numero totale di collisioni/tempo/volume =
2 VZ1 2
=
1 2 2 π RT
ρ 4d
= Z AA
2
M
π RT ⎛ N ⎞
⎜ ⎟
M ⎝V ⎠
2
Teoria delle Collisioni (4)
Una collisione elimina due molecole A
A + A → prodotti
⎛ 1 ⎞ dN
= −2 Z AA
⎜ ⎟
⎝ V ⎠ dt
[ ] = densità molare = ρ/N0
d [A]
dt
2Z AA
=−
N0
1 d [ A ] Z AA
2 2 ⎛ N 0 ⎞ ⎛ π RT ⎞
=
= 2d ρ ⎜ 2 ⎟ ⎜
velocità = −
⎟=
2 dt
N0
⎝ N0 ⎠ ⎝ M ⎠
⎡ 2
π RT ⎤
2
=
A
2
A
d
N
k
[ ]⎢
[ ]
⎥
0
M
⎣
⎦
2
⎡ 2
π RT ⎤
k = ⎢ 2d N 0
⎥
M ⎦
⎣
Ogni collisione produce una reazione?
Collisioni e Fattore Sterico
NO
NO22Cl
Cl++Cl
Cl f
f Cl
Cl22++NO
NO22
ONO
Cl
1 mole gas a P = 1 atm e T = 298 °K
N. collisioni/sec. = 107
tempo di reazione = 1 mol/107 mol s-1
= 10-7 s, se tutte le collisioni sono attive.
ONO
ONO
Cl
Cl
ONO
Cl
ONO
Cl
Cl
Cl
Cl
Collisione efficace
Cl
ONO
Cl
collisione non efficace
Cl
Cl
Origine dell’Energia di Attivazione
Marcelin-1915
non tutte le collisioni danno reazione
Le specie che collidono devono avere
sufficiente energia per reagire
La media non è tutto
Maxwell-Boltzmann e cammino di reazione
Distribuzione di Maxwell-Boltzmann
Effetto della Temperatura su k
Distribuzione Energia cinetica
0.004
Distribuzione Energia di collisione
0.004
T3 > T1
T1
f(v)
f(v)
T2
0.002
E > Eatt.
0.002
T3
0
0
1000
2000
<u> = velocità media
Frazione di molecole con energia
> Eatt diminuisce come:
exp(−Eatt / RT )
v
0
v
0
1000
2000
Distribuzione MB
⎛ m ⎞
⎟⎟
f (u ) = 4π ⎜⎜
⎝ 2π kT ⎠
3/ 2 ∞
∫
0
u 2 exp(−mu 2 / 2kT )
Funzione Densità di Probabilità
(Distribuzione)
f(u)du è la probabilità di avere la velocità u tra u e u+du
f (u) ≥ 0
f(u)
∫ g (u) f (u)du = g
u u+du
∞
∫ f (u)du = 1
−∞
Normalizzazione
Entropia di Attivazione
Per una reazione del tipo :
A−(aq) + B+(aq) → AB# (aq) → prodotti
ΔS# > 0 → delle molecole di acqua sono liberate a seguito della
formazione di AB# (qui una struttura non carica).
Per una reazione del tipo :
A−(aq) + B-(aq) → (AB#)2- (aq) → prodotti
ΔS# < 0 perché lo stato di transizione è fortemente carico, e
porta ad attrarre più molecole di solvente.
Cinetica Chimica e Equilibrio
Il meccanismo di una reazione: une serie di stadi elementari (monoo bi- molecolari). All’equilibrio ogni stadio elementare deve essere
una reazione reversibile.
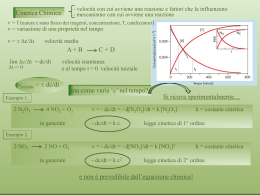
k2
A + B
All’equilibrio:
k-2
C + D
k2 [A][B] = k-2 [C][D]
k2 [C]eq [D]eq
=
≡ K eq
k−2 [A]eq [B]eq
Principio della Reversibilità Microscopica
Se una reazione passa per uno stadio intermedio o lo stato
di transizione, all’equilibrio la reazione opposta passerà
dallo stesso stato di transizione della reazione originale.
k1
A
B
k-1
k-3
k3
k2
C
k-2
k1 ⎛ k2 ⎞ ⎛ k3 ⎞
=⎜
K=
⎟
⎟⎜
k−1 ⎝ k−2 ⎠⎝ k−3 ⎠
Catalisi nelle Reazioni Chimiche
X≠
Non catalizzata
ΔΔGcat≠
(riduzione in ΔG ≠
da parte del
catalizzatore)
G
catalizzata
A+B
A+B a C+D
coordinata di reazione
C+D
Esempio di Reazione Catalizzata
Composti chimici apparentemente estranei alla reazione in esame
(non intervengono cioè nella stechiometria complessiva della
reazione) ma che modificano la velocità di reazione. In molti casi è
possibile recuperarli alla fine della reazione inalterati.
Catalizzatori positivi : aumentano la velocità
Catalizzatori negativi : abbassano la velocità (eliminano Cat. pos.)
SO2 + 1/2 O2 f SO3
ΔG°= 70.8 kJ/mol
Catalisi omogenea gassosa
NO + 1/2 O2
Eatt. = 162 kJ/mol
SO2 + NO2
Eatt. (NO) = 104 kJ/mol
SO2 + 1/2 O2
k1
→
k2
NO2
→
SO3 + NO
→
SO3
Inibitori (o Catalizzatori Negativi)
A) Eliminatori di catalizzatori positivi (Stabilizzanti)
ΔG°= - 123.9 kJ mol-1
H2O2 fn+ H2O + 1/2 O2
M
catalizzata da ioni metallici
L
CH2COOH
HOOCH2C
+ Mn+
N-CH2CH2-N
HOOCH2C
CH2COOH
EDTA
L
M
L
L
L
L
complesso Mn+ - EDTA
poco attivo nella decomp.
B) Interruttori di catene radicaliche (Antiossidanti)
R-H
f R.
O2
ROO.
R-H
Inb.
R-H o R-Inb.
R-PhOH (vit. E)
R2NH (ALS)
Vitamina A e C
Tioli e solfuri
Cinetica delle Reazioni Catalizzate da Enzimi
Gli enzimi sono capaci di aumentare enormemente
la velocità della reazione catalizzata :
2 H2O2 (aq) → 2 H2O (liq) + O2 (g)
In presenza dell’enzima catalasi la velocità
aumenta circa 15 ordini di grandezza.
Nella maggior parte delle reazioni enzimatiche l’azione
catalitica consiste in una forte stabilizzazione dello
stato di transizione a seguito di interazioni non
covalenti.
Catalisi Enzimatica
Energia libera (G)
Stato di
transizione
Non catalizzata
ΔG di attivazione
catalizzata
E+S
ΔG di reazione
ES
EP
E+P
ΔG di legame
coordinata di reazione
Catalisi Enzimatica
d [ P]
Termine
inizio
dt
[S]
Dipendenza della velocità di
una reazione enzimatica dalla
concentrazione del substrato.
La linea tratteggiata corrisponde
alla velocità raggiunta ad
elevata [S]
0
Enzima
Substrato
Enzima legato Substrato spezzato
al substrato
+
Enzima non-legato
Sito Catalitico dell’Enzima
Cinetica di Michaelis-Menten
La cinetica di una reazione enzimatica di ordine
complesso.
Sistema :
catalizzatore
E
S
Reagente (substrato)
P
l’insieme dei prodotti
Dati Sperimentali
1). La velocità di una reazione enzimatica è proporzionale
alla concentrazione dell’enzima :
υ ∝ [E]
2). A basse concentrazioni di substrato la velocità è
proporzionale alla concentrazione del substrato:
υ = k [S]
3). Ad alte concentrazioni di substrato la velocità diventa
indipendente dalla [S] e raggiunge il sua valore massimo.
υ = υmax
Cinetica di tipo Michaelis-Menton
0.9
0.8
velocità iniziale
0.7
0.6
0.5
1
υmax
2
0.4
0.3
0.2
0.1
KM
0
0
0.2
0.4
0.6
[S]
[S]
0.8
1
1.2
1.4
Complesso ES
L’esperienza mostra la formazione di un
complesso intermedio tra S e E (ES).
Ad alta [S] tutto l’E partecipa al ES: υ = υmax:
Un aumento ulteriore di [S] non influenzerà più la
velocità (υ = υmax = cost.).
Definizione: la costante catalitica dell’enzima (kcat) :
kcat =
υ max
[E 0 ]
[E0] è la concentrazione totale dell’enzima.
Cinetica di Michaelis-Menten a Due Stadi
1) Formazione di un complesso (ES) (stadio reversibile):
k1
⎯⎯
→ ES
E + S ←⎯⎯
k−1
2) Formazione del prodotto e rigenerazione del
catalizzatore:
ES ⎯⎯→ E + P
k2
Cinetica di Michaelis-Menten a Due Stadi
k1
k2
⎯⎯
→
E + S ←⎯⎯ ES ⎯⎯→ E + SP
k−1
Il secondo stadio diventa anch’esso reversibile a tempi
lunghi.
L’equilibrio del 1° stadio si stabilisce prima del 2° → si
trascura l’effetto della reazione opposta nel 2° stadio.
Analogie con la TET
A+ B
K#
AB#
k#
d[C] # #
υ = k[A][B]=
= k K [A][B]
dt
C+D
→ k = k# K#
Velocità Iniziale
La cinetica di Michaelis-Menten si applica alla velocità
iniziale (υ0):
ES
k2
E + P
⎛ d[P] ⎞
υ0 = ⎜
⎟ = k2 [ES]
⎝ dt ⎠t=0
k2 = kcat =
υ max
[E 0 ]
Stato Stazionario
L’approssimazione dello stato stazionario
(‘steady state’) per la [ES] :
d[ES]
= 0 = k1 [E][S] − k −1 [ES] − k 2 [ES]
dt
k1 [E][S] = ( k −1 + k 2 )[ES]
k1 [E][S]
[ES] =
( k −1 + k 2 )
Altre Considerazioni
I valori reali di [E] e [S] sono molto difficili da misurare.
In realtà si conosce solo [E]0 e [S]0
[E]0 = [E] + [ES]
→ [E] = [E]0 − [ES]
La parte di S che è in forma ES è molto più piccola
della concentrazione totale [S]0 :
[S]0 = [S] + [ES] ≈ [S]
Ulteriori considerazioni
[ES] =
[ES] =
k1 [E][S]
,
( k −1 + k 2 )
[E] = [E]0 − [ES]
[ES] =
k1 ([E]0 − [ES]) [S]
( k −1
+ k2 )
⎛ d[P] ⎞
⎟ = k2 [ES]
⎝ dt ⎠t=0
υ0 = ⎜
k2 = kcat
[E]0
⎛ ( k −1 + k 2 ) ⎞
⎜1 +
⎟
k
[S]
1
⎝
⎠
Equazione di Michaelis-Menten
υ0 = k2 [ES] =
k2 [E]0
⎛ ⎛ k−1 + k2 ⎞ 1 ⎞
⎜⎜1 + ⎜
⎟ ⎟⎟
⎝ ⎝ k1 ⎠ [S] ⎠
υmax = kcat[E]0 = k2[E]0
υ0 =
υmax
⎛ KM ⎞
⎜1 + [S] ⎟
⎝
⎠
⎛ k−1 + k2 ⎞
KM = ⎜
⎟
k
1
⎝
⎠
La costante di Michaelis KM : legata alla stabilità di ES
Equazione di Michaelis-Menten
υ0 =
υmax
⎛ KM ⎞
⎜1 + [S] ⎟
⎝
⎠
,
⎛ k−1 + k2 ⎞
KM = ⎜
⎟
k
1
⎝
⎠
(KM : Moli)
Le proprietà osservate sperimentalmente si
spiegano bene con il modello di Michaelis-Menten:
(a) Quando KM è piccola: k1 > (k-1 + k2 ) e (ES) è più
stabile (il legame enzima – substrato è più forte). E’
l’opposto quando KM è grande (k1 < (k-1 + k2 ).
Equazione di Michaelis-Menten
(b) Quando [S] è piccolo: KM/[S] >> 1:
υ0 =
υmax
⎛ KM ⎞
⎜1 + [S] ⎟
⎝
⎠
≈
υmax υmax [S]
KM
[S]
=
KM
≡ k[S]
(primo ordine)
k = υmax /KM = costante per una data [E0].
Equazione di Michaelis-Menten
υ0 =
υmax
⎛ KM ⎞
⎜1 + [S] ⎟
⎝
⎠
(c) Quando KM/[S] << 1 → υ0 = υmax :
υmax non dipende che da [E]0
(d) Quando [S] = KM , l’equazione di Michaelis diventa :
1
υ0 = υmax
2
Si può stimare KM da un grafico cinetico: determinare υmax e il
valore di [S] che corrisponde a υmax /2 .
L’equazione di Michaelis-Menten in forma di
grafico lineare
Grafico di Lineweaver – Burk:
υ0 =
υmax
⎛ KM ⎞
⎜1 + [S] ⎟
⎝
⎠
1
υ0
=
1
+
KM
υ max υ max
1
[S]
Un grafico di 1/υ0 in funzione di 1/[S] produce un retta con
una pendenza = KM/υmax e un valore all’origine = υmax-1
Conclusioni
(sull’equazione di Michaelis-Menten)
υ0 =
υmax
1
⎛ KM ⎞
⎜1 + [S] ⎟
⎝
⎠
υ0
=
1
+
KM
υ max υ max
1
[S]
I valori importanti :
(a) la costante catalitica kcat = k2 ;
(b) la costante di Michaelis KM → la stabilità di ES.
(c) υmax = kcat[E]0 = k2[E]0
Inibizione Competitiva
Inibitore (I): una sostanza con una struttura simile a
quella del substrato → occupa il sito attivo dell'enzima.
La costante di specificità : kspec = kcat/KM
Se si hanno due substrati A e B in competizione per lo
stesso sito attivo, il rapporto tra le velocità si ricava da :
υ A ( kspéc ) A [A]
=
υ B ( kspéc ) B [B]
Inibizione Competitiva
E+S
ES → E + P
E+I
EI
[E]0 = [E] + [ES] + [EI]
KI =
⎛ [I] ⎞
[E]0 = [E] ⎜1+ ⎟ + [ES]
⎝ KI ⎠
[E][I]
[EI]
Inibizione Competitiva
υo = k2 [ES]:
υ0 =
υmax
⎛ K'M ⎞
⎜1 +
⎟
[S]
⎝
⎠
⎛ [I] ⎞
K = K M ⎜1 +
⎟
K
I ⎠
⎝
'
M
La nuova costante K’M tiene conto
dell’influenza di I sulla cinetica enzimatica:
Quando [I] è grande o quando KI è piccola, la costante
K’M diventa più grande di KM → destabilizzazione del
complesso (ES) a seguito della presenza dell’inibitore.
Conclusioni Inibizione Competitiva
υmax non è influenzata dall’inibizione competitiva:
quando [S] >> [I] la maggioranza dei siti attivi è occupata
da S.
1
La concentrazione [S] che corrisponde a υ0 = υmax è più
2
alta a seguito della presenza dell’inibitore competitivo .
Inibizione competitiva:
υmax non varia
KM varia verso K’M
Inibizione Non-Competitiva
Un inibitore può legarsi in un punto diverso dal sito
attivo: il substrato S non è più in concorrenza con
l’inibitore I per lo stesso sito attivo.
Se una molecola di E è impegnata nella forma (EI)
essa diventa inattiva: υmax diminuisce in funzione
della percentuale dell’enzima che viene perso sotto
forma (EI).
Conclusione
La costante di Michaelis KM dipende dalla cinetica legata
al sito attivo : KM non sarebbe influenzato dall’influenza
di un inibitore non–competitivo.
Inibizione non–competitiva:
υmax varia
KM non varia
Inibizione competitiva:
υmax non varia
KM varia verso K’M
Catalisi Eterogenea
FASE 1
Condensata
FASE 2
Gassosa
zona di discontinuità : forti
interazioni tra particelle nella
fase condensata e con il gas
Adsorbimento : fenomeno di
concentrazione di particelle sulle
superfici di discontinuità tra fasi
condensate e gas (o liquidi) a
causa del campo generato dagli
atomi superficiali e non
compensato dall’altra fase.
ΔH°< 0 (esotermico)
ΔS°> 0 (ordinante)
Strato o strati di
molecole adsorbite
sulla superficie
Adsorbimento Fisico e Chimico
Adsorbimento fisico
Asorbimento chimico
Calore di ads. < 40 kJ mol-1
Non esiste Eatt. nel processo
Implica multistrati di adsorbato
Apprezzabile solo sotto b.p.
adsorbato
• La quantità di adsorbato è più
funzione dell’adsorbato che
dell’assorbente
• L’adsorbato aumenta ad ogni
aumento di pressione
dell’adsorbato in fase gas
• Calore di ads. > 80 kJ mol-1
• Si può avere Eatt. nel processo
• Implica al massimo uno strato di
adsorbato
• Può avvenire anche ad alte
Temperature
• La quantità di adsorbato è
caratteristica sia dell’adsorbente
che dell’adsorbato
• L’adsorbato diminuisce ad ogni
aumento di pressione
dell’adsorbato in fase gas
•
•
•
•
N
H
N
H
H
O
H
O
C
H
H
H
H
C
O
Area Superficiale, Matrici Catalitiche e
Catalizzatori
superficie esposta
particella con bassa area superficiale
Materiale compatto, cristalli formati
particella con alta area superficiale
Materiale molto poroso, da “gel”
Catalizzatori
Processi
• Gel di silice e allumina
• Gel di ossido di cromo, cromo
su allumina, nichel su allumina
• Acido fosforico su gel di silice
• Co, ThO2, MgO su gel di silice
• Ferro poroso
• Pentossido di vanadio
• Platino su carbone
• Al(C2H5)3 , TiCl4
• Cracking del petrolio (fraz. alte)
• Idrogenazione e deidrogenazione
di idrocarburi
• Polimerizzazione di alcheni (C=C)
• Sintesi di idrocarburi da CO e H2
• Sintesi dell’ammoniaca
• Processo a contatto per H2SO4
• Idrogenazioni, Isomerizzazioni
• Polimerizzazioni di olefine
Misure di Adsorbimento
Isoterma di adsorbimento
moli
gas
P, atm
termostato
P/Vads
Ipotesi : monostrato e uguale
velocità di evaporazione e di
condensazione sulla superficie.
La velocità di evaporazione è
proporzionale alla frazione di
superficie coperta
Diagramma di Langmuir
Teoria dell’Adsorbimento di Langmuir (1916)
Velocità di adsorbimento
rad = α p (1 − θ )
Velocità di desorbimento
rdes = α 'θ
p= pressione
θ = copertura
N
θ=
NM
Le velocità sono uguali all’equilibrio, con b = α'/ α
NM p
N=
b+ p
Isoterma di Langmuir
I. Langmuir, J. Am .Chem. Soc. 38 (1916) 2221
Il Metodo BET (1938)
¬ Isoterma BET- 1938 - Brunauer,
Emmett, Teller multistrati: 1°
strato chimiassorbimento, altri
fisiassorbimento.
(A)
nad/nm
P / P0
1
C −1 P
=
+
n(1 − P / P0 ) nmC nmC P0
(B)
¬ importante per misure di area
superficiali per fisiassorbimento
p/p0
He
N2
Dove
Gas Mixer
TCD
heated
Cold trap
Liquid nitrogen
P : Pressione parziale
P0 : Tensione di vapore
n : mole di gas adsorbito
nm : equivalente molare di un monostrato
Catalisi Eterogenea
reazione in fase gas
energia
Ea
E a‡
adsorbimento
ΔH
reazione
reazione catalitica
desassorbimento
Curva a Vulcano
T, K
Pt
Ru
Pd
400
Rh
Cu
a
HCOOH
Ir
Ag
H2 + CO2
Co
500
Fe
W
Au
600
60
80
100
120
-ΔHf formiato, kcal/eqiv.
Principio di Sabatier : curve a vulcano Tv/K. La temperatura a cui la velocità di
decomposizione dell’acido formico (asse verticale) assume un certo valore v, correlata con
il calore di formazione del formiato metallico, in kcal per equivalente (asse orizzontale).
Adsorbimento su Facce di Cristalli
Tecniche Cinetiche Veloci
(per analisi di intermedi di reazione)
•
•
•
•
•
•
Tecniche spettroscopiche fotoniche (IR) o magnetiche (ESR o NMR)
Tecniche a flusso
Fotolisi a lampo (multifotonica o laser)
Radiolisi pulsata (raggi g o X)
Tecniche di perturbazione dell’equilibrio (jump)
Tecniche elettrochimiche
Pulse Radiolysis
Lampo spettroscopico
γ 1 MeV
X
Cella di reazione
Flash photolysis
UV
visibile
10-5 s, 2000 J
Rivelatore
risoluzione temporale = 10-9 s
Reazioni Fotochimiche
a) - Reazioni fotoiniziate (moli prodotto > moli fotoni usati)
H2 + Cl2 f 2 HCl
ΔG°= - 95.26 kJ mol-1
reazione spontanea catena (pot. esplosiva)
b) - Reazioni fotochimiche (moli prodotto e moli fotoni usati)
Fotosintesi clorofilliana
n CO2 + n H2O + n hν f (CH2O)n + n O2 ; ΔG°= + 476.5 kJ mol-1 (n=1)
reazione non spontanea
Trasforma energia luminosa in energia chimica : prodotti (CH2O)n
zuccheri e O2 ossidante essenziale alla vita di piante ed animali.
Clorofilla : pigmento verde contenente magnesio che nel sistema
cloroplasto (antenne biologiche in grado di accumulare la luce) delle
piante verdi è in grado di effettuare tale conversione con una efficienza
del 92-95 %.
Reazioni Radicaliche a Catena
HH2 ++ Cl
Cl22 →
→ 22HCl
HCl
2
Iniziazione
Cl2 f 2
Propagazione
Cl•
Cl2
CI•
Ri
+ H2 f HCl +
H• + Cl2 f HCl + Cl•
H•
Terminazione H• + H• f H2
Cl• + Cl• f Cl2
H• + Cl• f Cl2
Cl
HCl
.
kCl
Cl2
H2
kH
.
H
HCl
kt
Terminazione (H2, Cl2, HCl)
In. :
hν (fotoiniziazione)
R-N=N-R (iniziazione termica)
Fe o Red. (iniziazione redox)
kt Å 109 M-1s-1
Cinetica Autossidazione di Idrocarburi (R-H)
A basse temperature i composti a legami C-H (idrocarburi) subiscono
l’attacco spontaneo da parte dell’ossigeno a dare soprattutto
idroperossidi con inserzione di O2 sul legame C-H.
R-H + O2 →
R-O-O-H
Meccanismo
O2
Iniziazione
In. f N2 + 2 f 2 I-O-O.
IOO. + R-H f IOOH + R.
Propagazione
R. + O2 f ROO.
ka Å 109 M-1s-1
ROO. + R-H f ROOH + R.
I.
Ri
kp
Terminazione
ROO. + ROO. f Prodotti non radicalici
kt
Scarica