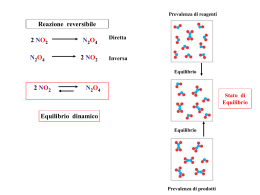
Programma svolto di Scienze Anno scolastico 2013-14 Classe 4^ F Docente: prof.ssa Eliana Bertocchi Libri di testo in adozione: “ Biologia ” Campbell – Reece – Taylor _ Simon _ Dickey – Ed. Linx “ Le idee della chimica ” – Valitutti – Tifi - Gentile - Ed. Zanichelli Ripasso dei prerequisiti di Chimica: massa atomica e molecolare, mole, numero di Avogadro; leggi dei gas; stechiometria, soluzioni; solubilità, concentrazione delle soluzioni. Reazioni di dissoluzione, di neutralizzazione e combustione. Esercizi. Velocità di reazione: velocità di reazione: significato teorico e rappresentazione grafica. Concetto di velocità media di reazione in relazione ad una specie chimica. Equazione cinetica di una reazione: ordine di una reazione. Reazioni di ordine zero, primo e secondo e relativa rappresentazione grafica. Fattori che influenzano la velocità di una reazione chimica ( natura dei reagenti, temperatura, concentrazione dei reagenti, superficie di contatto dei reagenti, presenza di catalizzatori ). Esercizi per la determinazione della velocità di reazione ( da dati sperimentali ). La teoria delle collisioni. L'energia di attivazione. Significato dell’equazione di Arrhenius. Meccanismo di reazione. Importanza dei catalizzatori / enzimi. Attività di laboratorio: velocità di una reazione chimica e fattori cha la condizionano ( temperatura, catalizzatore, concentrazione dei reagenti e superficie di contatto ) Attività di laboratorio: confronto tra azione di un catalizzatore inorganico e di un enzima. Equilibrio chimico: significato di equilibrio da un punto di vista macroscopico e microscopico. Costante di equilibrio (Keq) e legge dell'azione di massa. Significato del valore numerico della Keq. Determinazione per via sperimentale della Keq. Esercizi. Principio di Le Chatelier. Significato di quoziente di reazione per la determinazione della condizione di equilibrio. Esercizi. Equilibri in fase gassosa e in soluzione. Prodotto di solubilità e ionico. Esercizi. Attività di laboratorio: equilibrio chimico e verifica del principio di Le Chatelier. Equilibrio acido-base: definizione di acido e base secondo Boyle, Arrhenius, Bronsted-Lowry, Lewis. Equilibrio acido-base; costanti di acidità e di basicità. Acidi forti e deboli. ( Ka e Kb ) . Esercizi. Autoionizzazione dell’acqua e prodotto ionico dell'acqua. pH e pOH. Esercizi. Indicatori di pH. Titolazioni e reazioni di neutralizzazione ( acido forte/base forte; acido debole/base forte ). Esercizi. Idrolisi salina e soluzioni tampone. Esercizi. Prerequisiti necessari allo studio dell’anatomia umana: struttura della membrana cellulare , trasporti cellulari e flusso di massa Sistema digerente: Significato di nutrizione eterotrofa, di digestione e assorbimento Struttura di base del tubo digerente: mucosa, sottomucosa, tonaca muscolare e sierosa con relativa descrizione strutturale e funzionale Organi dell’apparato digerente: struttura e funzione. Funzione digestiva e/o di assorbimento nei vari organi Secreti dell’apparato digerente e relativa funzione. Ghiandole annesse al tubo digerente: ghiandole salivari, pancreas, fegato. Variazioni di pH nei vari tratti del tubo digerente Controllo da parte del sistema nervoso e degli ormoni sull’attività secretiva e sulla peristalsi Sistema circolatorio: flusso di massa nella circolazione sanguigna e possibilità di trasporto su grandi distanze Classificazione dei vasi sanguigni: differenze strutturali e funzionali tra arterie, arteriole, vene, capillari. Andamento della pressione sanguigna nei vasi sanguigni. Trasporti coinvolti nei vasi sanguigni: flusso di massa in arterie, arteriole, venule e vene; trasporti di diverso tipo nei capillari: diffusione, diffusione facilitata, esocitosi e osmosi, flusso di massa Anatomia del cuore e ciclo cardiaco. Genesi del battito cardiaco e sua propagazione nelle cellule del miocardio Flusso del sangue nel sistema circolatorio: circolazione sistemica e polmonare Regolazione da parte del sistema nervoso della frequenza del battito cardiaco e della pressione sanguigna mediante vasodilatazione e vasocostrizione in seguito a variazioni della pressione sanguigna Composizione del sangue : plasma e suoi componenti; processo emopoietico; globuli rossi ( struttura e funzione ), globuli bianchi ( funzione ), piastrine e processo di coagulazione Sistema respiratorio: Confronto tra i due trasporti coinvolti nell’apparto respiratorio: flusso di massa ( vie respiratorie ) e diffusione ( tra epitelio alveolare e capillari sanguigni ) Meccanica respiratoria: ruolo dei muscoli coinvolti sulla variazione di volume e dunque di pressione ( legge di Boyle ) Adattamenti strutturali e funzionali delle vie respiratorie e dei polmoni in relazione ai trasporti coinvolti Differente modalità di trasporto dell’ossigeno e dell’anidride carbonica da parte del sangue Descrizione del percorso seguito da una molecola di ossigeno introdotta con le vie respiratorie fino all’arrivo in una cellula per la respirazione cellulare e percorso inverso seguito dall’anidride carbonica Controllo della respirazione da parte del sistema nervoso: variazioni di frequenza respiratoria in seguito a variazioni di composizione del sangue ( concentrazione di ossigeno e anidride carbonica ) Sistema tampone del sangue Attività di laboratorio: dissezione cuore/polmone Lettura di approfondimento: “Le vicende di Serveto e Harvey- La scoperta della doppia circolazione” Lettura di approfondimento: “H.B.Taussing – I bambini blu” 04 giugno ’14 Firma insegnante Firma studenti Lavoro estivo – classe 4^ F Anno scolastico 2013/14 Tutti gli studenti devono svolgere il seguente lavoro: Leggere un libro a scelta tra quelli in elenco; produrre una relazione con un giudizio personale sulla lettura ( è espressamente richiesto un lavoro anche breve, purchè personale ). Non escludete di utilizzare la lettura per un eventuale approfondimento di tesina all’esame dell’anno prossimo …. dunque scegliete anche con questo possibile obiettivo Per gli studenti con sospensione di giudizio in Scienze: Ripassare tutti gli argomenti affrontati durante l’anno, rivedere le attività di laboratorio eseguite e gli esercizi svolti ( comprese le numerose schede di esercitazione fornite nel corso dell’anno ) Seguono su questo stesso file: Indicazioni di lavoro e alcuni esercizi da risolvere in preparazione alla verifica scritta del 30/08/14 e orale successivo Proposte libri da leggere e brevi recensioni ( per orientare la scelta ) / divise per argomenti A. Biologia …. significato di vita “La Scienza non ha bisogno di Dio” – E. Boncinelli – Ed. Rizzoli In questo saggio il genetista Edoardo Boncinelli si interroga sulle ripercussioni teologiche che scaturiscono dalle recenti scoperte scientifiche, con particolare riferimento alla scoperta del biologo statunitense Craig Venter, che nella primavera del 2010 ha annunciato al mondo intero che per la prima volta nella storia il suo team di ricerca è stato capace di costruire artificialmente in laboratorio una cellula in grado di dividersi. Da questa recente scoperta, Boncinelli si domanda se si può parlare di vita oppure no. Cercando una risposta nella sua vasta cultura scientifica, prova a fornire una definizione di ciò che dovrebbe essere considerato vita. Richiamando le scoperte scientifiche a riguardo, e facendo riferimento al volume dal titolo "Che cos'è la vita?", pubblicato nel 1944 dal premio Nobel per la fisica Edwin Schrödinger, Bonincelli cerca di fornire gli elementi per definire ciò che è naturale e ciò che è artificiale. Lo scienziato approfondisce anche tematiche relative al futuro della genetica e alle implicazioni di carattere etico, filosofico e religioso che si aprono di fronte ai progressi della scienza. Il volume fa riflettere molto e che pone degli interrogativi a cui è difficile poter dare una risposta univoca e completa. Il titolo dell’opera farebbe pensare ad altro …. in realtà penso che sia una lettura apprezzabile, scritta con un linguaggio fluido; è una sintesi interessante di contenuti di biologia, chimica e fisica finora studiati, che ruotano intorno al concetto di vita. B. Chimica “ Il sistema periodico ” – P. Levi – Einaudi Ed. Primo Levi, nella sua vita, è stato un chimico (laureato in chimica all’università di Torino). Tutti lo ricordano come l’ebreo che è sopravvissuto ad Aushcwitz in “Se questo è un uomo” pochi conoscono qual era la sua professione e di cosa si è occupato nella vita. Questo libro è una sorta di biografia, in cui l’autore ad ogni capitolo ha associato il nome di un elemento chimico. Per raccontare la sua vita utilizza degli episodi, aneddoti che gli sono capitati nell’ambito lavorativo e quindi nell’ambito della chimica. Il libro ha una struttura a cornice, e la cornice è appunto la chimica, con tutti i suoi elementi, chimica a cui Levi deve molto, infatti è grazie ad essa se si è salvato dalla strage degli ebrei durante la seconda guerra mondiale, lavorando come chimico al campo di concentramento di Auschwitz. Più o meno tutti i capitoli del libro riguardano situazioni di vita quotidiana o situazioni di lavoro nelle quali allo scrittore è capitato di dover avere a che fare con un determinato elemento, che appunto dà nome al capitolo. Come tradurre in letteratura contenuti complessi e apparentemente aridi che vengono dal mondo della chimica. E’ una lettura che viene generalmente apprezzata dagli alunni. “ Il cucchiaino scomparso e altre storie della tavola periodica degli elementi ” – Sam Kean – Ed. Adelphi Sempre sulla tavola periodica …. dietro ogni simbolo e ogni numero atomico si spalancano sequenze inimmaginabili in tutti gli ambiti dell'esperienza e della conoscenza umana. Punteggiato di sorprendenti aneddoti ( come quello, evocato nel titolo, del cucchiaino di gallio che si scioglie al contatto del tè, permettendo trucchi alla Houdini ) e digressioni narrative, il libro è un'introduzione alla conoscenza di ciò che costituisce il nostro pianeta. E’ di facile lettura, c’è però un errore ( che si ripete in tutto il libro ) di traduzione di un termine chimico … chi legge, lo trovi! C. Evoluzione “Evoluti e abbandonati. Sesso, politica, morale: Darwin spiega proprio tutto?” di T. Pievani – Ed. Einaudi Con uno stile narrativo brillante e avvalendosi di gustosi esempi tratti dalla letteratura scientifica e parascientifica, Evoluti e abbandonati getta le basi per un approccio che non consideri la mente umana come una «macchina di istinti» ossessionata soltanto da sesso, geni e competizione, ma come un «bricoleur» che, da sempre, si adatta all'imperfezione e all'imprevedibilità della nostra storia naturale e culturale. L'evoluzione continua, con i buoni vecchi mezzi di una volta, e con qualcuno nuovo. “La fine del mondo – Guida per apocalittici perplessi” di T. Pievani – Ed. Il Mulino La "catastrofe", intesa come resa dei conti finale con la storia, ci affascina da sempre perché soddisfa bisogni psicologici e vincoli cognitivi, magnificamente rappresentati dall'immaginario classico della fine del mondo interpretata come catarsi risolutiva, punizione, vendetta. Telmo Pievani ci accompagna in un viaggio fino alla fine del mondo guidandoci attraverso le parole chiave dell'attesa: apocalisse, disastro, nemesi, estinzione. Tra scienza, filosofia e letteratura, un messaggio di umiltà evoluzionistica e di accettazione della contingenza della vita sulla Terra, per decidere che cosa fare quando anche questa volta il mondo non sarà finito. D. Storia della Medicina “ La medicina non è una scienza ” - Giorgio Cosmacini – Cortina Raffello Ed. Qual è la definizione più adeguata di medicina? Possiamo parlare di una scienza medica, caratterizzata da un metodo specifico? Chi è medico? Quali sono i diritti e i doveri del medico e quali quelli del paziente? Che cosa intendiamo quando usiamo termini quali malattia e salute? Sono solo alcune delle domande che rivelano la complessa trama di temi epistemologici ed etici propria di quella forma di sapere nota come l'arte lunga, da sempre in bilico tra il rigore dei protocolli scientifici e la singolarità psicofisica del malato. Da Ippocrate a Galeno, da Georg Ernst Stahl a Claude Bernard, da Sigmund Freud e Karl Jaspers ai recenti dibattiti sul ragionamento in clinica, questo volume restituisce al lettore le pagine più significative della filosofia della medicina e dell'evoluzione del pensiero clinico-metodologico, affrontando i nodi concettuali attorno a cui "l'alleanza medico-paziente", stretta ufficialmente per la prima volta nel giuramento di Ippocrate, è andata sviluppandosi parallelamente alla crescita del sapere scientifico, delle moderne tecnologie e della consapevolezza dell'importanza delle istituzioni e delle strutture sanitarie. In ogni capitolo si stabilisce una connessione tra la medicina e una disciplina scientifica, per dimostrare che la medicina utilizza tutto quello che è stato scoperto nella storia della biologia, della fisica, della chimica, … come se tante scienze confluissero verso quella che fin dall’antichità veniva considerata non una scienza, ma “arte della cura”. E. Sistema nervoso “ So quel che fai – Il cervello che agisce e i neuroni specchio ” – G. Rizzolatti – C. Sinigaglia – Ed. Cortina Raffaello ( collana Scienza e idee ) Come comprendiamo le azioni degli altri? Negli ultimi anni sono le neuroscienze a offrire le risposte più convincenti. L'autore, neurofisiologo, ha scoperto un tipo particolare di cellule, i neuroni specchio, dotate della particolarità di attivarsi sia quando osserviamo un'azione sia quando la compiamo noi stessi. Trovano così spiegazione molti dei nostri comportamenti individuali e sociali, ma ciò comporta anche una trasformazione nel modo di intendere percezione, azione e cognizione, dato che lo studio dei neuroni specchio mostra che le aree del cervello deputate all'agire sono in grado anche di percepire e di conoscere. Neuroni specchio: argomento piuttosto nuovo e interessante …. “ Il cervello, la mente e l’anima ” - E. Boncinelli – Ed. Mondadori La psicologia cognitiva, le moderne scienze cognitive e il recentissimo campo di studi apertosi con le “neuroscienze” hanno profondamente mutato nella seconda metà del XX secolo il modo di analizzare il funzionamento del cervello e, più nello specifico, della mente. Con il suo libro Boncinelli mostra che uno studio della mente in termini di eventi neurali non solo è possibile, ma addirittura auspicabile, effettuando un lavoro sinergico fra campi di studio molto differenti: la biologia molecolare, la biofisica, la linguistica computazionale, la filosofia della mente, la filosofia del linguaggio e le scienze dell’informazione, inclusa la cibernetica. In alcune pagine riferimenti anche ai processi fisiologici che regolano il sonno …. Boncinelli è un autore facile da leggere, ha capacità comunicative molto efficaci, anche su argomenti non semplici F. Biotecnologie e bioetica “ L’etica della vita: siamo uomini o embrioni? ” E. Boncinelli – Ed. Rizzoli Quando si può parlare di essere umano? L'embrione è un individuo? Molte di queste domande hanno una risposta scientifica, altre rientrano negli ambiti civile e legale, etico e religioso. In questo libro, Edoardo Boncinelli descrive tutte le fasi dello sviluppo embrionale, dalla fecondazione alla nascita, attraverso la frenetica moltiplicazione delle cellule e la loro specializzazione. Ribadisce l'importanza scientifica della diagnosi pre-impianto e ci consegna un viaggio al microscopio nelle viscere dell'identità umana, raccontando l'inizio della vita di un uomo che non sa ancora di esserci. “ Il biologo furioso – Provocazioni tra scienza e politica ” – C. A. Redi – Ed. Sironi Carlo Alberto Redi, docente di Zoologia presso l’Università di Pavia e biologo di fama internazionale, non nasconde in questo vivace pamphlet tutta la propria indignazione verso una classe politica irresponsabile e scientificamente ignorante, non scusando però neppure i comuni cittadini che ancora nel XXI secolo – il secolo della Biologia – lasciano tutte le decisioni nelle mani di altri, senza informarsi adeguatamente e come se queste non li riguardassero. I problemi affrontati nei 16 brevi saggi sono tutti di grande attualità, dall’insufficienza dei fondi stanziati per la ricerca in Italia alle staminali, dagli OGM alla clonazione, dall’inizio della vita all’evoluzionismo…. Per gli alunni con sospensione di giudizio Alcuni spunti teorici su cui riflettere ( non si tratta di un elenco di contenuti – per quelli fare riferimento al programma svolto ) Riprendere le schede e gli Cinetica chimica Esistono 2 formule con cui calcolare la velocità di una reazione: quando si utilizza una formula e quando l’altra? / significato di k nell’equazione cinetica Lettura dei grafici concentrazione / tempo e ordine di reazione / quale informazione fornisce l’ordine di reazione? Grafico del profilo energetico di una reazione e sua interpretazione secondo la Teoria degli urti Significato di urto e di urto efficace / significato di energia di attivazione in una reazione chimica Fattori che condizionano la velocità di reazione / relazione catalizzatore e energia di attivazione Lettura del grafico pag. 427 / relazione tra T e k / relazione tra K ed Eatt Equilibrio dinamico Riflettere sul concetto di equilibrio / dinamico Informazioni che si ricavano dal valore di Keq Importanza del quoziente di reazione: quando è bene calcolarlo? Quale informazione si ricava nel confronto con Keq? Significato di equilibrio mobile / Pr. Le Chatelier / perturbazioni esterne che spostano l’equilibrio Confronto tra grandezze negli equilibrio di solublità: Kps / solubilità / prodotto delle concentrazioni ioniche 1. Vero / falso: giustifica in entrambi i casi. L’urto tra le molecole dei reagenti serve a raggiungere lo stato di transizione, necessario per rompere il legame tra gli atomi . L’affermazione è vera / falsa perché ….. E’ possibile che la velocità di una reazione sia indipendente dalla concentrazione dei reagenti. L’affermazione è vera / falsa perché ….. La reazione 2HI(g) → H2(g) + I2(g) è di secondo ordine: se si triplica la concentrazione di HI, la velocità diventa 6 volte maggiore. L’affermazione è vera / falsa perché ….. E’ impossibile modificare il valore di K di una reazione chimica. L’affermazione è vera / falsa perché ….. E’ possibile raggiungere l’equilibrio di una stessa reazione chimica, ad uguali condizioni di temperatura e pressione, ma con concentrazioni ( all’equilibrio ) di reagenti e prodotti differenti. L’affermazione è vera/ falsa perché …… Il catalizzatore abbassa l’energia di attivazione della reazione chimica. L’affermazione è vera/ falsa perché …… Non tutte le reazioni chimiche raggiungono una condizione di equilibrio. L’affermazione è vera/ falsa perché …… 2. Spiega l’importanza della conversione da energia cinetica in energia potenziale secondo la teoria degli urti. 3. In un esperimento si eseguono prove diverse e viene misurata la velocità della reazione 2CO(g) + O2(g) 2CO2(g) con i seguenti risultati: prove CO mol/L O2 mol/L Velocità mol/Lxs 1 0,02 0,02 3,68 x 10-5 2 0,04 0,02 1,47 x 10-4 3 0,02 0,04 7,36 x 10-5 K Calcola il valore di K. Scrivi l’equazione cinetica della reazione. Indica l’ordine complessivo della reazione. 4. Considera la seguente reazione: A → B + C Le misurazioni sperimentali si riferiscono alla concentrazione di A effettuata in istanti diversi dall’inizio della reazione: prova [A] tempo di reazione 1 0,024 0s 2 0,012 5s 3 0,006 10 s 4 0,003 15 s Fornisci un’interpretazione teorica dei dati sperimentali. E’ possibile risalire all’unità di misura di K? 5. A temperature elevate l’etano C2H6 si dissocia con una reazione del primo ordine. Se si racchiudono 1,2g di etano in un pallone da 500mL, a T= 700°C, quale sarà la velocità iniziale di decomposizione dell’idrocarburo, sapendo che a quella T la costante K vale 5,5x 10-4 s-1? 6. Descrivi le proprietà della reazione rappresentata: Si tratta di una reazione eso-endoenergetica? Individua graficamente il suo ∆H. E’ possibile stabilire il meccanismo della reazione : da quante reazioni elemntari sarà costituita? Quale sarà la fase che maggiormente condiziona la velocità della reazione? Motiva. 7. Analizza e commenta il grafico: come ti spieghi le due differenti curve? 8. In un pallone si mescolano 4 gas e si lascia che raggiungano l’equilibrio relativo alla reazione 4NH3(g) + 5O2(g) ↔ 4NO(g) + 6H2O(g) A questa miscela si impongono alcune perturbazioni, come indicato in tabella, ma la temperatura e il volume rimangono costanti. Completa la tabella. Cambiamento Come varia la … Aumento di pressione Quantità di NO Aggiunta di un catalizzatore Quantità di NH3 Aggiunta di NO Quantità di H2O Evaporazione di H2O Quantità di NO Aggiunta di NH3 Keq Aggiunta di NO Quantità di O2 Effetto ( aumento/ diminuzione/nullo ) 9. Trova il valore della Kp della reazione dell’esercizio 8, nel caso in cui si operi ad una temperatura di 360°C e la Kc valga 2,06 x 10-5. 10. A 460°C la seguente reazione ha Keq = 85,0 SO2 (g) + NO2 (g) ↔ NO (g) + SO3 (g) Un recipiente contiene alla data temperatura, i gas coinvolti nella reazione, con le seguenti concentrazioni: SO2 = 2,50 x 10-3 M NO2 = 3,50 x 10-3 M NO = 2,50 x 10-2 M SO3 = 4,0 x 10-2 M E’ possibile stabilire se il sistema si trova all’equilibrio? Se non lo è, in quale direzione deve procedere per raggiungere l’equilibrio? Rispondi senza poi eseguire i calcoli. 11. Data la reazione 2HBr (g) ↔ H2 (g) + Br2 (g) ad una data temperatura In un recipiente da 4L si parte da 2,00 mol di HBr, 3,2 moli di H 2 e Br2, e si raggiunge l’equilibrio ad una temperatura di 400°C, con una costante pari a 4. Calcola la concentrazione all’equilibrio delle specie coinvolte. 12. Il fluoruro di calcio ( CaF2 ), il componente principale del minerale fluorite, si discioglie nell’acqua, secondo una solubilità di 2,4 x 10 -4 mol/L a 20°C. Scrivi la reazione di dissoluzione e calcola la Kps del sale. Conoscendo la Kps ( = 9,8 x 10-9 ) di PbI2, è possibile confrontare la solubilità dei due sali, alla stessa temperatura? Rispondi brevemente senza svolgere calcoli. 13. Introducendo 1 mole di NH3 gassosa in un recipiente da 5L, mantenuto a 400°C, si trova che , quando la reazione 2NH3(g) ↔ N2(g) + 3H2(g) ha raggiunto l’equilibrio, le moli di azoto prodotte sono 0,086. Calcolare il valore di K c. 14. In un recipiente avviene la seguente reazione: N2(g) + 3H2(g) ↔ 2NH3(g) Ad una data temperatura si raggiunge la seguente composizione di equilibrio: [ NH3] = 0,150 M [ H2] = 0,575 M [N2] = 0,425 M Si modifica tale situazione di equilibrio aggiungendo: a) 0,025 M di H2 Come reagisce il sistema alla perturbazione? Trova le concentrazioni del nuovo equilibrio. 15. Si miscelano 2 soluzioni rispettivamente: 250mL di soluzione NaCl 0,015M 250mL di soluzione Pb(NO3)2 0,15M Sapendo che il valore di Kps di PbCl2 a 25°C è di 2,4 x 10-4 si vuole sapere se si otterrà precipitato di questo sale. Equilibri acido / base Riflettere sulla definizione di acido e base: perché nel tempo questa definizione è cambiata? Significato di acido / base relativa Equilibrio di auto ionizzazione dell’acqua / valore di Kw / giustificazione della scarsa conducibilità dell’acqua e della neutralità / Kw e suo valore in base alla temperatura Previsione sulle variazioni di pH quando si discioglie in acqua un acido, base, sale / comportamento acido - base forte/debole Importanza della misura del pH con scala logaritmica Individuare strategie corrette di risoluzione degli esercizi, partendo dal tipo di sostanza /e disciolta /e nell’acqua ( il riferimento è sempre l’autoionizzazione dell’acqua! ) Idrolisi salina: distinzione tra ioni spettatori in acqua e ioni che si comportano da acido / base rispetto all’acqua Distinzione tra titolazione e neutralizzazione Curva di titolazione durante le varie aggiunte / giustificazione della variazione di pH Lettura di grafici di titolazione in relazione alle aggiunte progressive 1. Completa i seguenti equilibri acido-base e stabilisci le coppie acido-base coniugate: H2SO4 + NH3 → HBr + OH- → H2O + H2O → 2. Crocetta tutte le affermazioni corrette che si riferiscono ad una soluzione acquosa con pH = 8,5: La H+ è uguale a OH- La H+ è uguale a zero. La H+ è minore a OH- Il prodotto H+ x OH- è uguale a 1 x 10-14 Il prodotto H+ x OH- è uguale a quello dell’acqua distillata Il pOH è uguale a 8,5 3. Calcola il pH di una soluzione ottenuta mescolando 50,0 mL di NaOH 0,200M e 25,0 mL di HCl 0,200M. Scrivi la reazione di neutralizzazione. 4. Calcola il pH di una soluzione acquosa 0,1 M di un acido con Ka = 1,3 x 10 -10. Cambierebbe se la stessa concentrazione riguardasse HCl? Motiva. 5. Una soluzione di HCl ha pH = 2,4. Calcola il volume della soluzione sapendo che contiene 0,252 g di HCl. 6. Per titolare 20 mL di NaOH sono stati necessari 35 mL di HCl 0,1M. Calcola la concentrazione molare dell’NaOH. 7. Fornisci una definizione di soluzione tampone e fai un esempio specifico. 8. Indica ( attraverso crocette ) rispettivamente i sali che in acqua daranno soluzioni con pH acido, neutro e basico. Formula del sale pH acido pH neutro pH basico Fe(ClO3)2 KBr Na2SO4 NH4Cl LiBrO 9. Osserva il grafico e descrivilo, indicando da quale tipo di acido si parte, specificando se si verifica completa dissociazione dell’acido e motivando il valore di pH. Anatomia Stabilire sempre una relazione tra descrizione strutturale / funzionale a qualunque livello organizzativo ( organo, tessuto, cellula, molecola ) Fare riferimento ai trasporti coinvolti nelle varie funzioni svolte dagli organi ( diffusione, diffusione facilitata, trasporto attivo, flusso di massa ) Dimostrare il ruolo di controllo del sistema nervoso sulla fisiologia dei vari apparati ( mantenimento dell’omeostasi ) Lettura e descrizione di grafici ( saturazione emoglobina / pressione sanguigna … ) Lettura e descrizioni di immagini 1. Digestione e assorbimento: quali organi adibiti ad una o all’altra funzione? 2. Significato della peristalsi nei vari organi dell’apparato digerente. Se cambia la forma dell’organo, cambia la funzione della peristalsi? 3. Differenza strutturale tra villi e microvilli. Perché sono tipici dell’intestino tenue? 4. Descrizione della composizione dei vari secreti prodotti negli organi del tubo digerente. Tutti i secreti contengono enzimi e dunque intervengono nella digestione chimica? 5. Enzimi che intervengono della digestione: quali? Quale funzione? Perché varia il pH nei vari organi del tubo digerente? 6. Importanza della ghiandole annesse al tubo digerente: quali secreti? Fegato: ghiandola annessa al tubo digerente con funzioni molteplici. 7. Assorbimento dei singoli monomeri della digestione: dove avviene? Con quali trasporti? Dove finiscono i monomeri assorbiti? 8. Controllo della funzione digestiva ad opera del sistema nervoso e ormonale. 9. Confronto tra flusso di massa e diffusione. Strutture del sistema respiratorio adibite ai due trasporti. 10. Meccanismi di difesa nei confronti della non selettività del flusso di aria nelle vie respiratorie. 11. Adattamenti degli alveoli al trasporto di diffusione. 12. Ruolo dei muscoli nella meccanica respiratoria. 13. Differenza tra trasporto di ossigeno e anidride carbonica nel sangue. Perché la necessità di cellule e pigmento per l’emoglobina? Come avviene la saturazione di ossigeno dell’emoglobina? 14. Funzione del sistema respiratorio nel mantenere il pH del sangue costante: sistema tampone H 2CO3 / HCO3- 15. Meccanismo di regolazione della respirazione: quali stimoli intervengono? Dove si trovano i recettori? Quale è la risposta? 16. Flusso di massa nel sangue: quale è la direzione? Cosa trasporta? Significato funzionale degli elementi corpuscolati del sangue. 17. Vasi sanguigni e flusso di massa: quali analogie strutturali? Quali differenze? Capillari e scambi di sostanze: caratteristiche strutturali e funzionali ( differenze con gli altri vasi ). 18. Significato di circolazione sistemica e polmonare. 19. Flusso del sangue nelle cavità cardiache e ciclo cardiaco ( diastole / sistole ). 20. Andamento della pressione sanguigna nei vari distretti della circolazione: perché differenza tra cuore destro/ sinistro? Tra arterie / arteriole / … vene? Tra circolazione polmonare / sistemica? 21. Differenza tra genesi del battito cardiaco ( pacemaker ) e controllo della frequenza cardiaca e pressione sanguigna da parte del sistema nervoso.
Scaricare