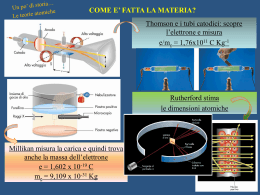
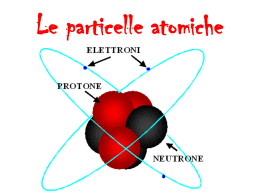
L’ ATOMO DI IDROGENO vedi per es. un qualsiasi testo di istituzioni di fisica teorica o struttura della materia L’ atomo di idrogeno è un sistema costituito da due particelle (elettrone e protone) soggette ad un potenziale di interazione colombiano. L’hamiltoniana dell’atomo di idrogeno, nella rappresentazione delle coordinate cartesiane è: h2 2 h2 r r Hˆ = − ∇1 − ∇ 22 + V (r1 − r2 ) 2m1 2m2 r r dove m1 è riferito al protone, m2 all’ elettrone e V ( r1 − r2 ) il potenziale colombiano. Il potenziale dipende solo dalla distanza, quindi è invariante per traslazioni e rotazioni. Risulta conveniente passare alle coordinate del centro di massa. Definiamo: x = x1 − x2 r r r r = r1 − r2 ⇒ (1) y = y1 − y2 z = z − z 1 2 m1 x1 + m2 x2 X = M r m1 rr1 + m2 rr2 m1 y1 + m2 y2 R= ⇒ Y = M m1 + m2 m z 1 1 + m2 z 2 Z = M Nella (2) M= m1 + m2 è la massa totale del sistema. Si ha: (2) ∂ ∂ ∂x ∂ ∂X ∂ m ∂ = + = + 1 ∂x1 ∂x ∂x1 ∂X ∂x1 ∂x M ∂X 2 ∂ ∂2 m1 ∂ ∂ m1 ∂ ∂ 2 m1 ∂ ∂ m1 ∂ 2 = + ⋅ + = +2 + ⋅ . M ∂x ∂X M ∂X 2 ∂x1 2 ∂x M ∂X ∂x M ∂X ∂x 2 ∂2 ∂2 ∂2 ∂2 ∂2 Analogamente si calcolano i termini , ; , , . ∂y1 2 ∂z1 2 ∂x 2 2 ∂y 2 2 ∂z 2 2 Sostituendo nell’ hamiltoniana troviamo Ĥ nelle coordinate del centro di massa: h 2 ∂ 2 ∂2 ∂ 2 h2 ∂ 2 ∂2 ∂2 ˆ (3) H =− + + + V (x , y , z ) − + + 2 µ ∂x 2 ∂y 2 ∂z 2 2M ∂X 2 ∂Y 2 Z 2 mm dove µ = 1 2 è la massa ridotta del sistema. m1 + m2 La (3) può essere pensata come la somma di due hamiltoniane indipendenti. La prima è h 2 ∂ 2 ∂2 ∂ 2 − + + + V ( x, y , z2 ) ; è l’ hamiltoniana di una particella di massa ì che si muove 2 µ ∂x 2 ∂y 2 ∂z 2 nel potenziale colombiano V(x,y,z); è l’hamiltoniana del cosiddetto moto relativo attorno al centro h2 ∂2 ∂2 ∂2 ; si riferisce al centro di massa ed è l’hamiltoniana di massa. La seconda è − + + 2 M ∂X 2 ∂Y 2 Z 2 1 di una particella libera. Il centro di massa dell’ atomo di idrogeno si comporta dunque come un sistema isolato. La funzione d’onda totale è dunque il prodotto della funzione d’onda del centro do massa e della i r r P ⋅R h i r r P⋅ R h funzione d’onda del moto relativo: ψ = ψBψrel = ce ψrel ; dove ψB = ce è la funzione d’onda r di una particella libera ( P è l’impulso totale, c è una costante di normalizzazione). Per trovare la funzione d’onda del moto relativo, che indichiamo con ø(x,y,z), risolviamo la sua equazione di Schrödinger: h2 2 ∇ ψ( x, y , z ) + V ( x, y, z )ψ(x , y , z ) = Eψ( x, y, z ) (4) 2µ e2 Nella (4) V(x,y,z) è il potenziale − se il sistema è un atomo di idrogeno, x2 + y 2 + z 2 − − Ze 2 se il sistema è un atomo idrogenoide, cioè un atomo costituito da Z protoni ed un x2 + y2 + z 2 elettrone. E’ conveniente, per risolvere l’ equazione, passare in coordinate polari sferiche; si può dimostrare che in tali coordinate l’ operatore ∇ 2 acquista la forma: 1 ∂ 2 ∂ 1 ∂2 1 ∂ ∂ r − − 2 senθ 2 2 2 2 r ∂r ∂r r sen θ ∂φ r senθ ∂θ ∂θ e2 Mentre il potenziale si scrive semplicemente V (r ) = − (nel sistema cgs). r In questo modo vediamo che è possibile effettuare una separazione delle variabili, ciò ci permette di trovare soluzioni del tipo: ψ(r ,θ ,φ ) = R (r )Θ(θ )Φ (φ) (5). Mostriamo che esistono soluzioni dell’ equazione: h2 2 − ∇ ψ(r ,θ ,φ ) + V (r )ψ( x, y, z ) = Eψ(r ,θ ,φ ) (6) 2µ che si separano nel prodotto di tre funzioni, ciascuna delle quali dipende da solo una delle coordinate, sostituendo la (6) nella (5) scritta con ∇ 2 in coordinate polari: ∇2 = − h 2 1 ∂ 2 ∂RΘΦ 1 ∂ 2 RΘΦ 1 ∂ ∂RΘΦ − − 2 r + 2 sen θ + V (r )RΘΦ = ERΘΦ ⇒ 2 2 2 2µ r ∂r ∂r r sen θ ∂φ r senθ ∂θ ∂θ h 2 ΘΦ ∂ 2 ∂R RΘ ∂ 2 Φ RΦ ∂ ∂Θ − − 2 r + 2 senθ + V (r )RΘΦ = ERΘΦ . 2 2 2 2µ r ∂r ∂r r sen θ ∂φ r senθ ∂θ ∂θ Moltiplichiamo per − 2 µr 2 sen 2θ ottenendo: h 2 RΘΦ 1 d 2Φ sen 2θ d 2 dR senθ d dΘ 2µ 2 2 = − r sen θ[E − V (r )] r − senθ − 2 Φ dφ R dr dr Θ dθ dθ h 2 2 Osserviamo che al primo membro abbiamo una funzione solo di φ ed al secondo membro una funzione solo di r e è. L’ uguaglianza delle due funzioni implica che esse siano entrambe uguali ad una costante, che indichiamo con –m2 . Si ha dunque: 1 d 2Φ = −m 2 2 Φ dφ − (7) 1 d 2 dR 1 d dΘ 2µ 2 m2 r − sen θ − r [ E − V ( r ) ] = − R dr dr Θsen θ dθ dθ h 2 sen 2θ (8) Dalla (7) si ricava: Φ = Ae imφ (9) Dove A è una costante di normalizzazione. Poiché deve essere Φ (φ) = Φ (φ + 2π ) , m deve essere un intero positivo o negativo. Risolviamo adesso la (8): 1 d 2 dR 2 µ 2 m2 1 d dΘ r + r [ E − V ( r ) ] = − senθ . 2 2 R dr dr h sen θ Θsenθ dθ dθ Come prima, osserviamo che al primo membro abbiamo una funzione solo di r ed al secondo una funzione solo di è. L’uguaglianza tra le due funzione implica ancora una volta che esse siano entrambe uguali ad una certa costante, che indichiamo con l(l+1). Si ha dunque: m2 1 d dΘ − senθ = l (l + 1)Θ 2 sen θ Θsenθ dθ dθ 1 d 2 dR 2 µ R r + 2 [E − V (r )]R = l (l + 1) 2 2 r dr dr h r (10) (11) Abbiamo già risolto l’ equazione (10) per trovare gli autovalori del momento angolare, pertanto riconosciamo nel prodotto di è e Ö le autofunzioni di L2 ed Lz, cioè le armoniche sferiche, m ed l sono, appunto, i loro numeri quantici. 1 d 2 dR 1 d 2 Prendiamo ora in considerazione la R(r); è facile dimostrare che r = ( rR ) ed r 2 dr dr r dr 2 essendo per il sistema protone elettrone µ ≈ me dalla (11) otteniamo: h2 1 d 2 dR h2 l ( l + 1) R e2 − r + = E + R 2me r2 dr dr 2m e r2 r h 2 d 2 l ( l + 1) h 2 e 2 + − rR = ErR − 2 2me r 2 r 2me dr e, ponendo u = rR , otteniamo infine: h 2 d 2 l ( l + 1) h 2 e 2 + − u = Eu (12) − 2 2me r 2 r 2me dr Riscriviamo l’ equazione (12) facendo le seguenti posizioni: 3 r = a0 ρ con a0 = h2 m0 e 4 e2 = 0,053 nm , raggio di Bohr; E = E ε ,con E = = = 13,6 eV , R R me e2 2 h2 2 a0 energia di Rydberg. Sostituendo: − d 2u l ( l + 1) 2 + u − u = εu 2 2 dρ ρ ρ (13) l ( l + 1) 2 . ρ ρ Esso è la somma di due termini, uno attrattivo dovuto all’ interazione colombiana, l’altro repulsivo centrifugo; quest’ ultimo nasce dal fatto che ci siamo messi nel sistema di riferimento del centro di massa, attorno al quale il sistema ruota. Possiamo allora distinguere due casi: l = 0 ed l ≠ 0 , poiché Veff cambia notevolmente: La (13) è l’ equazione del moto per una particella in un potenziale efficace Veff = 2 − Cerchiamo gli stati legati del sistema, essi si avranno per valori di energia negativi. d 2u Se ρ → ∞ la (13) è approssimata dall’ equazione − = εu , che ha per soluzione una funzione d ρ2 l ( l + 1) 2 del tipo u ( ρ) = e− b ρ , con ε = − b2 < 0 . Per ρ → 0 , possiamo trascurare rispetto a ed ρ ρ2 anche εu è trascurabile in quanto u deve mantenere un valore finito dappertutto, ed in particolare nell’ origine. La (13) è perciò approssimata dalla: d 2u l ( l + 1) = u, d ρ2 ρ2 la quale ammette soluzioni del tipo u ( ρ) = ρ−l , u ( ρ) = ρl +1 , la prima delle quali non è però fisicamente accettabile perché così la u divergerebbe all’infinito. Una soluzione della (13) che tiene conto del giusto comportamento all’ origine ed all’infinito è dunque: u ( ρ) = ρl +1e− b ρ (14). Ricordando che u ( ρ) = e− b ρ , otteniamo R ( ρ) = diversi andamenti per l = 0 ed l ≠ 0 . 4 u ( ρ) ρ = ρl e− b ρ , possiamo quindi notare i due 2 , cioè nel caso ρ di un potenziale efficace puramente colombiano. Notiamo che R ( 0 ) = 1 , e dunque è non nulla l’ ampiezza di probabilità di trovare l’ elettrone ad r = 0 . Gli stati caratterizzati dall’ avere l=0 sono gli stati a simmetria sferica( perché le funzione soluzioni della (4.40) sono indipendenti da θ e φ), e sono chiamati stati s. Questo risultato vale però nell’ approssimazione che il nucleo sia considerato 1 puntiforme, perché altrimenti il potenziale non avrebbe l’ andamento . r Nel caso in cui sia l = 0 invece l’ ampiezza di probabilità di trovare l’ elettrone al nucleo è nulla. Per l = 0 otteniamo u ( ρ) = e− b ρ , essa è la soluzione della (13) nel caso di Veff = − Sostituiamo la soluzione (14) nell’ equazione (13), si trova: l ( l + 1) l +1 −b ρ 2 l +1 − bρ d2 ρl +1e −b ρ + ρ e − ρ e = ερl +1e −b ρ ⇒ 2 dρ ρ2 ρ l −1 −b ρ l −b ρ l −b ρ 2 l +1 −b ρ −l ( l + 1) ρ e + b ( l + 1) ρ e + b ( l + 1) ρ e − b ρ e + l ( l + 1) ρl −1e −b ρ − 2 ρl e − b ρ = ερl +1 e −b ρ ⇒ ( ) 2b ( l + 1) − 2 ρl = ( ε + b 2 ) ρl +1 . Osservando che ε = −b2 la precedente relazione diventa : 2 b ( l + 1) − 1 ρ = 0 ∀ρ , da cui infine otteniamo: b= 1 . l +1 In corrispondenza, si trova il valore di energia: E=− ER ( l + 1) 2 =− 13,6 ( l + 1) 2 eV . Tutte le altre soluzioni della (13) si ottengono moltiplicando la (14) per polinomi di grado finito in ρ a segni alterni: 1 13,6 u2 ( ρ) = ρl +1e − b2 ρ ( c0 − c1 ρ ) ⇒ b2 = ⇒ E2 = − eV 2 l+2 (l + 2) ( ) u3 ( ρ) = ρl +1 e− b3 ρ c0 − c1 ρ + c2 ρ2 ⇒ b3 = 1 13,6 ⇒ E3 = − eV . 2 l +3 ( l + 3) Osserviamo che, fissato l’ intero l , i possibili valori dell’ energia possono essere espressi come: 13,6 En = − 2 eV n dove n è l’ intero n = l + 1; l + 2; l + 3;... Notiamo che, fissato n , fissata cioè l’ energia, si trovano n valori distinti di l (tutti gli interi compresi tra 0 ed n − 1 ) per i quali si hanno stati degeneri. IL potenziale efficace dipende da l . So dimostra che esso ha un minimo che sale e si sposta verso destra all’ aumentare dil . Infatti: 2l ( l + 1) 2 l ( l + 1) d Veff = − + 2 =0⇒− = −1 ⇒ ρmin = l ( l + 1) da cui: 3 dρ ρ ρ ρ 1 1 Vmin = − <− = El +1 2 l ( l + 1) ( l + 1) 5 Fissato n possiamo vedere dal grafico i possibili valori del momento angolare orbitale l considerando le intersezioni tra le energie totali En e i potenziali efficaci Veff : n = 1; l = 0 n = 2; l = 1,0 n = 3; l = 2,1,0 e così via. Riassumendo, le autofunzioni dell’ hamiltoniana dell’ atomo di idrogeno sono individuate dai tre numeri quantici m, l , n i quali possono assumere i seguenti valori: n = 1,2,3,... l = 0,1,2,..., n − 1 m = −l ,− l + 1;...,0,..., l − 1, l Per un fissato valore di n , dunque, ci sono n valori distinti di l ai quali corrisponde lo stesso valore di energia; fissato l ci sono poi 2l + 1 valori di m ai quali corrisponde ancora lo stesso valore di energia. La degenerazione totale del livello n-esimo è dunque: n −1 n −1 n −1 n ( n − 1) 2 l + 1 = 2 l + n = 2 l + n =2 + n = n2 . ( ) ∑ ∑ ∑ 2 l= 0 l= 0 l =1 In effetti, tenendo conto del numero quantico di spin, la degenerazione è 2n 2 . Per individuare lo stato dell’ elettrone si definiscono quattro numeri quantici che sono valori associati a certe grandezze che caratterizzano il sistema: n=numero quantico principale (energia) l=numero quantico azimutale (momento angolare orbitale) m= numero quantico magnetico (proiezione del momento angolare) m s = numero quantico di spin 6 La degenerazione è il risultato di certe proprietà della funzione energia potenziale che descrive il sistema. La degenerazione rispetto ad m nasce perché il potenziale dipende solo dalla coordinata r, cosicché esso è a simmetria sferica e l’ energia totale dell’ atomo è indipendente dalla sua orientazione nello spazio. La degenerazione rispetto ad l è una conseguenza della particolare di pendenza da r del potenziale colombiano, essa viene rimossa, cioè l’energia dei livelli dipende cost anche da l , quando il potenziale non è più del tipo − , pur restando a simmetria sferica. La r degenerazione rispetto ad m può essere invece rimossa solo sovrapponendo al potenziale coulombiamo un potenziale non caratterizzato da simmetria sferica. n − l −1 u ( ρ) i Esaminiamo per l’atomo di idrogeno le funzioni radiali Rl , n ( ρ ) = l , n = ρl e− b ρ ∑ ( −1) ci ρi al ρ i =0 variare di n ed l. Il comportamento di R ( ρ) nell’ origine è diverso nei due casi l = 0 ed l ≠ 0 .Abbiamo già osservato che nel primo caso è diversa da zero l’ ampiezza di probabilità di trovare l’ elettrone a ρ = 0 , mentre essa è nulla nel secondo caso. In prossimità dell’ origine l’ ampiezza di probabilità Rl , n diminuisce al crescere di l coerentemente con il fatto che la forza centrifuga allontana dall’ origine. 7 Definiamo la densità di probabilità radiale P ( r ) in modo che P ( r ) dr sia la probabilità di trovare l’ elettrone in un punto di coordinata radiale compresa tra r ed r + dr integrata sulla corrispondente 2 superficie sferica, cioè: Pn , l ( r ) dr = 4πr 2 Rl , n ( r ) dr , dove i pedici l ed n indicano che la densità di probabilità dipende da tali numeri quantici. Riportiamo ora la distribuzione della densità di probabilità dell’ elettrone 4πr 2 Rl , n ( r ) 2 per alcuni valori dei numeri quantici n ed l. Poiché ci riferiamo ad un sistema idrogenoide di numero atomico Z e poiché all’ aumentare di Z l’ elettrone si avvicina al nucleo, teniamo conto di questo fatto r moltiplicando per Z. Le curve risultano essere: a0 Osserviamo che il numero dei nodi è n − l − 1 . 8
Scaricare