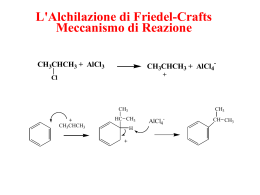
Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl Soluzioni ai problemi proposti nel libro Capitolo 1 6 16.1 Gli elettroni π del benzene sono delocalizzati sui sei atomi dell’anello, aumentando la stabilità del benzene e risultando meno disponibili per la donazione elettronica. In un alchene, i due elettroni π sono localizzati tra i due atomi di C, che risultano più nucleofili e quindi più reattivi con un elettrofilo rispetto agli elettroni delocalizzati nel benzene. 16.2 Quando si disegnano le strutture di risonanza, la carica è sempre posizionata in orto o para ad uno degli atomi dell'anello ibridati sp3. H Cl H Cl + a. + H NO2 H Cl + H NO2 H NO2 + b. + + 16.4 H E E B + + H E E B 16.5 L'addizione di Cl2 con FeCl3 come catalizzatore avviene in due parti. La prima è la formazione di un elettrofilo, seguita da una reazione di sostituzione in due stadi. + [1] Cl Cl + FeCl3 Lewis base Lewis acid H [2] Cl electrophile H Cl + Cl Cl FeCl3 Cl FeCl3 H Cl H Cl FeCl4 resonance-stabilized carbocation [3] H Cl Cl FeCl3 Cl + HCl + FeCl3 16.6 Nel meccanismo ci sono due parti. La prima parte è la formazione di un elettrofilo. La seconda parte è una reazione di sostituzione in due stadi. Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl O O [1] S O O + H OSO3H S = O + O H + + SO3H HSO4– electrophile H SO3H H + [2] SO3H H SO3H H SO3H resonance-stabilized carbocation H SO3H [3] HSO4– SO3H + H2SO4 16.7 L'alchilazione di Friedel–Crafts consiste nel trasferimento di un gruppo alchilico da un alogeno all'anello benzenico. Nell'acilazione di Friedel–Crafts un gruppo acilico è trasferito da un alogeno all'anello benzenico. CH(CH3)2 a. (CH3)2CHCl + O O AlCl3 c. + CH3CH2 C C Cl AlCl3 Cl b. CH2CH3 + AlCl3 16.8 Ricordare che un gruppo acilico è trasferito da un atomo di Cl all'anello benzenico. Per disegnare il cloruro acilico, sostituire un Cl all'anello del benzene. O C a. O O C b. Cl CH2CH2CH(CH3)2 O Cl C C CH2CH2CH(CH3)2 c. O O C C Cl Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl 16.9 + [1] CH3CH2 Cl + CH3CH2 AlCl3 _ Cl AlCl3 electrophile H [2] + CH3CH2 H CH2CH3 _ H CH2CH3 H CH2CH3 Cl AlCl3 + resonance-stabilized carbocation AlCl4– _ H CH2CH3 [3] Cl AlCl3 CH2CH3 + HCl + AlCl3 16.10 Per reagire in una reazione di alchilazione di Friedel–Crafts, X deve essere legato ad un atomo di carbonio ibridato sp3. Br a. sp2 unreactive Br Br b. c. sp3 reactive sp2 Br d. unreactive sp3 reactive 16.11 Sia gli alcheni che gli alcoli possono formare carbocationi per le reazioni di alchilazione di Friedel– Crafts. a. + b. + OH H2SO4 c. C(CH3)3 H2SO4 (CH3)2C CH2 H2SO4 + OH d. H2SO4 + 16.12 Cl Cl O Al Cl O Cl [1] H H O AlCl4– + O H [2] _ H O Cl AlCl3 [3] 16.13 L'OH è orto, para orientante. O + HCl + AlCl3 O H O Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl OH OH OH HNO3 a. OH OH NO2 Cl Cl2 g. H2SO4 Cl FeCl3 NO2 OH OH OH h. (+ ortho isomer) H2SO4 OH OH NH2 OH OH OH AlCl3 (+ ortho isomer) O C (CH3CH2)2CHCOCl d. C O OH (+ ortho isomer) HCl NO2 i. OH Sn SO3H CH3CH2Cl c. OH SO3H SO3 b. Cl OH (+ ortho isomer) HCl CH2CH(CH2CH3)2 CH(CH2CH3)2 OH OH CH(CH2CH3)2 AlCl3 Zn(Hg) (+ ortho isomer) j. NH2NH2 (+ ortho isomer) OH OH O C CH2CH(CH2CH3)2 CH(CH2CH3)2 OH O C CH(CH2CH3)2 OH Br Br2 e. (+ ortho isomer) hν Br Br FeBr3 OH OH OH OH Br l. Br Br2 f. Br2 (+ ortho isomer) k. OH OH OH (+ ortho isomer) KMnO4 (+ ortho isomer) O C OH Br 16.14 CN è meta orientante che disattiva l'anello del benzene. CN CN CN SO3 Br2 a. c. FeBr3 CN CN SO3H CN CN H2SO4 H2SO4 Br d. NO2 CH3COCl e. CH3CH2CH2Cl HNO3 b. CN AlCl3 No reaction AlCl3 No reaction Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl 16.15 CH(CH3)2 CH3CH2COCl a. CH(CH3)2 AlCl3 C O CH3CH2 CH2CH3 O C O CH3CH2COCl C b. CH(CH3)2 + CH(CH3)2 N(CH3)2 no reaction AlCl3 CH3CH2COCl c. no reaction AlCl3 Br Br Br CH3CH2COCl d. AlCl3 CH2CH3 C O NH e. C CH3 C O COCH2CH3 NH CH3CH2COCl O CH3CH2 C O AlCl3 NH CH3 + CH3CH2 C O 16.16 NO2 HNO3 a. NO2 HO CH3 b. O2N NO2 H2SO4 SO3 NO2 CH3 OH H2SO4 OH HO HO CH3 HO3S OH SO3H CH2CH3 c. Cl OCOCH3 CHO d. CH3 CH3CH2Cl AlCl3 Cl CHO Br2 FeBr3 OCOCH3 Br CHO CH3 CH3 Br COCH3 e. CH3OCO NHCOCH3 CH3COCl AlCl3 CH3OCO NHCOCH3 C O CH3 Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl O2N NO2 f. NO2 NO2 HNO3 H2SO4 NO2 NO2 NO2 Cl g. Cl2 COOCH3 CH3O OCH3 Br COOCH3 CH3O FeCl3 Br SO3 h. O2N OCH3 Br SO3H HO3S H2SO4 OCH3 16.17 Tenere conto dei riarrangiamenti. a. Cl b. c. Cl d. Cl Cl 2° carbocation rearrangement 3° carbocation rearrangement 16.18 O O O Cl Cl OCH3 AlCl3 A OCH3 16.19 a. CH3 C(CH3)3 KMnO4 C(CH3)3 HOOC Br Br2 b. hν CH3 Zn(Hg)/HCl c. C CH3 CH2CH2CH3 C H H O d. CH2CH2CH3 Br2 FeBr3 Br Br AlCl3 OCH3 Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl O NH2NH2 e. –OH OCH2CH3 f. Br Br2 OCH2CH3 FeBr3 Br Br 16.20 C bonded to 2 H's must use acylation followed by reduction O O Cl Zn(Hg) a. AlCl3 HCl C bonded to 1H can be added directly by alkylation Cl b. AlCl3 O O CH2CH3 C Cl c. C CH3 AlCl3 Ethyl group can be introduced by two methods. CH2CH3 CH3 Zn(Hg) CH3CH2Cl HCl AlCl3 Method [1] Method [2] 16.21 SO3H a. SO3H 1) CH3COCl/AlCl3 2) Cl2/FeCl3 Step [1] won't work because a Friedel–Crafts reaction = A can't be done on a deactivated benzene ring, as is the Cl O case with the SO3H substituent. Even if Step [1] did work, the second step would introduce Cl meta to SO3H, not para as drawn. CH3 Alternate synthesis: FeCl3 Cl AlCl3 SO3H SO3 CH3COCl Cl2 H2SO4 Cl O CH3 (+ para isomer) (+ isomer) Cl O CH3 Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl Step [1] involves a Friedel–Crafts alkylation o = B using a 1 alkyl halide that will undergo rearrangement, so that a butyl group will not be NO2 introduced as a side chain. OCH3 [1] CH3CH2CH2CH2Cl /AlCl3 b. [2] HNO3/H2SO4 OCH3 CH3CH2CH2CH2 Alternate synthesis: OH OCH3 [1] NaH OCH3 CH3(CH2)2COCl AlCl3 [2] CH3Cl (+ ortho isomer) CH3CH2CH2 O OCH3 (+ isomer) CH3CH2CH2CH2 NO2 Zn(Hg)/HCl OCH3 HNO3 H2SO4 CH3CH2CH2CH2 B 16.22 a. b. CH2CH2CH2CH3 alkyl group electron donating c. OCH2CH3 electronegative O electron withdrawing Br halide electron withdrawing 16.23 I gruppi elettron donatori posizionano una carica negativa sull'anello del benzene. Disegnare le strutture di risonanza per mostrare come –OCH3 posiziona una carica negativa sull'anello. I gruppi elettron attrattori collocano una carica positiva sul benzene. Disegnare le strutture di risonanza per mostrare come –COCH3 posiziona una carica positiva sull'anello. O a. b. O CH3 O CH3 O O O C C C CH3 CH3 O O C C CH3 O CH3 CH3 O CH3 O CH3 C CH3 O CH3 C CH3 16.24 Prima classificare i composti di partenza come: orto, para attivanti, orto, para disattivanti, o meta disattivanti. Quindi disegnare i prodotti. Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl CH2CH3 a. CH3CH2Cl OCH3 OCH3 OCH3 CH3CH2 AlCl3 ortho product lone pair on O o,p activating para product NO2 b. HNO3 Br Br halogen o,p deactivating Br O2N H2SO4 ortho product para product Cl c. NO2 Cl2 NO2 FeCl3 meta deactivating 16.25 meta product I gruppi elettron-donatori fanno reagire il composto più velocemente del benzene nelle reazioni di sostituzione elettrofila aromatica. I gruppi elettron-attrattori fanno reagire il composto più lentamente del benzene nelle reazioni di sostituzione elettrofila aromatica. O C a. O CH3 O2N C Cl O2N + halogen electron withdrawing reacts slower electron withdrawing reacts slower CN Cl d. CH3 CN NO2 Cl O2N b. CH2CH3 electron withdrawing reacts slower CH2CH3 e. NO2 OH OH c. OH + NO2 lone pairs on O electron donating reacts faster R group electron donating reacts faster O2N + CH2CH3 O2N 16.26 I gruppi elettron-donatori rendono il composto più reattivo del benzene nelle reazioni di sostituzione elettrofila aromatica. I gruppi elettron-attrattori rendono il composto meno reattivo del benzene nelle reazioni di sostituzione elettrofila aromatica. C(CH3)3 a. OH b. + COOCH2CH3 c. N(CH3)3 d. OH R group electron donating more reactive two OH's electron donating more reactive C with 2 electronegative O's electron withdrawing less reactive electron withdrawing less reactive Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl 16.27 Cl NO2 OCH3 CH3 b. a. halogen electron withdrawing least reactive intermediate reactivity lone pairs on O electron donating most reactive electron withdrawing least reactive R group electron donating most reactive intermediate reactivity 16.28 Strutture risonanti particolarmente stabili hanno tutti gli atomi con un ottetto. I carbocationi con più gruppi R elettron-donatori sono anche strutture più stabili. Strutture risonanti particolarmente instabili hanno cariche adiacenti uguali. C(CH3)3 C(CH3)3 a. NO2 OH NO2 C(CH3)3 H H H NO2 NO2 NO2 especially stable with additional R group stabilized carbocation OH b. C(CH3)3 OH OH OH H H H H NO2 NO2 NO2 NO2 especially stable all atoms have an octet O CHO C CHO C H H H H NO2 NO2 NO2 NO2 c. NO2 O CHO H H especially unstable 2 adjacent + charges Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl 16.29 Cl Cl Cl H ortho attack H E E+ + Cl Cl H E + + + Cl H E H E E preferred especially good All atoms have an octet. product Cl Cl E+ meta attack + + H E H H E Cl H E + E + Cl Cl Cl Cl Cl Cl Cl Cl + para attack + E+ H H + H E E H E H E E preferred product especially good All atoms have an octet. 16.30 Per disegnare il prodotto di reazione con HNO3/H2SO4 ed i derivati benzenici disostituiti ricordare: • Se i due effetti orientanti si rinforzano a vicenda, il nuovo sostituente sarà collocato nella posizione attivata da entrambi. • Se gli effetti orientanti sono opposti, predomina l'effetto del gruppo attivante più forte. • Non avviene nessuna sostituzione tra due sostituenti in meta. o,p o,p OCH3 OCH3 a. CH3 NO2 HNO3 CH3 NO2 HNO3 O2N CH3 NO2 NO2 c. H2SO4 COOCH3 meta H2SO4 COOCH3 NO2 o,p meta o,p (strong) OCH3 OCH3 Br HNO3 O 2N Br HNO3 d. o,p H2SO4 Br H2SO4 NO2 Cl Cl Br b. oppose products due to OCH3 directing effects Cl OCH3 o,p O2N Br Br NO2 Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl 16.31 Cl Cl2/FeCl3 SO3/H2SO4 a. OH OH CH3Cl/AlCl3 c. SO3H OH SO3H CH3 Put meta director on first. CH3 (+ ortho isomer) O ClCOCH3 b. Br goes ortho to the stronger activator. O HNO3/H2SO4 C AlCl3 Br Br2 C CH3 CH3 O2N 16.32 Prima usare una reazione di acilazione, e quindi ridurre il gruppo carbonilico per formare l'alchil benzene. O Cl a. C O C CH2CH2CH2CH3 CH2CH2CH2CH2CH3 Zn(Hg) + HCl CH2CH2CH2CH3 AlCl3 O Cl b. C O C(CH3)3 C CH2C(CH3)3 Zn(Hg) + HCl C(CH3)3 AlCl3 16.33 C6H5C(CH3)3 cannot be made by Friedel–Crafts acylation because there are no benzylic hydrogens. All products of Friedel–Crafts acylation followed by reduction have two benzylic hydrogens where the C=O was reduced. C6H5C(CH3)3 can be made by Friedel–Crafts alkylation using (CH3)3CCl and AlCl3. 16.34 CH3Cl CH3 a. KMnO4 COOH AlCl3 b. HNO3 NO2 H2SO4 CH3Cl c. AlCl3 H2 NH2 Pd-C CH3 Br2 FeBr3 CH3 KMnO4 Br (+ para isomer) 16.35 Usare le indicazioni della risposta 16.26 per mettere in ordine i composti. COOH Br C(CH3)3 no H's Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl OH NO2 CHCl2 a. CH2Cl d. intermediate reactivity least reactive CHO most reactive least reactive Cl intermediate reactivity CH2NH2 b. most reactive CH3 NH2 e. intermediate reactivity least reactive most reactive least reactive intermediate reactivity most reactive NH2 NO2 c. intermediate reactivity least reactive most reactive 16.36 Gruppi elettron-attrattori delocalizzano una carica positiva sull'anello benzenico. Disegnare le strutture di risonanza per mostrare come NO2 colloca una carica positiva nell'anello, generando un effetto di risonanza elettron-attrattore. Gruppi elettron-donatori delocalizzano una carica negativa sull'anello benzenico. Disegnare le strutture di risonanza per mostrare come F colloca una carica negativa nell'anello, generando un effetto di risonanza elettron-donatore. O O O N N N O a. O O N O O O F F F 16.37 Br [1] a. withdraw b. donate c. less d. deactivate C N [2] a. withdraw b. wtihdraw c. less d. deactivate O [3] C O a. withdraw b. donate c. more d. activate O F b. CH3 O O O N N N O F Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl 16.38 O C a. b. O CH3 more electron rich due to CH3 group more reactive more electron rich due to O atom more reactive 16.39 a. OH H ortho attack OH OH H E E+ + OH OH H E OH H E + H E E + + especially good All atoms have an octet. OH OH E+ meta attack + H + H E H E + OH H E E + OH OH OH OH OH OH preferred product OH OH + para attack + E+ H H + E H E H E H especially good All atoms have an octet. E E preferred product Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl COOCH3 b. H ortho attack E+ COOCH3 H E + COOCH3 H E CH3O CH3O O C H E + + O COOCH3 +C + E H E destabilized two adjacent like charges COOCH3 E+ meta attack COOCH3 COOCH3 + H H E + H E COOCH3 COOCH3 H E + E preferred product CH3O COOCH3 COOCH3 C O CH3O +C + para attack O COOCH3 + + E+ H H COOCH3 + E H E H E destabilized two adjacent like charges H E E Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl 16.40 E E+ + A benzene ring is an electron rich substituent that stabilizes an intermediate positive charge by an electron donating resonance effect. As a result, it activates a benzene ring toward reaction with electrophiles. E Ortho and para products are isolated. ortho, para director With ortho and para attack there is additional resonance stabilization that delocalizes the positive charge onto the second benzene ring. Such additional stabilization is not possible with meta attack. Ortho attack: H E H E H E H E H E H E+ E H Meta attack: H E H H E H E E+ Para attack: E+ H E H H E H E H E 16.41 CH3 CH3 CH3 CH3 p-xylene m-xylene slower faster CH3 is an ortho, para director. In m-xylene, the directing effects of the two CH3 groups reinforce each other, making it react faster. In p-xylene, the two groups activate different C's, so the reaction is slower. H E H E Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl 16.42 Nelle condizioni acide della nitrazione, l'atomo di N del composto di partenza risulta protonato, così l'atomo direttamente legato all'anello del benzene ha una carica (+). Questo lo rende meta orientante, e perciò il gruppo NO2 attacca in posizione meta. H N(CH3)2 N(CH3)2 HNO3 H2SO4 acts as a base N(CH3)2 HNO3 + H2SO4 now a meta director NO2 16.43 a. H AlCl3 Cl Cl + _ AlCl3 3° carbocation + AlCl4– H H H H _ Cl HCl + AlCl3 Cl b. AlCl3 + _ AlCl3 + + Cl AlCl3 + + AlCl4– resonance-stabilized carbocation Use both resonance forms to show how two products are formed. _ Cl H H H AlCl3 H + + + + + H + AlCl3 HCl + + + H + H H _ Cl AlCl3 c. H OSO3H H H H – 3° carbocation + HSO4 – HSO4 H2SO4 + Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl 16.44 a. The product has one stereogenic center. stereogenic center b. The mechanism for Friedel–Crafts alkylation with this 2o halide involves formation of a trigonal planar carbocation. Since the carbocation is achiral, it reacts with benzene with equal probability from two possible directions (above and below) to afford an optically inactive, racemic mixture of two products. H Cl H Cl AlCl3 H H AlCl3 AlCl4 trigonal planar achiral carbocation (R)-2-chlorobutane H – racemic mixture optically inactive 16.45 E E E+ A This product is formed. B This product is not formed. H E H E H E H E E+ H E Attack to form A proceeds via a carbocation for which 7 resonance structures can be drawn. A E E+ H E H E H Attack to form B proceeds via a carbocation for which 6 resonance structures can be drawn. E H E E H H B A reaction that occurs by way of the more stable carbocation is preferred so product A is formed. E E H H Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl 16.46 O CCl3 C H H OSO3H H CCl3 H O C H CCl3 Cl O C OH OH H C H Cl H C CCl3H HSO4– H OSO3H Cl CCl3 HSO4– (+ 3 resonance structures) OH2 H C Cl CCl3 HSO4– HSO4– H CCl3 CCl3 C Cl Cl C Cl H Cl Cl H C H CCl3 H2O (+ 3 resonance structures) DDT H2SO4 Cl 16.47 Il bromuro di benzile forma un intermedio stabilizzato per risonanza, che gli permette di reagire rapidamente in condizioni che favoriscono la SN1. Formation of a resonance-stabilized carbocation: CH2 CH2 CH2 CH2 CH2 CH2 Br benzyl bromide resonance-stabilized carbocation CH2OCH3 CH2 CH2OCH3 + HBr H + CH3OH + Br benzyl methyl ether 16.48 L'addizione di HBr forma soltanto un bromuro alchilico, perché l'intermedio carbocationico che porta alla sua formazione è stabilizzato per risonanza. Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl H H H CH3 CH3 H Br CH3 CH3 H H H H H CH3 H H H H resonancestabilized or H Br H H CH3 Br CH3 H H H only no resonance stabilization As a result, this carbocation does not form. 16.49 Cl a. AlCl3 O O b. Zn(Hg)/HCl Cl AlCl3 O c. Cl2 Cl Cl Zn(Hg)/HCl Cl FeCl3 Cl AlCl3 O (+ para isomer) NO2 HNO3 d. NO2 Br2 FeBr3 H2SO4 Br Br2 e. HNO3 FeBr3 Br CH3Cl f. AlCl3 CH3 H2SO4 SO3 H2SO4 NO2 (+ para isomer) Br CH3 SO3H (+ para isomer) KMnO4 COOH SO3H Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl CH3Cl g. CH3 COOH KMnO4 COOH HNO3 AlCl3 H2SO4 NO2 Br2 CH3Cl h. AlCl3 O C Cl i. CH3 KMnO4 Br FeBr3 CH3 Br COOH (+ ortho isomer) Br2 CH2CH3 NO2 O O CH2CH2CH3 Zn(Hg)/HCl FeBr3 AlCl3 CH2CH2CH3 HNO3 H2SO4 Br Br Br (+ isomer) 16.50 Br a. K+ −OC(CH3)3 Br2 Cl hν AlCl3 Br Br b. K+ −OC(CH3)3 Br2 Cl Br Br2 hν AlCl3 16.51 NO2 a. NH2 Br2 HNO3 Sn FeBr3 H2SO4 HCl Br Br Br (+ ortho isomer) CH3 CH3 b. Br CH3Cl Br2 AlCl3 FeBr3 (3 equiv) KMnO4 Br Br Br Br CH3 CH3 CH3 c. COOH Br CH3Cl HNO3 Br2 AlCl3 H2SO4 FeBr3 NO2 (+ ortho isomer) Br NO2 2 NH2 C CH Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl NO2 Cl Cl HNO3 O d. AlCl3 AlCl3 H2SO4 O O (+ para isomer) NO2 CH3Cl HNO3 AlCl3 CH3 H2SO4 e. NO2 KMnO4 HOOC CH3 NH2 Sn HCl HOOC (+ ortho isomer) 16.52 CH3 CH2Br Br2 a. hν CH2OH b. product in (a) c. product in (a) NaOH CH2OC(CH3)3 OC(CH3)3 CHO d. PCC product in (b) CHO Br2 e. from d. CHO FeBr3 Br f. CH3 Cl2 CH3 FeCl3 Cl g. CH3 C CH3 Cl COOH (+ ortho isomer) O h. Cl KMnO4 Cl Cl COOH (+ para isomer) Cl2 FeCl3 CH3 KMnO4 (CH2)4CH3 AlCl3 CH3 O C (CH2)4CH3 Zn(Hg)/HCl CH3 (CH2)5CH3 Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl O i. CH3 CH3 C O Cl C O KMnO4 CH3 C CH3 CH3 AlCl3 CH3 COOH KMnO4 COOH COOH COOH SO3H HNO3 j. H2SO4 CH3 NO2 k. HO3S CH3 CH3 HNO3 H2SO4 NO2 H2SO4 HNO3 NO2 COOH KMnO4 NO2 NO2 H2SO4 NO2 NO2 16.53 HO CH3 CH3Cl [1] NaH [2] CH3CH2CH2Br AlCl3 O COOH KMnO4 O O HNO3 H2SO4 COOH O2N X O 16.54 L'attacco sulla posizione 2 è favorito perché il carbocatione risultante è maggiormente stabilizzato per risonanza rispetto al carbocatione che si forma dall'attacco sulla posizione 3. attack at 2-position + + E+ O H E O furan attack at 3-position furan O H E + O H E O three resonance structures + O + E H E+ + O E 2-position E E H + O O 3-position two resonance structures 16.55 Disegnare un meccanismo a stadi per la seguente reazione intramolecolare, che è stata usata per la sintesi dell'ormone sessuale femminile estrone. Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The McGraw Hill Companies srl overall reaction Lewis acid OH or HA RO The steps: RO A H A + + + OH2 RO RO + A + H2O RO (+ 1 resonance structure) A H + H A + RO A RO (+ 3 resonance structures)
Scarica