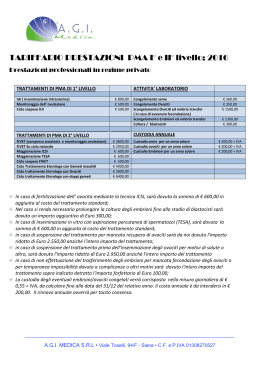
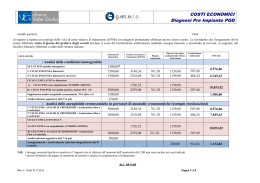
Biotech PMA Centro di Procreazione Medicalmente Assistita di II livello Numero 050040 del Reg. Naz. PMA presso l’Istituto Superiore di Sanità Direttore Sanitario: Dott.ssa Giuliana Bruno – Spec. in Ginecologia e ostetricia Responsabile medico: Dott. Roberto Laganara – Spec. in Ginecologia e Ostetricia CONSENSO FIVET CONSENSO ALLA PROCEDURA DI FECONDAZIONE IN VITRO (FIVET) Redatto secondo la legge 40/2004 del 19 febbraio 2004 “Norme in materia di PMA” DESCRIZIONE DELLA PROCEDURA La fecondazione in vitro è una sofisticata tecnica nella quale la fecondazione della cellula femminile (ovocita) da parte della cellula maschile (spermatozoo) non avviene naturalmente nella tuba dell'utero ma è effettuata in laboratorio, da parte di personale altamente qualificato, mettendo gli ovociti alla presenza degli spermatozoi o iniettando direttamente uno spermatozoo in ogni ovocita (tecnica nota come ICSI). La prima parte della metodica consiste nell'ottenere la maturazione contemporanea di più ovociti da parte delle ovaie. Per fare questo è necessario somministrare alla paziente un farmaco che blocchi la funzione spontanea della ghiandola ipofisi e, successivamente, somministrare degli ormoni (detti gonodatropine), del tutto identici a quelli normalmente presenti nell'organismo, che inducono la maturazione follicolare. Questa è monitorizzata mediante prelievi di sangue per eseguire dei dosaggi ormonali ed ecografie transvaginali per visualizzare i follicoli ovarici (piccole strutture ovariche dentro le quali si trovano gli ovociti). Quando le dimensioni dei follicoli ovarici sono ritenute sufficienti, viene indotta la maturazione finale con un'ultima iniezione e si passa, dopo circa 36 ore, alla raccolta degli ovociti. La seconda parte della metodica consiste appunto nella raccolta degli ovociti: questa viene effettuata pungendo i follicoli ovarici ed aspirandone il liquido, nel quale vengono quindi ricercati gli ovociti. La puntura avviene per via vaginale, sotto controllo ecografico; la procedura viene eseguita normalmente con una leggera sedazione o in anestesia loco-regionale. Una volta ottenuti gli ovociti, si passa alla terza parte della metodica, che si svolge in laboratorio. Gli ovociti ottenuti sono messi in presenza degli spermatozoi del partner (o iniettati con tecnica ICSI) e dopo 24 ore si osserva al microscopio se vi è stata la fecondazione. In caso affermativo, dopo un intervallo variabile da 1 a 5 giorni ore si procede con la quarta ed ultima parte della metodica: consiste nel trasferimento in utero degli embrioni; tale trasferimento viene eseguito con un sottile catetere per via trans-cervicale e non richiede anestesia. A questo punto bisogna aspettare 14 giorni per eseguire un dosaggio dell'ormone HCG e vedere se si è instaurata una gravidanza. Come tutte le procedure mediche, anche per la FIVET esistono dei rischi e possibili complicanze. RISCHI e POSSIBILI COMPLICANZE 1. 2. 3. 4. 5. Iperstimolazione delle ovaie causata dalla terapia ormonale. le ovaie possono rispondere in maniera eccessiva alla dose di ormoni usata normalmente. Questo può avere sia implicazioni sul trattamento FIVET (fino a richiedere la sua sospensione immediata) sia sulla salute della paziente: si possono avere dolori addominali intensi, accompagnati dall'ingrossamento delle ovaie e dalla formazione di liquido nella cavità addominale; in rari casi si rende necessario il ricovero in ambito ospedaliero e l'aspirazione di tale liquido. Sono segnalati anche rarissimi casi di trombosi venose. L’incidenza è tra 0,5 e 5%. Complicazioni del prelievo ovocitario. Comprendono il rischio di emorragia conseguente alla puntura della parete vaginale e dell’ovaio, con un’incidenza del 0,1%, e il rischio di un’infezione con formazione di un ascesso pelvico, con un’incidenza del 0,3% Gravidanza extrauterina. Nella procedura FIVET è segnalata una percentuale lievemente più elevata del normale di gravidanze tubariche (4% rispetto al 1-1,5% della popolazione normale) Gravidanza multipla. Questo rischio è direttamente legato al numero di embrioni trasferiti nell’utero. Reazioni allergiche possono manifestarsi verso tutte le sostanze implicate nella procedura, dai farmaci per la stimolazione ovarica fino ai materiali di sala operatoria o di laboratorio. MOD-18-MPO-PMA Rev. n. 6 del 14.01.2015 pag. 1 di 4 Biotech PMA Centro di Procreazione Medicalmente Assistita di II livello Numero 050040 del Reg. Naz. PMA presso l’Istituto Superiore di Sanità Direttore Sanitario: Dott.ssa Giuliana Bruno – Spec. in Ginecologia e ostetricia Responsabile medico: Dott. Roberto Laganara – Spec. in Ginecologia e Ostetricia CONSENSO FIVET 6. Fallimento della procedura: può verificarsi a vari livelli. Può aversi un’inadeguata risposta ovarica alla stimolazione; possono non ritrovarsi ovociti nel liquido aspirato dai follicoli ovarici; la fecondazione in laboratorio può non avvenire o avvenire in maniera irregolare. RISULTATI Nel 2013 la nostra percentuale totale di gravidanza per transfert di embrioni (sommando cicli freschi e da decongelamento) è stata del 24,8%. I dati riportati dalle NICE Clinical Guidelines nel 2013 (guidance.nice.org.uk/cg156) sono riportati nel grafico sottostante. CONSEGUENZE GIURIDICHE I sottoscritti dichiarano di essere stati informati sulle conseguenze giuridiche derivanti dagli articoli 8 e 9 della legge 40 del 2004, e specificatamente che: In base all’articolo 8 della legge 40/2004 (stato giuridico del neonato) i nati a seguito di tecniche di PMA hanno lo stato di figli legittimi o di figli riconosciuti della coppia che ha espresso la volontà di ricorrere alle tecniche di PMA. In base all’articolo 9 della legge 40/2004 (divieto di anonimato della madre) la madre del nato in seguito a tecniche di PMA non può dichiarare la volontà di non essere nominata al momento del parto, ai sensi art. 30, comma 1, DPR 3 nov. 2000, n. 396 MOD-18-MPO-PMA Rev. n. 6 del 14.01.2015 pag. 2 di 4 Biotech PMA Centro di Procreazione Medicalmente Assistita di II livello Numero 050040 del Reg. Naz. PMA presso l’Istituto Superiore di Sanità Direttore Sanitario: Dott.ssa Giuliana Bruno – Spec. in Ginecologia e ostetricia Responsabile medico: Dott. Roberto Laganara – Spec. in Ginecologia e Ostetricia CONSENSO FIVET COSTI (*)(**) - Ciclo FIVET o ICSI (***) - Eventuale crioconservazione di embrioni sovrannumerari - Ciclo FIVET con embrioni crioconservati (*) Euro 1.225,00 (***) - Crioconservazione degli ovociti (*) - Ciclo ICSI con ovociti crioconservati - Ciclo FIVET-ICSI con arresto della stimolazione (*) - Ciclo FIVET o ICSI senza transfert Euro 3.950,00 Euro 300,00 Euro 300,00 Euro 1.525,00 (*) Euro 500,00 Euro -500,00 (*) Escluso prelievi di sangue: i dosaggi saranno pagati direttamente presso il laboratorio di analisi. In caso di ripetizione di trattamento FIVET “fresco” entro sei mesi dalla conclusione del primo, sarà applicata una riduzione di euro 300,00. (***) Comprensivo delle spese di custodia fino al 31 dicembre del primo anno, poi il costo è attualmente di 200 euro per anno solare. (**) Modalità di pagamento: Cicli freschi: 1. 2. 3. un primo acconto di 500,00 euro va versato al momento della firma del consenso e del rilascio del piano terapeutico un secondo acconto di 2950,00 euro va versato il giorno del prelievo di ovociti il saldo di 500,00 euro (più eventuali 300,00 euro per la crioconservazione), va versato il giorno del transfert degli embrioni Cicli di decongelamento: 1. 2. un primo acconto di 500,00 euro vi verrà richiesto al momento dell’annuncio della mestruazione il saldo va versato il giorno del transfert degli embrioni I sottoscritti dichiarano di essere coniugati o conviventi e avendo letto e compreso quanto precede, chiedono di entrare nel programma FIVET del centro Biotech PMA. In base alle legge n.40/2004 sulla PMA è possibile ritirare il consenso fino a prima della fecondazione degli ovociti. I sottoscritti dichiarano di essere stati informati che le Linee Guida F.O.N.Ca.M. del 2005 raccomandano testualmente: “Prima di una stimolazione ormonale o di un impianto protesico potrebbe essere utile sottoporre a mammografia la donna sopra i 35 anni”. Il numero massimo di embrioni da trasferire viene fissato a …..…. (…………………) ma siamo stati anche informati che, pur trasferendo il numero di embrioni concordati, è possibile osservare successivamente un numero di embrioni maggiore correlato ad una divisione post-zigotica, non controllabile nel fase di pre-impianto (gemelli omozigoti). I sottoscritti dichiarano di aver ricevuto un’esplicita offerta di consulenza riguardante le implicazioni del trattamento per noi stessi, per i nostri familiari inclusi figli già esistenti o figli futuri e per la società, con informazioni esaurienti sui problemi bioetici e sui possibili effetti collaterali sanitari e psicologici, sulle probabilità di successo e sui rischi derivanti MOD-18-MPO-PMA Rev. n. 6 del 14.01.2015 pag. 3 di 4 Biotech PMA Centro di Procreazione Medicalmente Assistita di II livello Numero 050040 del Reg. Naz. PMA presso l’Istituto Superiore di Sanità Direttore Sanitario: Dott.ssa Giuliana Bruno – Spec. in Ginecologia e ostetricia Responsabile medico: Dott. Roberto Laganara – Spec. in Ginecologia e Ostetricia CONSENSO FIVET dall’applicazione delle tecniche di fecondazione assistita e sulle conseguenze giuridiche per la donna, per l’uomo e per il nascituro. I sottoscritti dichiarano che gli è stata altresì prospettata la possibilità di ricorrere, in alternativa, a procedure di adozione o di affidamento ai sensi della Legge 4 maggio 1983, n. 184 e successive modifiche. Ogni riferimento normativo è comunque compreso nella Legge n. 40 del 19 Febbraio 2004, in materia di PMA e nelle Linee Guida PMA D.21 Luglio 2004 (GU n.191 del 16.8.2004) , nel D. 4 Agosto 2004 (GU n.200 del 26.8.2004), nelle Linee Guida PMA D. 11 Aprile 2008 (GU n. 101 del 30.4.2008). I sottoscritti dichiarano di essere stati informati ed acconsentono che, in caso di gravidanza, saranno contattati per la compilazione di un questionario riguardante l’andamento della gravidanza: tale raccolta dati è necessaria per la compilazione dei report annuali del Registro Nazionale PMA, dove i dati vengono trasmessi in forma assolutamente anonima. Padova, …………………………..……….. La paziente Il paziente ..………………………………………………. ………………………………………..……………. Come previsto dalla normativa si allega copia del documento d’identità dei pazienti. Il Medico ………………………………………………. MOD-18-MPO-PMA Rev. n. 6 del 14.01.2015 pag. 4 di 4
Scaricare