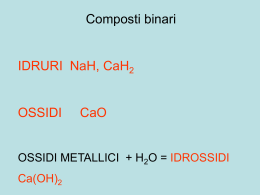
NOMENCLATURA delle SOSTANZE CHIMICHE ~100 elementi A,B,C, … quanti composti binari AB,AC,AD, ….? ternari ABC,ABD, …AFB,…, ZZZ? quali rapporti di combinazione A2B,AB2, A3B,A3B2, …? Ricordiamo che … non conduttori anche aeriformi opachi conduttori non-METALLI non plastici solidi tranne Hg METALLI lucenti circa 18 duttili e malleabili circa 93 semiMETALLI B (boro), Si (silicio), Ge (germanio), As (arsenico), Sb (antimonio), Te (tellurio), Po (polonio) Sostanze basiche si ottengono dai metalli (composti ionici) amare scivolose neutralizzano gli acidi fanno virare al blu la cartina tornasole caustiche e corrosive Sostanze acide si ottengono dai NON metalli (composti covalenti) aspre corrodono metalli neutralizzano le basi fanno virare al rosso la cartina tornasole Sostanze acide H- + ossigeno + idrogeno IDRURI OSSIDI BASICI METALLI 2Na(s)+H2(g)→2NaH(s) H+ 4Na(s)+O2(g)→2Na2O(s) non-METALLI Cl2(s)+H2(g)→2HCl (s) O-2 + ossigeno + idrogeno IDRACIDI O-2 OSSIDI ACIDI 2Cl2(s)+3O2(g)→2Cl2O3 (s) METALLI sono semiMETALLI ANFOTERI comportandosi da non-METALLI Il numero di ossidazione gas nobili ±1 calcogeni H alcalini metalli +1 alogeni Carica formale che un elemento assume durante la formazione di un legame chimico per condivisione di elettroni +2 metalli alcalino- terrosi He +1 +2 ±3 +4 +5 +3 ±2 +4 Li Be B C +1 +3 +4 +3 +5 -2 +4 +6 Al Si P S +4 ±3 +4 +2 Na Mg +1 +2 K Ca +1 +2 Rb Sr +1 +2 Cs Ba +1 +2 Fr Ra +2 +3 +2 +3 +2 +3 +6 +4 +6 +7 Cr Mn Fe +1 +2 +2 Cu Zn 0 N -2 -1 -1 0 O F Ne ±1 +3 +5 +7 0 Cl Ar ±1 +3 +5 0 Ge As Br Kr +1 +2 +4 +2 +4 ±1 +3 +5 0 Ag Sn Sn I Xe +1 +3 +1 +2 0 Au Hg Rn Spostandoci a destra … il C ad esempio 4e- C +4 -2 2O CO2 4x1e- C -4 4H +1 CH4 -2 CO 2e- C +2 O elementi dei gruppi VA, VIA, VIIA 3e- N -3 3H NH3 +1 2x1e- 2Na+1 Na2O O-2 1e- H+1 Cl-1 E’ anche possibile però che… 2x3 e- 2N+3 2x1e- 2Cl+1 3O-2 2x5 e- O-2 2N+5 5O-2 2x3e- 2Cl+3 3O-2 2x5e- 2Cl+5 5O-2 2x7e- 2Cl+7 7O-2 Scriviamo la formula chimica di una sostanza … +7 -2 Cl2 O7 La regola viene detta della X Alcune regole che è bene ricordare … •Gli atomi delle sostanze elementari hanno sempre numero di ossidazione zero; •Il numero di ossidazione dell’ossigeno è sempre -2 (tranne nei perossidi in cui vale -1); •Il numero di ossidazione dell’idrogeno è sempre +1 ad eccetto degli idruri; •In una molecola o unità formula la somma dei numeri di ossidazione di tutti gli atomi presenti deve essere uguale a zero; se si tratta di uno ione deve coincidere con la carica dello ione. Principali categorie di sostanze SALI BINARI + H2 IDRACIDI (o acidi binari) IDRURI + H2 (g) METALLI + H2 (g) TPE NON METALLI + O2 (g) + O2 (g) OSSIDI ACIDI (o anidridi) OSSIDI BASICI + H2O(l) + H2O(l) OSSIACIDI (o acidi ossigenati o acidi ternari) IDROSSIDI (o basi) SALI TERNARI + H2O Schema semplificato Composti binari COMPOSTI BINARI IONICI MOLECOLARI OSSIDI BASICI SALI (alogenuri, solfuri) OSSIDI ACIDI IDRACIDI IDRURI COVALENTI IDRURI COMPOSTI TERNARI Composti ternari IONICI IDROSSIDI SALI DEGLI OSSIACIDI MOLECOLARI OSSICIADI (o acidi ternari o acidi ossigenati) Nomenclatura tradizionale e IUPAC di alcuni ossidi 2Mg(s) + O2(g) → 2MgO(s) elemento numero di ossidazione formula nome tradizionale nome IUPAC +1 Cu2O ossido rameoso monossido di dirame +2 CuO ossido rameico monossido di rame +2 SnO ossido stannoso monossido di stagno +4 SnO2 ossido stannico diossido di stagno Cu Sn S(s) + O2(g) → SO2(g) elemento C N Cl numero di formula nome tradizionale nome IUPAC +2 CO ossido di carbonio monossido di carbonio +4 CO2 anidride carbonica diossido di carbonio +3 N2O3 anidride nitrosa triossido di diazoto +5 N2O5 anidride nitrica pentossido di diazoto +1 Cl2O anidride ipoclorosa monossido di dicloro +7 Cl2O7 anidride perclorica eptaossido di dicloro ossidazione Nomenclatura tradizionale e IUPAC di idruri e idracidi Mg(s) + H2(g) → MgH2(s) numero di elemento formula nome tradizionale nome IUPAC +1 NaH idruro di sodio idruro di sodio +1 CuH idruro rameoso idruro di rame +2 CuH2 idruro rameico diidruro di rame +3 AlH3 idruro di alluminio triidruro di alluminio ossidazione Na Cu Al S(s) + H2(g) → H2S(g) numero di nome elemento ossidazion formula nome IUPAC tradizionale e F -1 HF acido fluoridrico fluoruro di idrogeno Cl -1 HCl acido cloridrico cloruro di idrogeno Br -1 HBr acido bromidrico bromuro di idrogeno I -1 HI acido iodidrico ioduro di idrogeno Nomenclatura tradizionale e IUPAC di alcuni idruri speciali numero di elemento formula nome comune nome IUPAC ossidazione C -4 CH4 metano tetraidruro di carbonio N -3 NH3 ammoniaca triidruro di azoto Si +4 SiH4 silano tetraidruro di silicio P +3 PH3 fosfina tetraidruro di fosforo Nomenclatura tradizionale e IUPAC dei Sali binari 2HCl(aq) + Zn (s) → ZnCl2(aq) +H2(g) 2HCl(aq) + ZnO (s) → ZnCl2(aq) +H2O(l) nome acido nome sale -idrico -uro ione formula metallico sale binario HF Na+1 HCl idracido nome tradizionale nome IUPAC NaF fluoruro di sodio fluoruro di idrogeno Ca+2 CaCl2 cloruro di calcio dicloruro di calcio HBr Al+3 AlBr3 bromuro di alluminio tribromuro di alluminio H2S Fe+3 Fe2S3 solfuro ferrico trisolfuro di diferro Nomenclatura tradizionale e IUPAC di idrossidi e ossiacidi MgO(s) + H2O(l) → Mg(OH)2(s) elemento numero di formula nome tradizionale nome IUPAC +1 NaOH idrossido di sodio idrossido di sodio +1 CuOH idrossido rameoso monoidrossido di rame +2 Cu(OH)2 idrossido rameico diidrossido di rame Al +3 Al(OH)3 idrossido di alluminio triidrossido di alluminio Sn +4 Sn(OH)4 idrossido stannico tetraidrossido di stagno Na Cu ossidazione SO3(g) + H2O(l) → H2SO4(l) Elemento numero di formula nome tradizionale nome IUPAC +4 H2SO3 acido solforoso acido triossosolforico (IV) +3 HNO2 acido nitroso acido diossonitrico (III) +5 HNO3 acido nitrico acido diossonitrico (V) C +4 H2CO3 acido carbonico acido triossocarbonico (IV) Cl +1 HClO acido ipocloroso acido ossoclorico (I) Cl +7 HClO4 acido perclorico acido tetraossoclorico (VII) S N ossidazione Nomenclatura tradizionale e IUPAC dei Sali ternari Mg(s) + H2SO4(aq) → MgSO4(s) + H2(g) MgO(s) + H2SO4(aq) → MgSO4(s) + H2O(l) Mg(OH)2(s) + H2SO4(aq) → MgSO4(s) + 2H2O(l) MgO(s) + SO3(aq) → MgSO4(s) nome acido -oso -ico acido nome terziario tradizionale H2SO3 HClO4 H3PO4 HNO2 nome IUPAC acido acido triossosolforico solforoso (IV) acido acido tetraossoclorico perclorico (VII) acido fosforico acido tetraosso fosforico (V) acido nitroso acido diossonitrico (III) acido solforico acido tetraossosolforico nome sale -ito -ato ione formula nome metallico sale binario tradizionale Na+1 Na2SO3 solfito di sodio Sn+4 Sn(ClO4)4 Fe+2 Fe3(PO4)2 fosfato ferroso Cu+2 Cu(NO2)2 nitrito rameico +3 nome IUPAC triossosolfato (IV) di sodio perclorato tetraossoclorato (VII) d stannico stagno (IV) solfato di tetraossofosfato (V) di ferro (II) diossonitrato (III) di rame (II) tetraossosolfato (VI) di In generale, le reazioni di sintesi dei sali, sia ternari che binari, si possono ottenere secondo il seguente schema: IDRACIDI (o acidi binari) METALLI OSSIDI BASICI IDROSSIDI (o basi) + OSSIACIDI (o acidi ossigenati o acidi ternari) OSSIDI ACIDI (o anidridi) = SALI BINARI = SALI TERNARI
Scaricare