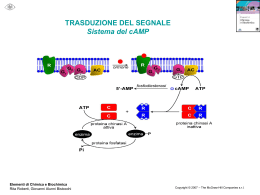
Meccanismi d’azione degli ormoni II tipo Recettori a 7 tratti transmembrana Recettori a 1 tratto transmembrana Oligosaccaridi: legame N animazione TRENDS in Pharmacological Sciences 26 2005 Emerging role of homo- and heterodimerization in G-proteincoupled receptor biosynthesis and maturation Sébastien Bulenger, Stefano Marullo and Michel Bouvier The idea that G-protein-coupled receptors (GPCRs) can function as dimers is now generally accepted. Although an increasing amount of data suggests that dimers represent the basic signaling unit for most, if not all, members of this receptor family, GPCR dimerization might also be necessary to pass quality-control checkpoints of the biosynthetic pathway of GPCRs. To date, this hypothesis has been demonstrated unambiguously only for a small number of receptors that must form heterodimers to be exported properly to the plasma membrane (referred to as obligatory heterodimers). However, increasing evidence suggests that homodimerization might have a similar role in the receptor maturation process for many GPCRs. Emerging roles for RGS proteins in cell signalling John R. Hepler Regulators of G-protein signalling (RGS proteins) are a family of highly diverse, multifunctional signalling proteins. RGS domains bind directly to activated Gα subunits and act as GTPase-activating proteins (GAPs) to attenuate and/or modulate hormone and neurotransmitter receptor-initiated signalling by both Gα–GTP and Gβγ. These proteins differ widely in their overall size and amino acid identity and possess a remarkable variety of structural domains and motifs. These biochemical features impart signalling functions and/or enable RGS proteins to interact with a growing list of unexpected protein-binding partners with diverse cellular roles. New appreciation for the broader cellular functions of RGS proteins challenges established models of G-protein signalling and serves to identify these proteins as central participants in receptor signalling and cell physiology. Classi e funzioni di proteine G Classe Tipo Gs αs Glucagone, β-adrenergici ↑ Adenilato ciclasi Gluconeogenesi Lipolisi, glicogenolisi αolf Olfattorio ↑ Adenilato ciclasi Senso dell'olfatto α11 Acetilcolina ↓ Adenilato ciclasi ↓ frequenza cardiaca α12 α2-Adrenergici ↑ Canali del potassio Gi Stimolo Effettore Effetto M2 colinergici Gq G12 α0 Oppiodi, endorfine ↑ Canali del potassio ↓ Canali del calcio Attività elettrica neuronale αt Luce ↑ cGMP fosfodiesterasi Visione αq M1 colinergici α11 α1-Adrenergici ↑ Fosfolipasi C- β2 ↑ Contrazione muscolare α1-Adrenergici ↑ Fosfolipasi C-β1 ↑ pressione ematica α12/13 Vari: ac.lisofosfatidico Vari: GTP-binding protein Rho vari Le quattro principali sottofamiglie di proteine G di mammifero (Gs, Gi, Gq e G12) sono distinte in base all'omologia di sequenza. La tabella riporta i membri rappresentativi di ognuna delle classi Si conoscono oltre 20 differenti tipi di subunità α, 6 subunità β, 12 sub γ J Biol Chem, Vol. 273, Issue 8, 4653-4659, February 20, 1998 Antje Gohla, Rainer Harhammer, and Günter Schultz Institut für Pharmakologie, Freie Universität Berlin, Germany The G-protein G13 but Not G12 Mediates Signaling from Lysophosphatidic Acid Receptor via Epidermal Growth Factor Receptor to Rho Lysophosphatidic acid (LPA) utilizes a G-protein-coupled receptor to activate the small GTP-binding protein Rho and to induce rapid remodeling of the actin cytoskeleton. The signal transduction from LPA receptors to Rho activation revealed interaction with proteins of the Gq, Gi, and G12 subfamilies. G13 but not G12 is involved in the LPA-induced activation of Rho. Moreover, our results suggest an involvement of the EGF receptor in this pathway. Sintesi e demolizione dell’AMP ciclico La tossina della pertosse attiva irreversibilmente l’adenilato ciclasi tramite ADP-ribosilazione della subunità αi La tossina colerica attiva irreversibilmente l’adenilato ciclasi tramite ADP-ribosilazione della subunità αs PKA inattiva Attivazione della PKA 2 4 2 PKA attiva 2 2 Cascata fosforilativa Ciclo dei fosfoinositidi attivi IP3 chinasi PL IP3 fosfatasi IP2 fosfatasi IP1 fosfatasi IP4 fosfatasi Gq (Active) Fosforilazione proteica accoppiata a proteine G Calmodulina e calcio Dominio della proteina target Attivazione e azione della protein chinasi c C2 Dominio del calcio citosol diacilglicerolo C1 C4 Ca2+ Proteina bersaglio ATP C3 ATP Dominio del C1 C3 C4 Proteina bersaglio ADP C1 C2 Ca2+ Ca2+ Ca2+ C1 Membrana plasmatica P Enzimi regolati da calcio o da calmodulina Adenilato ciclasi Proteina chinasi Ca2+-dipendente Ca2+-Mg2+-ATPasi Proteina chinasi Ca2+-fosfolipide-dipendente Fosfodiesterasi dei nucleotidi ciclici Glicerolo 3-fosfato deidrogenasi Glicogeno sintasi Guanilato ciclasi Miosina chinasi NAD chinasi Fosfolipasi A2 Fosforilasi chinasi Fosfoproteina fosfatasi 2B Piruvato carbossilasi Piruvato deidrogenasi Piruvato chinasi NO e guanidilato ciclasi Competizione per il substrato Immunomodulazione Infiammazione Attiv. leucociti Perm. Vasale Musc. Liscia ipersensibilizzazione ogni cellula produce un tipo solo di prostanoide * enzima unico: prostaglandina H-sintasi (PGHS-1 e PGHS-2) (enzima suicida) (acetilazione) (competizione) Recettori tirosin-kinasici Esempi di fattori di crescita Fattore di crescita sigla Bersagli cellulari recettore Epidermal growth factor EGF Varie cellule epiteliali e mesenchimali Tirosin chinasi Transforming growth factor-a TGF-a idem Tirosin chinasi Platelet-derived growth factor PDGF Mesenchimali, muscolo liscio, trofoblasti Tirosin chinasi Transforming growth factor-b TGF-b Fibroblasti Serina Treonina chinasi Fibroblast growth factor FGF Mesenchimali, fibroblasti altre Tirosin chinasi Interleukin-2 IL-2 Linfociti T citotossici Complesso 3 subunità Precursori macrofagi Tirosin chinasi Colony stimulating factor-1 CSF-1 Trasduzione del segnale di recettori tirosin-kinasici Raf Mek Approximately 30% of all human cancers display evidence of constitutive activation of the Raf/MEK/ERK MAPK pathway. I recettori per prolattina, eritropoietina, ormone crescita e citochine non hanno attività chinasica intriseca La fosforilazione sarà svolta da altre proteine: Tyk-2, JAK1 o JAK2 Altre vie in comune ad altri ormoni Dimerizzazione e traslocazione nucleare per l’interazione con elementi di risposta specifici: all’interferone, al siero ecc. Molte vie di trasduzione del segnale convergono su coattivatori comuni
Scaricare