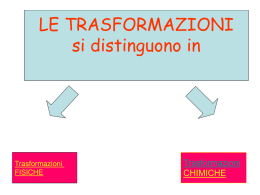
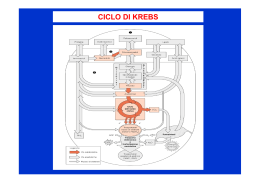
Le reazioni chimiche Nulla si crea, nulla si distrugge, tutto si trasforma Bilanciamento delle razioni chimiche scrivere l’ equazione in parole sostituire le parole con i simboli dei reagenti sistemare i coefficienti Il ferro reagisce con l’ ossigeno dell’atmosfera per dare ossido di ferro ( ruggine). 1) Fe + O2 2) 4 Fe + 3O2 Fe 2 O3 2 Fe2 O3 Esempi di reazioni chimiche -l’ossidazione dell’alluminio -la formazione di diossido di carbonio -La combustione del metano .La formazione di acido carbonico L’ossidazione dell’alluminio 4 Al + 3 O2 →2 Al2O3 La formazione di diossido di carbonio C + O2 → CO2 La combustione del metano CH4 + 2 O2 → CO2 + 2 H2O Formazione dell’acido carbonico CO2 + H2O → H2CO3 LA MOLE Quando si vuole effettuare una reazione bisogna sapere la quantità (g. kg. ecc..) dei reagenti necessaria. Siccome gli atomi e le molecole non si possono pesare si parla di mole: la MOLE è una quantità in grammi uguale al peso molecolare (numero di massa) dell’elemento dato. Esempio: il numero di massa (peso atomico) del Fe è uguale a 55,85, quindi una mole di ferro pesa 55,85 g. Esempio: consideriamo il solfuro di ferro (FeS). Il numero di massa dello zolfo è 32,06. Quindi il numero di massa del solfuro di ferro (peso molecolare) è 55,85 + 32,06 = 87,91 Questo significa che una mole di solfuro di ferro pesa 87, 91 g COME CALCOLARE LA PERCENTUALE DI UN ELEMENTO IN UN COMPOSTO PESO ATOMICO Fe : 55,85 PESO MOLECOLARE S : 32,06 PESO MOLECOLARE FeS : 87,91 % Fe in FeS = (55,85 / 87,91)*100=63.53 % % S in FeS = (32,06 / 87,91) * 100= 36.47 % REAZIONI DEI METALLI E NON METALLI METALLI IDROGENO IDRURI NON METALLI OSSIGENO OSSIDI IDROGENO OSSIGENO IDRACIDI ACQUA ANIDRIDI ACQUA IDROSSIDI OSSIACIDI SALE
Scaricare