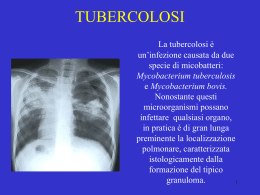
Use the Best First (UBF) Workshop Antiinfettivi 2005 Roma 09-11 Marzo 2005 Microbiologia delle Micobatteriosi Prof. Giovanni Fadda Istituto di Microbiologia – U. C. S. C. - Roma Active TB 30 millions New cases/year 8 millions Deaths/year 3 millions Un terzo della popolazione mondiale è infettato con M. tuberculosis Dye C., et al.. (1999) JAMA Vol. 282, pp:677-686 TUBERCOLOSI NEL MONDO Ogni giorno: 25000 persone si ammalano di TB attiva; circa 5000 muoiono di TB. 300,000 persone si infettano ogni anno con ceppi MDR-TB Testimonianze archeologiche della tubercolosi • Lesioni ossee in scheletri fossili risalenti a circa 8000 a.C. • Degenerazioni riconducibili alla tubercolosi in mummie egizie del 2500 a.C. • Rinvenimento di batteri con caratteristiche simili al M. tuberculosis in lesioni ossee di una mummia di un bimbo inca del 700 a.C. • Determinazione di DNA di M. tuberculosis complex in tessuto osseo di un bisonte estinto, datato 15000 anni a. C. (B. M. Rothschild et al., CID 2001, 33:305-11) La scoperta del M. tuberculosis • 1819: Teofilo Lennec ipotizza l’unicità delle manifestazioni cliniche della malattia • 1865: Jan Antonine Villemin induce in conigli la Tubercolosi e fornisce per la prima volta la prova della sua natura infettiva • 1882: Robert Koch, per la prima volta, isola e coltiva il Mycobacterium tubercolosis che da allora è anche conosciuto come bacillo di Koch Relazioni genetiche ed evolutive tra le specie di M. tuberculosis complex Evoluzione per delezione genica M. tuberculosis è la specie geneticamente più vicina al ceppo ancestrale; Le specie si sono evolute e differenziate seguendo un processo di delezione di frammenti di genoma; La specie di M. bovis è quella che ha subito il maggior numero di delezione; Tutti i ceppi di BCG presentano la delezione della regione RD1 di M. tuberculosis complex, che codifica per importanti fattori di virulenza (Esat-6, CFP10, PPE68, etc.); Ne consegue che M. bovis si è evoluto a partire dal ceppo ancestrale di M. tuberculosis, e che pertanto la tubercolosi è stata trasmessa dall’uomo agli animali e non viceversa. Si stima (dati OMS) che circa 50 milioni di persone siano infettate da micobatteri che presentano farmaco-resistenze Prevalence of drug resistance among new cases of tuberculosis Estonia 1999 China (Henan) 1996 Russia (Ivanovo) 1999 Latvia 1998 Russia (Tomsk) 1999 Thailand 1997 Sierra Leone 1997 0 MDR-TB 20 40 60 Any drug resistant other than MDR 80 100 Susceptible La soluzione raccomandata dall’OMS per il problema rappresentato dai micobatteri “multi drug resistant” è il protocollo DOTS (Directly Observed Treatment-Short Course) Il regime terapeutico DOTS, della durata di sei mesi, prevede l'impiego simultaneo di almeno 3 farmaci: l'isoniazide, la rifampicina e la pirazinamide per i primi 2 mesi, rifampicina e isoniazide per i restanti 4 mesi. In particolari casi questi farmaci possono di volta in volta essere integrati da streptomicina, etambutolo o etionamide. • Mycobacteria other than tubercle bacilli (Mycobacterium tuberculosis, M. bovis, M. africanum) and M. lepraeare now are recognized as important human pathogens • Some of these species can cause serious, even fatal, diseases in animals and humans. These microorganisms, once considered only environmental and saprophytic species, have been called by many names: anonymous, opportunistic, atypical and opportunistic bacilli •The terms “non-tuberculous mycobacteria” (NTM) and “mycobacteria other than tubercle bacilli” (MOTT) are preferable Ecology of Nontuberculous Mycobacterial (1) • Many nontuberculous mycobacteria are freeliving saprophytes that have been detected in and isolated from a wide variety of environments, including water, soil, dust, and aerosols. • In addition to their presence in natural environments, nontuberculous mycobacteria have been recovered from drinking-water distribution systems throughout the world. Ecology of Nontuberculous Mycobacterial (2) • The highest rates of NTM colonization in potable water systems are found in hospitals and hemodialysis and dental offices, with rates ranging from 60% to 100%. • The resistance of nontuberculous mycobacteria to disinfection undoubtedly contributes to the ability of a number of nontuberculous mycobacteria (e.g., Mycobacterium xenopi, M. avium, M. fortuitum, and M. chelonae) to persist in drinking-water systems The Runyon classification and characteristics of clinically significant nontuberculous mycobacteria (NTM) Species (Runyon group) Ideal temp. for growth Time for growth, days 37 °C 10-20 30 °C 5-10 Deep yellow (with light), smooth to rough Scotochromogens (II) M. szulgai M. xenopi M. gordonae 37 °C 42 °C 37 °C 10-25 15-30 10-15 Orange, smooth to rough Yellow and rough Deep yellow-orange and smooth Photochromogen at 25 °C Occasionally non pigmented Nonphotochromegens(III) M. avium 37 °C 10-20 Smooth-transparent flat colonies tend to be more Virulent M. haemophilum 30 °C 15-20 3 variants: smoothopaque raised, smoothtransparent flat, rough Smooth to rough Rapid growers (IV) M. fortuitum 37 °C 3-5 28°C 3-5 Transparent to creamcolored smooth Transaparent to creamcolored smooth May grow on 5% sheep blood agar May grow on 5% sheep blood agar Photochromogens (I) M. kansasii M. marinum M. chelonae Colony morphology Yellow (with light) Comments Occasional scotochromogenic or nonchromogenic strains Water exposure Importanza delle infezioni sostenute da MNT • In Svizzera, dal 1983 al 1988, l’incidenza della tubercolosi è passata da 16,2 a 13,2 casi per 100.000 abitanti, mentre quella delle micobatteriosi da MNT da 0,4 a 0,9 per 100.000 abitanti (Debrunner M et al., CID, 1992). • In Inghilterra, nel 1970, veniva isolato 1 MNT ogni 60 M. tuberculosis, mentre nel 1992 si è passati ad un rapporto di 1 MNT per 6 M. tuberculosis (Yates, JCM, 1995). • Infine, in Europa e negli USA è stato riportato che dal 25 al 50% dei pazienti con AIDS è affetto da micobatteriosi non tubercolari. Incidence rates (per 100,000 population) of disease due to nontuberculous mycobacteria in the Northern Territory of Australia,1989–1997 O’Brien DP, et al.. (2000) CID Vol. 31, 958-967 Association of species of nontuberculous mycobacteria (NTM) with clinical categories of nosocomial infection Clinical category Disseminated infection in immunocompromised patients Respiratory tract colonization/infection M. avium + Peritonitis associated with CAPD Injection associated cutaneous and joint infections Surgical infections M. xenopi M. kansasii M. gordonae ++ Infections related to hemodialysis Intravascular catheter infections Rapid growers + Other NTM + +++ + ++ ++ + ++ + ++ +++ + + + + + NOTE. CAPD, continuous ambulatory peritoneal dialysis; + rarely associated; ++ occasionally associated; +++ frequently associated. From: Phillips and van Reyn, CID, 2001 Association of species of nontuberculous mycobacteria (NTM) with types of nosocomial pseudoinfection Type of pseudoinfection M. avium Rapid growers M. xenopi Contamination via endoscope or automated endoscope washer + ++ + Contamination in microbiology and pathology laboratory + ++ Generalized contamination of a variety of clinical specimens after colonization of hospital water systems + M. gordonae M. scrofulaceum + + + Contamination in specimen collection M. marinum ++ + + + + NOTE: + rarely associated; ++ occasionally associated; +++ frequently associated. From: Phillips and van Reyn, CID, 2001 • Sulla base della sequenza del gene che codifica l’RNA ribosomale 16S, sono state identificate più di 100 specie di micobatteri • According to Wolinsky (1979) the following information is required for demonstrating that a particular nontuberculous mycobacterium was responsible for disease : the species of Mycobacterium, the quantity of growth on primary culture, repeated isolations of the same organism from the specimec taken at different times, and the host’s risk factors Chemotherapy of Nontuberculous Mycobacterial Infections (1) • Chemotherapy of nontuberculous mycobacterial infections has been problematic because of the relative resistance of nontuberculous mycobacteria to a wide range of antibiotics. • Further, because most mycobacteria are intracellular pathogens, the mammalian host cells (e.g., macrophages) serve as a barrier to the delivery of drug to the intracellular environment. • The relative hydrophobicity of nontuberculous mycobacteria is thought to restrict the activity of most hydrophilic drugs. An example is rifabutin, a hydrophobic derivative of rifampin, which has been shown to be effective in prophylaxis and treatment of nontuberculous mycobacterial infections Chemotherapy of Nontuberculous Mycobacterial Infections (2) • There are a number of published guidelines for prophylaxis and treatment of nontuberculous mycobacterial infections, especially directed toward M. avium. These include American Thoracic Society Guidelines on the diagnosis and treatment of disease caused by nontuberculous mycobacteria and the reports of the U.S. Public Health Service Task Force on Prophylaxis and Therapy for M. avium complex. “Guidelines” utilizzate per la cura delle infezioni sostenute dalle più imporanti specie di MNT SPECIE M. avium complex M. kansasii M. xenopi M. malmoense M. marinum PROTOCOLLO TERAPEUTICO Rifampicina + isoniazide + etambutolo; Macrolidi (Claritromicina e/o azitromicina) + rifabutina Rifampicina + isoniazide + etambutolo e/o streptomicina Rifampicina + streptomicina; Rifampicina + isoniazide + etambutolo Rifampicina + isoniazide + etambutolo; Rifampicina + etambutolo + amikacina Minociclina o doxiciclina + trimetoprim; Rifampicina + etambutolo + amikacina Falkinham JO. Clin. Microbiol. Rev. 1996 Antimicrobial activity for the three most frequently isolated species of nonpigmented RGM Antimicrobial agent Species > 90% susceptible or intermediate (% if <100%) < 90% susceptible or intermediate (approx. % susceptibility/intermediate) M. fortuitum group Amikacin, cefoxitin, ciprofloxacin, moxifloxacin, gatifloxacin, imipenem, levofloxacin, linezolid (96%) Clarithromycin (80%), doxycycline (46%), vancomycin (38%) M. abscessus Amikacin (98%), cefoxitin (95%), clarithromycin Ciprofloxacin (<1%), doxycycline (4%), imipenem (57%), linezolid (48%) M. chelonae Amikacin (97%), clarithromycin, moxifloxacin, gatifloxacin (96%), linezolid (94%), tobramycin Ciprofloxacin (19%), doxycycline (26%), imipenem (40%) From: Brown-Elliott and Wallace, CMR, 2002 Diagnosis of mycobacterial infections by conventional procedures DIRECT CULTURE ISOLATION AND IDENTIFICATION DRUG-SUSCEPTIBILITY TESTING INDIRECT MICROSCOPIC EXAMINATION ANTIBODY DETECTION ? Terreni di coltura solidi più comuni per micobatteri Terreno Componenti Agenti inibitori Lowenstein-Jensen (LJ) Proteine di uovo coagulate, Verde malachite sali, glicerolo, fecola di patate (penicillina, e RNA acido nalidixico) Middlebrook 7H10 Sali, vitamine, cofattori, acido Verde oleico, albumina, catalasi, malachite, glicerolo, destrosio, agar cicloesimide, lincomicina, acido nalidixico Middlebrook 7H11 Sali, vitamine, cofattori, acido oleico, albumina, catalasi, glicerolo, destrosio, agar, idrolizzato di casteina Carbenicillina, amfotericina B, polimixina B, trimethoprim Modalità consigliate per la raccolta dei materiali patologici per la ricerca di M. tuberculosis e dei MNT Materiale Modalità di raccolta Numero di campioni Espettorato Primo mattino* con o senza nebulizzazione Uno al giorno per 3/5 giorni Urine Primo mattino* raccolta completa Uno al giorno per 3/5 giorni Liquor Puntura lombare Uno o più se possibile Biopsie Escissioni o incisioni Lente Escissioni o tampone Broncoaspirato Aspirazione di secrezioni bronchiali Succo gastrico Aspirazione di succo gastrico al primo mattino *Non utilizzare raccolte di 24 ore in quanto fortemente contaminate con flora microbica non specidica Metodi di digestione, decontaminazione e concentrazione dei campioni clinici per la ricerca di M. tuberculosis e dei MNT Metodo Commento N-acetil-L-cisteina (NALC) + 2% di NaOH Soluzione decontaminante (NaOH); agente mucolitico (NALC) Ditiotreitolo + 2% NaOH Azione mucolitica più efficace 13% di fosfato trisodico + cloruro Azione antibatterica più blanda di benzalconio Cloruro di cetilpiridinio + 2% NaCl Utilizzato per la spedizione dei campioni 4% di NaOH Per campioni fortemente contaminati 4% di acido solforico Per la decontaminazione dei campioni di urina 5% acido ossalico Elimina Pseudomonas aeruginosa Trattamento dei campioni clinici contenenti micobatteri Espettorato od altro campione clinico contaminato Digestione con sputolisina Campioni extrapolmonari non sterili Decontaminazione con NaOH al 2% (conc. finale) Campioni sterili Centrifugazione a 1500xg Risospendere e lavare 2 volte con PBS pH 7.2; risospendere con BSA priva di acidi grassi (0.2%) Esame microscopico diretto (Ziehl-Neelsen, auramina) Semina in LJ Semina in terreno liquido Sistemi di coltura in terreno liquido per l’isolamento di micobatteri da materiali clinici Metodi radiometrici • BACTEC 460 TB Metodi non radiometrici • BACTEC 9000 MB • Mycobacteria Growth Indicator Tube (MGIT) – MGIT 460 – MGIT 960 – MB/BacT System – ESP Culture System II Journal of Clinical Microbiology, May 1984,vol. 19:720-1 Recovery and susceptibility testing of Mycobacterium tuberculosis from extrapulmonary specimens by the BACTEC radiometric method Fadda G1, Roe SL2 Medical Microbiology Department1, University of Sassari, Sassari, Italy and Becton Dickinson Laboratory Systems2, Mechlin, Belgium Tecnologia a fluorescenza Ruthenium complex Tecnologia a fluorescenza Coltura Positiva Coltura Negativa O2 O2 O2 CO2 O2 O O2 2 CO2 O2 O2 CO2 O2 FO2 FO2FO2 FO2 F F FO FO2F 2FO2 Poca o nessuna fluorescenza Spazio vuoto O2 O2 Brodo O2 Sensore O2 O2 CO2 F F F F FO2 F F F FO2 F Forte fluorescenza BACTEC 9000MB ™ Monitoraggio continuo in fluorescenza, non invasivo Risultati significativamente più veloci rispetto ai terreni solidi Flacone Myco/F Sputa per tutti i campioni Flacone specifico per il sangue Myco/F Lytic 2000 campioni/anno (2040 settimana) Curve, referti di positività Journal of Clinical Microbiology, 1997, 35(8):2072-5 Evaluation of a nonradiometric system (BACTEC 9000 MB) for detection of mycobacteria in human clinical samples Zanetti S2, F. Ardito1, L. Sechi2, M. Sanguinetti1, P. Molicotti2, G. Delogu2, M. P. Pinna2, A. Nacci1, and G. Fadda1 Istituto di Microbiologia1, Universita’ Cattolica del S. Cuore, Rome and Dipartimento di Scienze Biomediche, Sezione di Microbiologia Sperimentale e Clinica2, Universita’ degli Studi di Sassari, Italy MGIT 460 Risultati rapidi Utilizzo semplice Non invasivo e non radiometrico Per laboratori con 120 campioni/settimana Disponibile AST New Microbiologica, 2000, 23 (2): 151-158 Comparison of the Mycobacteria Growth Indicator Tube (MGIT) with radiometric and solid culture for isolation of Mycobacteria from clinical specimens and susceptibility testing of Mycobacterium tuberculosis Ardito F.1, M. Sanguinetti 1, L. Sechi 2, B. Posteraro 1, L. Masucci 1, G. Fadda 1 and Stefania Zanetti 2 Istituto di Microbiologia1, Universita’ Cattolica del S. Cuore, Rome, Centro Cardiologico "Monzino" IRCCS2, Milan and Istituto di Microbiologia C. A. Romanzi, Università di Genova, Genoa, Italy3 BACTEC™ MGIT™ 960 strumento a monitoraggio continuo • Crescita ed Isolamento Antibiogramma in completa automazione (2000) • Utilizza la tecnologia BBL® MGIT™ già esistente • Sicurezza Non utilizzo di aghi provette in plastica • Per laboratori che processano un elevato numero di campioni – fino 8000 colture/anno Hanna, B. A. et al. 1999. Multicenter evaluation of the BACTEC 960 System for recovery of mycobacteria. J. Clin. Microbiol. 37: 782-784. Tortoli E. et al. 1999 Use of BACTEC MGIT 960 for recovery of mycobacteria from clinical specimens: multicenter study. J. Clin. Microbiol. 37: 3578-3582. LA TECNOLOGIA COLORIMETRICA (MB/BacT) •La chimica della crescita microbica – La crescita degli organismi in un brodo di coltura produce una variazione in CO2 – La CO2 abbassa il pH – Il sensore diventa giallo •Il sensore del flacone – Sensore colorimetrico impregnato di silicone – Sensibile ai cambiamenti in CO2 – Cambio di colore permanente • giallo = Positivo Metodi fenotipici di identificazione dei micobatteri – Caratterizzazione del pattern biochimico – Analisi degli acidi micolici della parete micobatterica mediante HPLC e gascromatografia Pattern degli acidi micolici in HPLC di alcune specie micobatteriche A: Mycobacterium asiaticum B: M. bovis C: M. gastri D: M. gordonae E: M. kansasii F M. leprae Da: Butler WR, CMR, 2001 Metodi per la determinazione della sensibilità ai farmaci di M. tuberculosis • Metodo proporzionale (MOP) (metodo di riferimento) • Metodo radiometrico (BACTEC 460 TB) • Metodo MGIT (Mycobacterium Growth Indicator Tube) • E-test (sia M. tuberculosis che NTM) BBL MGIT ® ™ • • 4 ml AST La procedura prevede l’utilizzo di 5 provette MGIT. Le provette contengono quantità standardizzata di antibiotico: STR 0.8 mg/mL INH 0.1 mg/mL RIF 1.0 mg/mL ETH 3.5 mg/mL Controllo di Crescita (GC) New Microbiologica, 2000, 23 (2): 151-158 Comparison of the Mycobacteria Growth Indicator Tube (MGIT) with radiometric and solid culture for isolation of Mycobacteria from clinical specimens and susceptibility testing of Mycobacterium tuberculosis Ardito F.1, M. Sanguinetti 1, L. Sechi 2, B. Posteraro 1, L. Masucci 1, G. Fadda 1 and Stefania Zanetti 2 Istituto di Microbiologia1, Universita’ Cattolica del S. Cuore, Rome, Centro Cardiologico "Monzino" IRCCS2, Milan and Istituto di Microbiologia C. A. Romanzi, Università di Genova, Genoa, Italy3 Antibiogramma automatico SIRE 1. Inoculo SIRE 3. Scaricamento set AST 2. Inserimento Strumento 4. Stampa risultati Ardito, Zanetti, Fadda et al. J. Clin. Microbiol., 2001; Bemer et al.,. J. Clin. Microbiol., 2002 Journal of Clinical Microbiology, December 2001,vol. 39: 4440-4444 Evaluation of the BACTEC Mycobacteria Growth Indicator Tube (MGIT 960) automated system for drug susceptibility testing of Mycobacterium tuberculosis Fausta Ardito1, Brunella Posteraro1, Maurizio Sanguinetti1, Stefania Zanetti2, and Giovanni Fadda1 Istituto di Microbiologia, Università Cattolica del Sacro Cuore, Rome1, and Dipartimento di Scienze Biomediche, Sezione di Microbiologia, Università di Sassari, Sassari2, Italy Principali sequenze geniche utilizzate per l’identificazione di MNT • Gene che codifica la heat shock protein da 65 kDa (hsp65) • Gene che codifica la subunità b dell’RNA polimerasi (rpoB) • Gene che codifica l’RNA ribosomale 16S e sequenze intergeniche 16S-23S (ITS) • Sequenze ripetitive disperse nel genoma Gene che codifica l’RNA ribosomale 16S • E’ la sequenza genica che meglio riflette le relazioni filogenetiche tra i batteri, a causa di un tasso di mutazione basso e costante nel tempo, tanto che può essere considerata un “orologio molecolare”. • Per questo motivo la variabilità interspecifica è piuttosto bassa (per i micobatteri varia dal 94.3 al 100%). • D’altro canto la variabilità intraspecifica è praticamente nulla, a differenza del gene hsp65 e rpoB. • Nell’ambito del gene sono state individuate (Kirschner et al., JCM, 1993; Rogal et al., JGM, 1990) due regioni ipervariabili, A (da 129 a 267 bp) e B (da 430 a 500 bp), la cui analisi consente una valida identificazione delle varie specie di micobatterio. Journal of Clinical Microbiology, June 1998, p.1530-1533 Routine Use of PCR-Reverse Cross-Blot Hybridization Assay for Rapid Identification of Mycobacterium Species Growing in Liquid Media M. SANGUINETTI1, B. POSTERARO1, F. ARDITO1, S. ZANETTI2, A. CINGOLANI3, L. SECHI2, A. DE LUCA3, L. ORTONA3, AND GIOVANNI FADDA1 Istituto di Microbiologia1 and Clinica delle Malattie Infettive3, Universita’ Cattolica del S. Cuore, Rome and Dipartimento di Scienze Biomediche, Sezione di Microbiologia Sperimentale e Clinica2, Universita’ degli Studi di Sassari, Italy PCR-Reverse Cross Blot Hybridization dTTP-tailing and fixing of species-specific Biotine oligonucleotide probes (1-7) to nylon membrane 1 2 3 Incubation with streptavidin-AP and a color substrate 4 5 6 7 PCR with pMyc 14 (5’ biotinilated) and pMyc7 as primers Target DNA Hybridization of biotinilated PCR-product to oligonucleotide probes on nylon membrane 1 2 3 4 5 6 Detection of DNA-DNA hybrids by colored precipitate 7 Analysis by reverse cross-blot hybridization of PCR products from 13 mycobacterial species 1:Mycobacterium tuberculosis, 2: M. avium, 3: M. intracellulare, 4: M. fortuitum, 5: M. gordonae, 6: M. xenopi, 7: M. chelonae, 8: M. genavense, 9: M. kansasii, 10: M. malmoense, 11: M. marinum, 12: M. smegmatis, 13: M. terrae Sanguinetti M., Fadda G., et al. JCM, 1998, 36:1530-3 Journal of Clinical Microbiology, September 2002,vol. 40: 3499-3501 Early detection of negative BACTEC MGIT 960 cultures by PCR-reverse cross blot hybridization assay L. Romano1, M. Sanguinetti1, B. Posteraro1, F. Ardito1, G. Gesu2, A. M. Schito3, and G. Fadda1 Istituto di Microbiologia1, Universita’ Cattolica del S. Cuore, Rome, Centro Cardiologico "Monzino" IRCCS2, Milan and Istituto di Microbiologia C. A. Romanzi, Università di Genova, Genoa, Italy3 PCR-reverse cross blot hybridization as early negative predictor for BACTEC MGIT 960 liquid cultures Time 0 7days 42days SET A 549 clinical samples Inoculation in MGIT 960 SET B Inoculation in MGIT 960 1 ml aliquot was taken and analyzed by PCR-reverse cross hybridization Endpoint Endpoint Da: Romano, Fadda et al. J. Clin. Microbiol., 2002 Comparison of results between MGIT 960 and PCR-reverse cross blot hybridization Clinical specimens Specimens positive by MGIT (65) Specimens negative by MGIT (484) Sensitivity (%) Specificity (%) PPV (%) NPV (%) PCR pos PCR neg PCR pos PCR neg Total (549) 64 1 0 484 98.4 100 100 Respiratory (446) 58 0 0 388 100 100 100 100 6 1 0 96 85.7 100 100 98.9 Non-respiratory (103) 99.8 PPV: Positive predictive value NPV: Negative predictive value From: Romano, Fadda et al. J. Clin. Microbiol., 2002 Br. J. Dermatology, 139, 872-876, 1998 POLYMERASE CHAIN REACTION-REVERSE CROSS-BLOT HYBRIDIZATION ASSAY IN THE DIAGNOSIS OF SPOROTRICHOID MYCOBACTERIUM MARINUM INFECTION POSTERARO B.1, SANGUINETTI M.1, GARCOVICH A.2, ARDITO F.1, ZAMPETTI A.2, MASUCCI L.1, SBORDONI G.2, CERIMELE D.2, FADDA G.1 1Istituto di Microbiologia, e 2Clinica Dermotologica Università Cattolica del S. Cuore, Roma, Italia Nodular lesions on the patient's right dorsal hand Histological section of the skin biopsy Demonstrating dermal inflammation in a perivascular distribution, with tuberculoid granulomas showing a predominance of giant cells From: Posteraro, Fadda et al., Br. J. Dermatol, 1998 Identificazione molecolare di M. marinum From: Posteraro, Fadda et al., Br. J. Dermatol, 1998 Utilità della PCR-Reverse Cross Blot Hybridization per l’identificazione di rare o nuove specie di micobatteri Clonaggio e sequenza del frammento di rDNA 16S amplificato Campione clinico PCR-reverse o ceppo in esame hybridization Sonda genere specifica Identificazione e disegno di una nuova hybridization sonda specie-specifica PCR-reverse Sonda specie specifica Sonda genere specifica Confronto con le sequenze di rDNA del GenBank Identificazione di Mycobacterium triplex mediante PCR-Reverse Cross Blot Hybridization Campione clinico (liquido sinoviale) PCR-reverse hybridization M. avium M. chelonae M. fortuitum M. genavense M. gordonae M. intracell. M. kansasii M. malmoense PCR-reverse M. marinum M. smegmatis hybridization M. triplex M. tuberculosis M. xenopi Mycobacterium spp M. avium M. chelonae M. fortuitum M. genavense M. gordonae Clonaggio e sequenza del M. intracell. M. kansasii frammento di rDNA 16S M. malmoense amplificato M. marinum M. smegmatis M. terrae M. tuberculosis M. xenopi Mycobacterium spp Completa omologia con l’rDNA 16S di M. triplex e disegno di una sonda speciespecifica Confronto con le sequenze di rDNA del GenBank Cingolani, Fadda et al, CID (2000), 31 (1): 177-9 Metodi molecolari utilizzati per la rivelazione della resistenze in M. tuberculosis • Tecniche basate sull’elettroforesi – PCR-SSCP(Single Strand Conformational Polymorphisms) – Analisi degli heteroduplex (DG-DGGE, RNA/RNA mismatch assay) • PCR-DNA sequencing • Tecniche basate sull’ibridazione – Ibridazione in fase solida (Inno LiPA Rif. TB) – Ibridazione in micropiastra – Ibridazione su array • PCR “real-time” – TaqMan probe – Molecular beacons – FRET probes Molecular Epidemiology Sechi LA, Leori G, Lollai SA, Dupre I, Molicotti P, Fadda G, Zanetti S. Different strategies for molecular differentiation of Mycobacterium bovis strains isolated in Sardinia, Italy. Appl Environ Microbiol. 1999 Apr;65(4):1781-5. Sechi LA, Zanetti S, Dupre I, Aceti A, Sanguinetti M, Fadda G. Genotypic changes in DNA fingerprinting patterns of Mycobacterium tuberculosis strains from HIV-positive persons in Sardinia. AIDS. 1998 Oct 22;12(15):2084-6. Cingolani A, Antinori A, Sanguinetti M, Gillini, De Luca A, Posteraro B, Ardito F, Fadda G, Ortona L. Application of molecular methods for detection and transmission analysis of mycobacterium tuberculosis drug resistance in patients attending a reference hospital in Italy. J Infect Dis. 1999 Apr;179(4):1025-9. Sechi LA, Zanetti S, Delogu G, Montinaro B, Sanna A, Fadda G. Molecular epidemiology of Mycobacterium tuberculosis strains isolated from different regions of Italy and Pakistan. J Clin Microbiol. 1996 Jul;34(7):1825-8. DNA Fingerprinting Journal of Clinical Microbiology, Apr. 1993, p 767-770 The Resurgence of Tuberculosis: Is Your Laboratory Ready? FRED C. TENOVER, JACK T. CRAWFORD, ROBIN E. HUEBNER, LARRY J. GEITTER, C. ROBERT HORSBURGH. JR., AND ROBERT C. GOOD CDC Atlanta •RECOMMENDATIONS • Promote the rapid delivery of specimens to the laboratory on a day basis (24h). • Inoculate a liquid medium as primary culture, and include inoculation of a slant of LJ medium. • Identify growth in liquid medium as acid fast and use probes, NAP, mycolic acid patterns or other molecular tests, i. e. PCR reverse hybridization, to identify as M. tuberculosis or MOTT as soon as possible. • Determine the susceptibilities of M. tuberculosis isolates to primary drugs in a BACTEC or similar systems (MGIT). • Maintain up-to-date records • Review all laboratory procedures and facilities to garantee safety of workers. • Acid fast examinations of specimens in 24h (Use a fluorescent acid-fast staining) • Identifications of M. tuberculosis within 10-14 days • Reports of drugs susceptibility test within 15-30 days Università Cattolica del S. Cuore - Roma • Istituto di Microbiologia – G. Fadda – F. Ardito – G. Delogu – B. Posteraro – M. Sanguinetti – L. Romano Università di Sassari • Istituto di Microbiologia e Virologia – S. Zanetti – L. Sechi – P. Molicotti
Scaricare