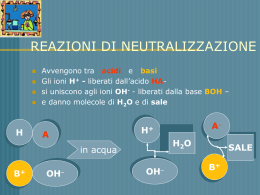
DEFINIZIONE Per durezza dell'acqua si intende un valore che esprime il contenuto di ioni di Ca2+ e Mg2 +, e di eventuali metalli pesanti presenti nell'acqua. Generalmente con questo termine si intende riferirsi alla durezza totale. La durezza permanente esprime invece la quantità di cationi rimasti in soluzione dopo un’ebollizione prolungata; mentre la durezza temporanea, ottenuta per differenza tra le precedenti durezze, esprime sostanzialmente il quantitativo di idrogenocarbonati. SVANTAGGI • DEPOSITI DI CALCARE Gli ioni Ca2+ e Mg2+ formano incrostazioni (il calcare) che provocano problemi rilevanti in molti elettrodomestici e impianti di riscaldamento dove l’acqua riscaldata produce la seguente reazione: Ca(HCO3)2 → CaCO3 + CO2 + H2O • LAVAGGIO DEI TESSUTI Gli ioni di Ca2+ e Mg2+ si uniscono alle molecole di sapone impedendone l’azione, per cui con acque molto dure si dovrà impiegare più sapone per poter pulire. • PORI DELLA PELLE Le particelle presenti nell’acqua possono ostruire i pori della cute determinando l’occlusione dei dotti delle ghiandole provocando reazioni flogistiche delle stesse. L’ADDOLCIMENTO DELL’ACQUA L'addolcimento dell'acqua è una tecnica che favorisce la rimozione degli ioni che inducono l'acqua ad essere dura, nella maggior parte dei casi ioni Ca2+ e Mg 2+. Durante l'addolcimento si possono anche rimuovere ioni di ferro. L'addolcimento dell'acqua è un processo importante, perché si riduce la durezza dell'acqua anche negli impianti domestici e nelle aziende. COME ADDOLCIRE L’ACQUA Per addolcire l'acqua si utilizzano gli addolcitori a scambio ionico. Questi strumenti sostituisco gli ioni Ca2+ e Mg 2+, che sono la causa della durezza dell'acqua, con altri ioni, per esempio Na+ e K+. VANTAGGI DELL’ACQUA ADDOLCITA • L’acqua addolcita scioglie meglio il sapone ed i detersivi, diminuendone il quantitativo necessario. Da qui deriva il risparmio e la salvaguardia dell'ambiente per un minor scarico di sostanze inquinanti, tra i quali i fosfati, che danno luogo all'eutrofia. L'eutrofia e’ quel fenomeno che provoca incontrollabili crescite di alghe nei laghi e nei mari. Elimina la necessità di aggiungere ammorbidenti nella lavatrice per evitare l'infiltramento dei tessuti, causato dal calcare. Oltre al risparmio specifico, si evita di utilizzare prodotti chimici che provocherebbero dei danni alla pelle. Evita di dover usare dei brillantanti nelle lavastoviglie. Le macchioline biancastre sui bicchieri non esisteranno piu’, non essendoci il calcare che le provoca. Con l'acqua addolcita inoltre si elimina l'inconveniente di quel velo biancastro all'interno delle pentole. Anche qui si risparmia e si evita di ingerire delle sostanze, in un certo senso, chimiche. Rappresenta un'ottima "cura di bellezza" perche’ preserva la morbidezza della pelle (avendo eliminato il calcare che ne ostruiva i pori), rende i capelli piu’ morbidi e lucenti, e permette così di risparmiare sull'uso di saponi e shampoo, realizzando un miglior comfort. Migliora il gusto ed il sapore dei cibi e delle bevande. Come mai il caffe’ fatto in casa non e’ cosi’ buono come quello di un bar? Semplice: tutte le macchine espresso dei bar sono corredate di un addolcitore; si preserva nel tempo il buon funzionamento della macchina e si migliora il gusto. Inoltre si risparmia e si esalta il sapore di tutti i cibi. I chimici identificano la presenza di una sostanza aggiungendone un’altra che reagendo produce un composto colorato o un precipitato (sostanza insolubile) che renderà torbida la soluzione. Per essere sicuri, però, che tale reazione sia causata effettivamente dalla presenza della sostanza e non da altri fattori, si effettuano, prima, prove con una soluzione di riferimento (contenente sicuramente la sostanza) e acqua distillata (che sicuramente ne è priva). Confrontando i risultati di tali soluzioni con il campione da esaminare si potrà stabilire la presenza o meno della sostanza. • OBIETTIVO: Osservare la presenza di ioni Ca2+ nell’acqua di rubinetto. • MATERIALE E STRUMENTAZIONE: 1) Provette con porta-provette; 2) 2ml di soluzione contenente ioni Ca2+ 3) 3 gocce di acido acetico CH3COOH 4) 5 gocce di ossalato di sodio Na2C2O4 • PROCEDIMENTO: 1) Si prendono tre provette pulite e si segna la prima con R (riferimento), la seconda con A (H2O distillata) e la terza con C (campione) e si inseriscono sul porta-provette; 2) Si versa nella prima provetta 2 ml di soluzione di riferimento contenente gli ioni Ca2+; •PROCEDIMENTO (parte 2): 3) Si aggiungono 3 gocce di CH3COOH diluito; 4) Si aggiungono ancora 5 gocce di Na2C2O4 - si nota un precipitato biancastro; 5) Analogo procedimento usando H2O distillata – non si nota alcun precipitato; 6) Analogo procedimento usando H2O di rubinetto – la reazione è la seguente: Na2C2O4 + Ca(NO3)2 → NaNO3 + CaC2O4 - si nota che l’H2O diventa leggermente torbida. • CONCLUSIONE: Nell’H2O di rubinetto sono presenti piccole quantità di ioni Ca2+. Per determinare la concentrazione incognita della soluzione espressa in gradi francesi (°F) si usa una soluzione a concentrazione nota contenente una sostanza (EDTA 0,01 M) che ha la capacità di legarsi si agli ioni Ca2+ e Mg2+ che ad un indicatore (Nero Eriocromo T). L’EDTA che si aggiunge, finché trova in soluzione gli ioni, si lega ad essi, ma quando avrà legato tutti gli ioni, si unirà all’indicatore determinando una variazione di colore. Quindi, quando si ottiene una variazione di colore (viraggio dell’indicatore) si raggiunge il punto di equivalenza nel quale si ha: Numero di moli di Ca2+ e Mg2+ = Numero di moli di EDTA • OBIETTIVO: Determinare la concentrazione di ioni Ca2+ espressa in gradi francesi che esprimono la durezza. • MATERIALE E STRUMENTAZIONE: 1) Beuta; 2) 100 ml di H2O di rubinetto 3) 5 ml di soluzione tampone 4) indicatore Nero Eriocromo T 5) Buretta contenente la soluzione di EDTA • PROCEDIMENTO: 1) Si versano in una beuta 50 ml di H2O di rubinetto; 2) Si aggiungono a tale campione 5 ml di una soluzione tampone; 3) Si aggiunge qualche granello di indicatore Nero Eriocromo T; 4) Il livello iniziale delle soluzione di EDTA nella buretta graduata è 13.6 ml; •PROCEDIMENTO (parte 2): 5) Far cadere goccia a goccia la soluzione di EDTA nella beuta fino al viraggio dell’indicatore; 6) Agitare con la mano la beuta, successivamente chiudere il rubinetto; 7) Il livello della soluzione di EDTA nella buretta graduata dopo il viraggio dell’indicatore è di 8ml; 8) Il volume della soluzione consumata è di 5,6 ml; 9) Il numero di moli di Ca2+ e Mg2+ risulta essere uguale al numero di moli di EDTA consumati che equivale ai millilitri di soluzione di EDTA x 0.01 mol/l x 0.001 l/ml •PROCEDIMENTO (parte 3): 10) I milligrammi di CaCO3 in 50 ml di soluzione risultano essere uguali alle moli di Ca2+ e Mg2+ x 100 (peso molecolare di CaCO3) x 1000 che equivalgono alla durezza dell’acqua in gradi francesi. 11) 5.6 ml = 0.0056 l 0.0056 l x 0.01 mol/l = 0.000056 mol 0.000056 mol x 100 g = 0.0056 g 0.0056 g = 5.6 mg 5.6 mg : 50 ml = x : 100 ml x = 11,2 °F • CONCLUSIONE: La concentrazione di ioni Ca2+, che esprime la durezza dell’acqua, è nel nostro esperimento 11.2 °F
Scaricare