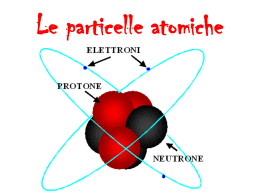
L’ATOMO Cosa si intende per atomo Forse alcuni di voi hanno già sentito parlare dell'atomo, altri meno. Visto che è l'argomento che abbiamo deciso di trattare vorremo spiegarvi brevemente l'oggetto con cui avremo a che fare nelle prossime pagine. Realizzato da: Miceli Roberto & Liuzzo Walter III E L'uomo, gli animali, i vegetali e le cose sono fatti di una materia comune che è in grado di compiere trasformazioni di energia; Nel caso dei primi due queste trasformazioni danno la capacità di compiere azioni. Se mangiamo un panino al salame (che non è capace di muoversi) acquistiamo l'energia che contiene, tramite una trasformazione chimica, e ne ricaviamo l'energia che ci serve per muoverci e compiere azioni. La materia di cui siamo composti è a sua volta formata da particelle piccolissime dette atomi. Gli atomi come vedremo, non sono particelle ultime, ma sono suddivisi in particelle più piccole dotate di una certa quantità di energia. L’origine della teoria atomica e la sua evoluzione La parola atomo deriva dal greco atomos ovvero indivisibile. Fu infatti un filosofo greco del V secolo a.C., Democrito di Abdera, ad elaborare la teoria secondo cui tutte le cose, esseri viventi o non viventi, sono formati da particelle ultime ed indivisibili che costituiscono la materia. Molti filosofi suoi contemporanei, detti fisici pluralisti concordavano sul fatto che gli esseri viventi o non sono composti da elementi ultimi che unendosi danno vita mentre quando si distaccano l'entità muore, non esiste più come tutt'uno. Tuttavia la teoria di Democrito non venne accettata dalla società. Venne ripresa e rielaborata nel 1803 da uno scienziato inglese di nome J.DALTON. Egli a differenza di Democrito, grazie anche a migliori mezzi di sperimentazione, rafforza la teoria dell'esistenza degli atomi con argomentazioni scientifiche ovvero sulla base di misure e dati sperimentali verificabili da chiunque. Il suo scopo è di spiegare il comportamento degli elementi chimici i quali si combinano formando composti chimici (ad esempio il cloro ed il sodio formano il sale da cucina) ecc. e tutto con un'impeccabile regolarità. I punti principali della sua teoria sono i seguenti: tutti i corpi materiali sono costituiti da atomi indivisibili gli atomi di uno stesso elemento chimico (ad esempio l'oro) sono tutti uguali e hanno quindi le stesse proprietà chimiche gli atomi di elementi diversi sono differenti e hanno quindi differenti proprietà chimiche nelle reazioni chimiche gli atomi rimangono inalterati e possono formare diversi composti a seconda del modo in cui si legano gli atomi si combinano tra loro secondo precisi rapporti numerici e formano così le particelle composte gli atomi possono combinarsi tra loro in più rapporti comunque sempre ben definiti. Tuttavia nella teoria di Dalton mancano alcuni particolari: ad esempio non spiega come mai gli atomi si combinano tra di loro, come mai si attraggono a vicenda formando legami così forti da creare dei composti? E secondo quali criteri? In poche parole la risposta sta nel fatto che, come vedremo, gli atomi non sono proprio delle particelle ultime, anzi sono ulteriormente divisibili, ma questo Dalton, con i mezzi a sua disposizione, non poteva saperlo. Tramite esperimenti successivi si scoprì l'esistenza di particelle subatomiche. La prima particella che venne scoperta prese il nome di protone,di carica positiva, e fu ad opera di Goldstein; poi fu il turno dell'elettrone, di carica negativa, ad opera del fisico inglese Thomson nel 1897. Successivamente, nel 1932 fu scoperta da Chadwick la terza particella, il neutrone, che fu comunque postulata in precedenza da Rutherford nel 1920. Una volta scoperte queste particelle si pone un altro problema: rappresentare la struttura dell'atomo. Il primo tentativo fu quello di Thomson: il suo modello viene chiamato "a panettone". Infatti si presenta come una struttura di forma sferica di carica positiva all'interno della quale sono incastonate le particelle di carica negativa, come l’uvetta nel panettone. Gli elettroni di carica negativa incastonati in una struttura di carica positiva L'atomo di Rutherford invece presenta una struttura di forma sferica e di carica positiva al centro ed una nube di carica negativa tutt'intorno contenente atomi che girano intorno al nucleo secondo orbite circolari. Il nucleo composto di protoni con intorno una nube di carica negativa Questo modello verrà pian piano perfezionato. Il modello atomico di Niels Bohr e la teoria dei quanti di energia Sempre dopo osservazioni su fenomeni sperimentati si arriva ad un nuovo modello atomico. Niels Bohr elabora nel 1913 una teoria secondo la quale nel nucleo sono concentrati i protoni che, come abbiamo già detto, sono dotati di una carica positiva. Intorno al nucleo "orbitano" ovvero girano gli elettroni, dotati di carica negativa. Avendo cariche diverse (positiva indicata col segno + per i protoni, negativa indicata col segno - per gli elettroni), le due particelle si attraggono a vicenda, impedendo le une alle altre di disperdersi liberamente. Gli elettroni seguono solo determinate traiettorie, fisse e circolari, come quelle dei pianeti intorno al sole, dette "orbite stazionarie". Ogni atomo ha al suo interno la stessa quantità di elettroni e di protoni (ad esempio 4 elettroni e 4 protoni). Ma gli atomi non sono tutti uguali. Infatti ci sono atomi di ossigeno, di ferro, di cloro, di argento e tantissimi altri. Questi sono elementi. Gli atomi di elementi diversi hanno un diverso numero di particelle gli uni dagli altri (esempio l'ossigeno ha 8 protoni e 8 elettroni, mentre il ferro ha 26 protoni e 26 elettroni). Gli elettroni di un elemento con una maggiore quantità di particelle hanno una maggiore quantità di orbite, con diversi livelli di energia. Ogni orbita possiede un determinato livello di energia, ovvero un elettrone per poter girare intorno al nucleo seguendo SEMPRE la stessa orbita deve possedere perciò SEMPRE la stessa quantità di energia. Un elettrone, per passare da un orbita all'altra ha bisogno che gli venga fornita una certa quantità di energia, non una qualsiasi, ma una precisa quantità. Una quantità di energia detta genericamente QUANTO. Il quanto è un'unità multiplo di una costante fondamentale detto QUANTO DI AZIONE. Perciò diciamo che le orbite sono "quantizzate". Tuttavia la teoria di Bohr tralascia un particolare importante: se le particelle che posseggono cariche diverse (positiva e negativa) si attraggono a vicenda perché gli elettroni non cadono sul nucleo ma si limitano a girarvi intorno? E poi, così come cariche diverse si attraggono così cariche uguali si respingono: come fanno allora i protoni a stare insieme nel nucleo? Inoltre perché per passare da un'orbita all'altra hanno bisogno di aggiungere alla propria energia per forza quella quantità chiamata QUANTO e non una leggermente minore o leggermente maggiore? Per rispondere alla prima domanda possiamo limitarci a rileggere più su, nelle righe in cui sono elencate le date in cui vennero scoperte le particelle che compongono l'atomo: la terza particella fu scoperta nel 1932, quindi successivamente al modello atomico di Bohr. Questa famosa terza particella è il neutrone, che non ha né carica positiva né negativa, ma è NEUTRA. Il neutrone è contenuto nel nucleo e svolge una doppia funzione. Se non fosse per i neutroni i protoni si respingerebbero l'uno dall'altro in quanto hanno la stessa carica mentre gli elettroni verrebbero attratti dalle particelle di carica positiva, collidendo su di esse. In poche parole i neutroni bilanciano le cariche dell'atomo. Per rispondere alla seconda domanda dobbiamo analizzare un altro punto dell’evoluzione della teoria atomica La teoria ondulatoria, gli orbitali e la configurazione elettronica Nel 1923 uno studioso di nome Louis De Broglie stava svolgendo degli studi sulla luce; osservò che la luce ha proprietà ondulatorie ovvero si espande nell'aria come un'onda nel mare: se tiriamo un sassolino in acqua noteremo come si formano delle ondine che si espandono circolarmente. Più o meno lo stesso comportamento lo ha la luce. La luce però è una forma di energia; De Broglie ipotizzò che questa fosse una proprietà universale, e quindi anche della materia. Le onde associate con l'elettrone e con QUALSIASI ALTRO CORPO IN MOVIMENTO vengono definite onde di materia. Gli elettroni quindi si muovono intorno al nucleo dell'atomo secondo orbite circolari ma compiono un'altra operazione: seguono la propria orbita "ondulando". Vi faccio un esempio concreto. Un atleta sta correndo su una pista circolare dove ogni 60 metri c'è un ostacolo da saltare. L'ostacolista deve compiere dieci giri di seguito. Quindi deve compiere un salto ogni dieci secondi per dieci giri consecutivi. Perciò egli deve mantenere costante la velocità con cui corre e deve saltare a intervalli di tempo REGOLARI; altrimenti rischia di saltare troppo presto o troppo tardi non riuscendo a compiere i giri con regolarità e buttando giù gli ostacoli. Il caso dell'atomo è più o meno lo stesso, comunque per maggiore chiarezza lo rappresento il concetto graficamente: Un elettrone, per passare ad un'orbita superiore ha bisogno di ricevere un QUANTO di energia, né più né meno, in quanto è l'energia che gli permette di girare intorno ad un'orbita compiendo una quantità di ondulazioni complete. Mi spiego meglio. Se gli fornissimo l'energia sufficiente a compiere 20 ondulazioni e mezzo il ciclo sarebbe irregolare. Di qui la necessità del QUANTO. Continuando questi studi si arrivò nel 1927 ad affermare che non possiamo in realtà definire orbite precise che l'elettrone compie. Secondo Heisenberg possiamo solamente considerare una zona in cui la probabilità di trovare l'elettrone sia massima. Al concetto di orbita si sostituisce quello di "orbitale" ovvero una zona, una nube elettronica dove possiamo essere certi che quell'elettrone si trovi. La nube elettronica però non è una sola bensì una per ogni elettrone, o quasi. Infatti, come aveva postulato in precedenza Bohr, le orbite hanno un preciso livello energetico; anche gli orbitali hanno un preciso livello energetico. Gli orbitali si indicano con lettere dell'alfabeto; in natura gli elettroni arrivano a riempire solo i primi 4 (su 7) che si indicano con le lettere s, p, d, f; questi hanno anche forme diverse e, come ho già detto, non contengono un solo elettrone ma più di uno, a partire dai due contenuti nell'orbitale s. Un orbitale però può essere diviso in sottolivelli, anzi più correttamente in sezioni, aventi comunque lo stesso livello energetico, ma posizionati su assi diversi. Ogni sezione può contenere solo due elettroni che però girano intorno al proprio asse (come fa la Terra intorno al proprio asse) uno in senso orario uno in senso antiorario. A seconda del numero di particelle contenenti in un certo elemento ( ad esempio l'atomo di ferro) gli orbitali vengono riempiti fino ad un certo punto, e ne rimangono anche di vuoti. È per questo che atomi di elementi diversi si uniscono per fare composti: il nucleo (di carica positiva) di un atomo di ferro (per fare un esempio) potrebbe attrarre l'elettrone (di carica negativa) di un altro elemento formando così un composto. Gli elementi in natura sono 92 più altri 11 creati in laboratorio; per conoscerli tutti bisognerebbe avere davanti una "tavola periodica", ma penso che questo argomento non sia di vitale importanza al momento, visto che l'argomento da noi trattato è l'atomo. In realtà la teoria atomica è molto complessa ed in continua evoluzione. L’ATOMO FINE PRESENTAZIONE Realizzato da: Miceli Roberto & Liuzzo Walter III E
Scarica