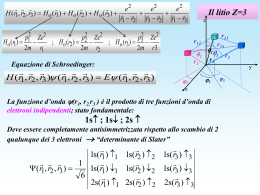
. Alcalini Shell atomi alcalini Shell K L Li 1s2 [He] 2s Na 1s2 2s2 2p6 M N O P 3s [Ne] K 1s2 2s2 2p6 3s2 3p6 [Ar] 4s Rb 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 [Kr] 5s Cs 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 [†e] 6s pi2 Ze 2 e2 H [ ] 2m 40 ri i j 4 0 rij Campo medio centrale 2 i 2 p Ze H [ (ri )] 2m 4 0 ri i (ri ) e 2 dr j i (rj ) j 2 ri r j Ze 2 V (ri ) (ri ) 4 0 ri (ri ) (ri ) Rn i l i (ri )Yli mi ( i ,i ) Si msi Campo medio centrale i i Gli orbitali degli atomi polielettronici • Gli orbitali degli atomi polielettronici sono qualitativamente simili a quelli dell’atomo di idrogeno • Valgono gli stessi numeri quantici n, l e ml Livelli energetici negli atomi polielettronici L’energia dei diversi orbitali degli atomi polielettronici non dipende soltanto dal numero quantico principale n, ma anche da quello secondario l • A parità di n, l’energia dei diversi orbitali varia nell’ordine: s <p<d<f… • Il valore dell’energia dei livelli successivi varia al variare del numero atomico Z Atomi poliettronici 4 Modellizzazione della funzione d’onda del litio con un potenziale medio di schermo Si può trattare la funzione d’onda del litio come prodotto di una funzione d’onda che descrive i due elettroni in singoletto di spin sullo stato 1s (shell chiusa dell’elio, [He]) per la funzione d’onda del terzo elettrone sull’orbitale 2s o sull’orbitale generico nl: |1s> n=1, l=0 (r1 , r2 , r3 ) =[He(r1 , r2)] |nl(r3)> Distribuzione sferica Sub-shell chiusa La shell chiusa dei due elettroni interni crea uno schermo della carica elettrica del nucleo La carica elettrica del nucleo viene vista non con la sua Z reale ma con una “Z efficace” |2s> n=2, l=0 Modellizzazione della funzione d’onda del litio con un potenziale medio di schermo: stato 2s Funzione d'onda calcolo analitico orbitale 1s blu - numerov rosso scuro 2,0 1,5 1s 1,0 2s (l=0) con schermo ~ 1,8 0,5 0,0 -0,5 -1,580 Energia (eV) Lo schermo dei 2 elettroni sull’orbitale interno 1s è maggiore sullo stato 2p rispetto allo stato 2s: E2s=-5,4 eV Zeff ~ 1,26 D(r)=rf(r) -1,0 r (angstrom) 70 -2,0 60 0,0 2,0 50 Potenziale coulombiano (verde), 4,0 6,0 di schermo 8,0 (rosso), 10,0 centrifugo (fucsia), totale (viola) 40 30 20 E2s 10 0 -10 -20 -30 0,0 1,0 2,0 3,0 r (angstrom) 4,0 5,0 6,0 Modellizzazione della funzione d’onda del litio con un potenziale medio di schermo: stato 2p Funzione d'onda calcolo analitico orbitale 1s blu - numerov rosso scuro 2,0 1,5 1s 2p (l=1) con schermo ~ 1,97 1,0 0,5 0,0 -0,5 -1,0 80 -1,5 Energia (eV) Lo schermo dei 2 elettroni sull’orbitale interno 1s è maggiore sullo stato 2p rispetto allo stato 2s: E2p=-3,6 eV Zeff ~ 1,06 70 -2,0 600,0 r (angstrom) 2,0 50 Potenziale coulombiano (verde), 10,0 4,0 6,0 8,0 centrifugo (fucsia), di schermo (rosso), totale (viola) 40 30 20 10 0 -10 -20 E2p -30 0,0 1,0 2,0 3,0 r (angstrom) 4,0 5,0 6,0 Difetti quantici Le energie dei livelli dell’elettrone ottico si calcolano come E nl R dove Dnl viene chiamato difetto quantico e tiene conto della penetrazione 2 (n nl ) In generale Dnl : a) diminuisce all’aumentare di l; b) A parità di l non deve variare (diminuire) molto) al variare di n E nl l=0 1 2 3 4 Li (n=2) 0.4 0.04 0 0 0 Na (n=3) 1.35 0.85 0.01 0 0 K (n=4) 2.19 1.71 0.25 0 0 Rb (n=5) 3.13 2.66 1.34 0.01 0 R Z eff (n,l) la penetrazione viene anche espressa tramite una Zeff(n,l) 2 n Invece Zeff(n,l) tende a 1 (per atomi neutri) al crescere di n e l. H Z=1 Li++ Z=3 Livelli energetici - Zeff diminuisce al crescere di n e, a parità di n, al crescere di l; - tende a 1 per grandi l schermo completo (stessa energia dell’elettrone dell’atomo di idrogeno) 2 Z eff ,nl E nl R n2 E4f= -0,85 eV E4d= -0,85 eV E4p= -0,87 eV E4s= -1,05 eV E4,H= -0,85 eV E4,Li++= -7,65 eV E3d= -1,51 eV E3p= -1,55 eV E3s= -2,01 eV E3,H= -1,51 eV E3,Li++= -13,6 eV E2p= -3,6 eV E2s= -5,4 eV E2,H= -3,4 eV E2,Li++= -30,6 eV Penetrazione delle orbite Penetrazione orbitale più esterno nel core Effetto sulle energie elettroniche E (eV) H E (eV) Li 0 0 -1 -2 4 4s 4p 3 4d 4f 3d 3p -3 3s -2 -3 -4 -4 -5 -1 Litio: Z=3 atomo “alcalino” -1 solo elettrone fuori della shell chiusa del [He] -2 elettroni sull’orbitale 1s -5 2 2p -6 -6 2p+ 2po 2p- 2s configurazione elettronica del Li nello stato 1s fondamentale 2s idrogeno - litio Somiglianze e differenze fra H e Li -H e Li hanno una configurazione elettronica simile per l’elettrone di valenza: 1 elettrone in un orbitale s - entrambi si legano bene all’ossidrile OH 2p+ 2po 2p- 2s configurazione elettronica del Li nello stato fondamentale (LiOH ha importanti applicazioni, ad es. nelle pile alcaline) però: - l’elettrone di valenza del Li ha minore energia di legame - ha un livello eccitato 2p con energia poco diversa e molti stati disponibili (6) ciò fa sì che: - il Li sia un solido metallico (“litium” perché si trova nelle rocce), mentre l’idrogeno è un gas - si trova facilmente in uno stato eccitato anche a temperatura ambiente 1s 2s 1s 2p+ 2po 2p- configurazione elettronica dell’idrogeno nello stato fondamentale E (eV) H E (eV) Li 0 nel lontano IR, Dn=0, D1=1 -1 4 -2 3 4s 4d 4p 4f 3d 3s -1 -2 nell’IR, Dn=0, D1=1 -4 -4 -5 2 2p -6 -6 nel visibile, Dn=0, D1=1, rossa, molto intensa 2s Transizioni nel litio 2p+ 2po 2p- 2s configurazione -3 3p -3 -5 0 elettronica del Li nel primo stato 1s eccitato: i tre stati 2p+, 2po, 2p- sono degeneri E (eV) H Li E (eV) Na 0 0 -1 -2 4 4s 4p 3 4d 4d 4p 3d 3d 3p -3 3s -5 -2 -4 -4 3p 2 -5 2p -6 -6 3s 2s idrogeno - litio - sodio Na Z=11 -1 -3 4s Il sodio atomo “alcalino” - 1 solo elettrone fuori della shell chiusa del [Ne] -bassa energia di ionizzazione E = -5,1 eV - livelli energetici simili a quelli del Li E (eV) splitting dei livelli del sodio 0 DE 10-6eV -1 4d5/2 4d3/2 -2 DE 7·10-4eV 4p3/2 -3 DE 4s1/2 -4 -5 3d5/2 4p1/2 DE 2·10-3eV -6 3s1/2 3p3/2 3p1/2 6·10-5eV Perché la linea gialla del sodio è sdoppiata? 3d3/2 Accoppiamento di spin-orbita: il “buon numero quantico” è il momento angolare totale j dell’elettrone che può avere due valori a parità di l: j=l+1/2 j=l-1/2 Negli atomi, - l’effetto sull’energia è piccolo (accoppiamento magnetico fra il momento magnetico di spin e il campo magnetico visto dall’elettrone in moto, per effetto della trasformazione di Lorentz del campo coulombiano) - lo stato j=l-1/2 ha energia minore E (eV) principali transizioni radiative del sodio 0 DE 10-6eV -1 4d5/2 4d3/2 -2 DE 4p3/2 7·10-4eV 3d5/2 4p1/2 3d3/2 -3 DE 6·10-5eV 4s1/2 proibita in dipolo elettrico -4 3p3/2 -5 DE 2·10-3eV 3p1/2 -6 3s1/2 praticamente coincidenti in energia linea “D” doppietto giallo del sodio Regole di selezione di dipolo elettrico: Dl =1 D ml = 0, 1 D S= 0 D ms = 0 D j = 0, 1
Scaricare