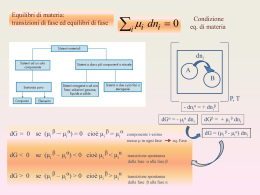
ABBASSAMENTO DELLA TENSIONE DI VAPORE: LA LEGGE DI RAOULT Una sostanza che ha pressione di vapore non misurabile si dice non volatile. Le p di vapore dei solventi puri sono sempre più alte delle p di vapore delle loro soluzioni. Tanto più soluto c’è, tanto più si abbassa p di vapore. PA = AP°A A frazione molare del solvente P°A p di vapore del solvente puro P°A- PA P°A = B La legge è valida se le interazioni solventesolvente sono identiche a quelle solutosolvente. Le soluzioni che seguono la legge di Raoult si chiamano SOLUZIONI IDEALI Hmesc=0 LEGGE DI RAOULT PER SOLUZIONI DI DUE LIQUIDI MISCIBILI Se A e B hanno tensioni di vapore misurabili allora, la p di vapore della soluzione sarà P = AP°A + BP°B A B A+B benzene metilbenzene CH 3 SOLUZIONE IDEALE Caratteristiche e interazioni simili La maggior parte delle soluzioni non sono ideali Le interazioni tra A e B sono diverse da quelle AA e BB SOLUZIONE REALE Deviazione dalla legge di Raoult, Hmesc≠0 Soluzioni Non Ideali-Deviazioni dalla legge di Raoult T costante Deviazione positiva Le interazioni AA e BB nei liquidi puri sono più forti di quelle AB (Hmesc>0) Deviazione negativa Le interazioni AB sono molto più forti di quelle AA e BB presenti nei liquidi puri (H<0) Soluzioni molto diluite possono essere considerate ideali
Scaricare