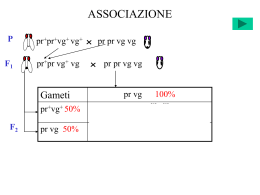
Determinazione cromosomica del sesso XY ½Ye ½X ½ XY XX ZW tutti X ½ We ½ Z ½ XX ½ WZ ZZ tutti Z ½ ZZ Eredità legata al sesso P XW XW Xw Y P Xw Xw XW Y F1 XW Xw XW Y F1 XW Xw Xw Y F2 Gameti XW 1/2 XW 1/2 XWXW 1/4 Xw 1/2 Y 1/2 Gameti Xw 1/2 XWY 1/4 XW 1/2 XWXw 1/4 XwXW Xw Y 1/4 1/4 Xw F2 1/2 Y 1/2 XWY 1/4 XwXw Xw Y 1/4 1/4 EREDITA’ LEGATA AL SESSO NELL’UOMO XX XY XY XX XY XX XY XY XX XX XY XY XX XX XY XX XX XY XY XX XX XY XY XX XY XY XX XY XY XX XY XX XY XX XY XY XY XX Eredità non nucleare Fenotipi parentali Anche questo albero genealogico, in cui il carattere è trasmesso esclusivamente dalla madri ai figli di ambo i sessi, testimonia di un’eredità citoplasmatica (mitocondri) Fenotipi della F1 I risultati di questi 9 incroci dimostrano che il carattere “colore della foglia” è trasmesso alla progenie solo dall’ovulo: quindi è determinato da geni citoplasmatici (nei cloroplasti) ASSOCIAZIONE P pr+pr+vg+ vg+ F1 pr+pr vg+ vg Gameti F2 pr pr vg vg pr pr vg vg pr vg 100% pr+vg+ 50% pr+ pr vg+ vg 25% +25% pr vg 50% pr pr vg vg 25% +25% ASSOCIAZIONE E SCAMBIO P pr+pr+vg+ vg+ F1 pr+pr vg+ vg Gameti F2 pr pr vg vg pr pr vg vg pr vg 100% pr+vg+ 44% pr+ pr vg+ vg 22% +22% pr vg 44% pr pr vg vg 22% +22% pr+vg 6% pr+ pr vg vg 3% +3% prvg+ 6% pr pr vg+ vg 3% +3% ASSOCIAZIONE e CROSSING-OVER: GAMETI due o più geni sullo stesso cromosoma a b GAMETI a b ab a ab senza crossing over b dopo crossing over ab a a b b ANAFASE 2 A A A B B B B aB a a A A b B anche gameti b ricombinanti B ANAFASE 2 A AB A a B AB b Ab Solo gameti parentali A AB B Crossing-over, ricombinazione e chiasmi. GAMETI a b ab a a A A b b B B chiasma Crossing over a a A A a B aB ANAFASE 1 ANAFASE 2 b b B B DIPLOTENE A terminalizzazione del chiasma METAFASE b Ab A AB B ASSOCIAZIONE E SCAMBIO 2 P b+b+vg+ vg+ F1 b+b vg+ vg b b vg vg b b vg vg b vg Gameti F2 100% b+vg+ 40% b+ b vg+ vg 20% +20% b vg 40% b b vg vg 20% +20% b+vg 10% b+ b vg vg 5% +5% b vg+ 10% b b vg+ vg 5% +5% crossing over = scambio di segmenti di cromosomi Wx C wx c wx c wx c assenza di crossing over crossing over Wx C wx C wx c wx c wx c Wx c wx c wx c Distanza tra i geni e frequenza di ricombinanti A A a a A A B B b b D D a d a d AB Ab aB ab AB AD Ad aD ad AD Ad aD ad ab Maggiore è la distanza tra i geni, più alta è la probabilità che fra di essi vi sia un crossing over, più alta è la frequenza di ricombinanti fra loro. SAGGIO A TRE PUNTI v+v cv+ cv ct+ct v v cv+ ct+ vv v+ v+v cv ct v cv ct+ vv vv cvcv ctct cv ct cv+cv ct+ ct 580 cvcv ct ct 592 cvcv ct+ ct 45 v+ cv+ ct v+v cv+cv ct ct 40 v vv cvcv ct ct 89 cv+cv ct+ct 94 cv ct v+ cv+ ct+ v+v v cv+ v+ cv ct vv cv+cv ct+ v+v cvcv ct ct 3 ct+ ct 5 268/1448 Ricombinanti per v e cv (18,5%) 191/1448 Ricombinanti per v e ct (13,2%) 93/1448 Ricombinanti per cv e ct (6,4%) Ordinamento lineare dei geni v v v+ v+ ct+ ct+ ct ct cv+ cv+ cv cv misura la distanza v-ct: 13,2 u.m. misura la distanza ct-cv: 6,4 u.m. v ct cv v+ ct+ cv+ 12,6% v ct+ cv v+ ct cv+ 5,9% v ct cv+ v+ ct+ cv 0,55% 0,84% atteso 268/1448 Ricombinanti per v e cv (18,5%) 191/1448 Ricombinanti per v e ct (13,2%) 93/1448 coeff. di coincidenza 0,65 atteso Interferenza (I) = 1-c.d.c = 0,35 Ricombinanti per cv e ct (6,4%) Analisi delle tetradi ordinate I centromeri e i geni per cui non c’è stato crossing over segregano in prima divisione meiotica (segreganti MI: a 2 gruppi di 4 spore) a a a a a A A Prima divisione meiotica a a Seconda divisione meiotica Mitosi A A A A A A duplicazione Il crossing over nelle tetradi ordinate:ipotesi del crossing over prima della duplicazione IPOTESI: il crossing over avviene prima della replicazione e coinvolge 4 cromatidi su 4 A A A A a A A a Aa Prima divisione meiotica A A Seconda divisione meiotica I geni per cui c’è stato aun crossing Mitosi a a over segregano anche aessi in prima a divisione meiotica (segreganti a MI);questa ipotesi non prevede in nessun caso la segregazione in MII, duplicazione cioè 4 gruppi di 2 Il crossing over nelle tetradi ordinate I geni per cui c’è stato un crossing over segregano in seconda divisione meiotica (segreganti MII) a a a A Poiché effettivamente si osserva a la segregazione inPrima MII, se ne a divisioneover concludeA che il crossing meiotica A avviene dopo la replicazione e coinvolge due cromatidi su a quattro A A Seconda divisione meiotica Mitosi a a A La distanza tra il centromero e il locus è data dalla frequenza dei segreganti MII : 2 A A duplicazione Segregazione di geni lontani dal centromero b b+ b b+ b b+ b b+ b b+ b+ b La frequenza massima di segreganti MII di geni molto lontani dal centromero e che quindi segregano indipendentemente è pari a 2/3. Distanza tra geni sullo stesso braccio cromosomico Sia il gene A che il gene B segregano in seconda divisione meiotica (segreganti MII) a a A A b b B B Se A e B sono sullo stesso braccio dello stesso cromosoma sono possibili solo queste due modalità di segregazione Il gene A segrega in prima divisione meiotica (segregante MI) Il gene B segrega in seconda divisione meiotica(segreganti MII) a a A A b b B B La distanza tra A e B è data dalla frequenza di questi segreganti : 2 Distanza tra geni su due bracci dello stesso cromosoma Solo il gene B segrega in seconda divisione meiotica (segreganti MII) b b B B c c C C Se B e C sono su due bracci diversi dello stesso cromosoma sono possibili solo queste due modalità di segregazione Solo il gene C segrega in seconda divisione meiotica (segreganti MII) b b B B c c C C Le distanze tra B e il centromero e fra C e il centromero sono date dalle frequenze di questi segreganti : 2 Distanza tra geni sul due cromosomi Il gene B segrega in seconda divisione meiotica (segreganti MII); il gene D segrega in prima divisione meiotica (segregante bMI). Il gene B segrega in prima divisione meiotica (segregante MI); il gene D segrega in seconda divisione meiotica(segreganti MII) Se A e B sono su due cromosomi diversisono possibili solo queste due modalità di segregazione Le distanze tra B e il proprio centromero e fra C e il proprio centromero sono date dalle frequenze di questi segreganti : 2 b B B d d D D B B b b d d D D Segregazione indipendente tra geni su due cromosomi B B b b d d D D a a A A c c C C b b B B d d D D Doppi crossing over tra due-tre-quattro filamenti A A B B D D a b d B B D D a a b b d d A A B B D D a b d a A A a A b b B d d D Doppio c.o. a due filamenti ABD AbD a Bd a b d Parentale Ricombinante doppio Ricombinante doppio Parentale Doppio c.o. a tre filamenti ABd AbD a BD a b d Ricombinante Ricombinante doppio Ricombinante Parentale ABD Abd a Bd a b D Parentale Ricombinante Ricombinante doppio Ricombinante Doppio c.o. a tre filamenti Ricombinante ABd Doppio c.o. Ricombinante Abd A B D a quattro Ricombinante a BD a b d filamenti Ricombinante a b d a b D Le quattro combinazioni di doppi crossing over sono equiprobabili (non c’è interferenza Ogni crossing over può interessare con pari probabilità ciascuna delle possibili cromatidica) la frequenza ricombinanti fra A e D è del 50 %, come dopo un crossing coppie di cromatidi di un bivalente che siano omologhi ma non fratelli over singolo Coniugazione batterica I ceppi F+ infettano solo ceppi F-, trasformandoli in F+ e inducendo ricombinazione a bassa frequenza, tramite il passaggio di una copia del fattore F F+ F- Hfr F- Hfr F- F+ I ceppi Hfr derivano, a bassa frequenza, dai ceppi ricombinazione F ricombinante F+; non infettano i ceppi F- ma inducono, solo in essi, ricombinazione ad alta frequenza ricombinazione F- ricombinante I ceppi Hfr trasferiscono integralmente o in parte una copia del proprio cromosoma La ricombinazione non è reciproca: alcuni alleli del cromosoma del batterio ricevente vengono sostituiti dagli alleli corrispondenti provenienti dal cromosoma del ceppo Hfr; non si forma la combinazione complementare F+ F- F+ Dai ceppi Hfr si possono formare, a bassa frequenza, cellule F+, capaci di trasformare i batteri F- in F+; dunque il fattore F si era integrato nel cromosoma batterico (Hfr) ma se ne può dissociare L’organizzazione del cromosoma batterico: gli esperimenti di coniugazione interrotta In uno stesso ceppo Hfr l’ordine di trasferimento dei geni è costante e si presenta un gradiente di probabilità di ricombinazione dei diversi geni: i cromosomi vengono trasferiti in forma lineare sempre a partire dallo stesso punto ma per segmenti di differente lunghezza; è possibile mappare linearmente i geni per gradiente di trasferimento g a Diversi ceppi Hfr presentano diversi b f ordini di trasferimento, che però sono a c g tra loro permutazioni circolari; ed b dunque il cromosoma batterico in f c g a origine è circolare e il fattore F si può b ed inserire in punti diversi f c g a ed Vi sono ceppi Hfr che trasmettono i geni b in ordine inverso rispetto ad altri; f dunque il fattore F ha una polarità che c determina l’ordine del trasferimento dei g a ed geni e può inserirsi nello stesso punto b con polarità opposte f c ed A A B B a a a b c b c b c de f de g a b c de g b c de a g f f de f g a b c f ed g a b c de f c b g a Coniugazione batterica: interpretazione Il fattore di fertilità F è un plasmide che può essere trasmesso da un batterio Escheirichia coli che lo possiede (F+) a uno che ne è sprovvisto (F-), che così diventa, a sua volta, F+ il fattore F può integrarsi nel cromosoma, mediante uno scambio; i ceppi con il fattore F integrato hanno un’alta frequenza di ricombinazione (Hfr) FF+ F+ I batteri Hfr possono passare, del tutto o in parte, una copia del loro cromosoma, in forma lineare, a un batterio FF+ FHfr I batteri Hfr, mediante uno scambio, possono rilasciare dal proprio cromosoma il fattore F; talvolta nel plasmide può essere incorporato un piccolo segmento del cromosoma; un plasmide così costituito viene chiamato F’ F’ Hfr Hfr I meccanismi di ricombinazione nella coniugazione batterica esogenote strR strS strS strR strR strS Il batterio Fmentre ha al proprio interno il segmento cromosomico lineare proveniente dall’Hfr viene chiamato merozigote Un solo crossing over (o un numero dispari) produce un cromosoma lineare, non vitale endogenote Due crossing over (o un numero pari) producono un cromosoma circolare ricombinante, vitale e un frammento lineare ricombinante, non vitale Il plasmide F’, contenendo alcuni geni batterici, determina nel batterio che lo contiene una condizione di merodiploidia A a Il plasmide F’ si reinserisce con alta frequenza nel cromosoma batterico e sempre nello stesso sito, la regione omologa ai geni batterici che ha incorporato, attraverso un crossing over Mappatura dei geni batterici attraverso la frequenza di ricombinazione dopo coniugazione Hfr x FSi selezionano i geni più tardivi (A) A B C a b c A B C a b c A B C a b c A B C a b c Abc Deriva da 2 c.o., di cui una fra A e B, di cui misura la distanza ABc Deriva da 2 c.o., di cui una fra B e C, di cui misura la distanza ABC Deriva da 2 c.o. esterni alla regione in esame: la frequenza non è informativa delle distanze fra i geni studiati Deriva da 4 c.o.: rarissimo, AbC identifica il gene mediano Ciclo litico (fagi T pari) e ciclo lisogeno (fagi temperati) Ciclo lisogeno I batteri che hanno incorporato il cromosoma virale nel proprio si moltiplicano integrazione induzione Nota: il cromosoma del fago è rappresentato in forma circolareanche nel capside, anche se circolarizza solo entro la cellula batterica Ciclo litico Infezione mista e ricombinazione nei fagi virulenti Nota: il cromosoma del fago è rappresentato in forma circolareanche anche nel capside, anche se circolarizza solo entro la cellula batterica r+ h- rhr+ rh+ h+ Trasduzione generalizzata: fago P1 in Escheirichia coli Si seleziona per un marcatore sul frammento trasdotto (lungo al massimo come il cromosoma di un fago) e si misura la vicinanza a 2 a 2 dei geni come frequenza di cotrasduzione Se seleziono A, A è cotrasdotto con B più che con C, che quindi non è in mezzo; se seleziono B, B è cotrasdotto con frequenze simili con A e C; quindi A non è in mezzo: in mezzo è B Si misurano quindi le distanze AB e BC direttamente dalla frequenza di cotrasduzione A B C a b c A B C a b c cotr BC cotr AB A B C a b c A B C a b c Cotr AB, BC, AC Cotr AC raro Trasduzione specializzata nel fago l 2 2 1 gal bio gal l dgal 2 2 gal TS 1 gal bio bio 2 gal- I gal 1 gal- gal bio bio l dgal l helper Analisi fine del gene: ricombinazione intragenica Ceppo B Non infetta il ceppo K Non infetta il ceppo K rII A Non infetta il ceppo K Infetta il ceppo K La frequenza di ricombinazione si calcola come frequenza di virus capaci di infettare E. coli ceppo K x 2 sul totale dei virus dello stesso lisato capaci di infettare il ceppo B La frequenza minima di ricombinazione intragenica è pari allo 0,01%; quindi il gene è costituito da subunità di dimensione costante che possono ricombinare fra loro; tali subunità hanno la dimensione di 1 nucleotide; la mappa dei siti ricombinabili entro un gene è ancora lineare Mappatura per delezione di siti mutabili Esistono mutazioni che non possono ricombinare con altre mutazioni nello stesso gene: si tratta di delezioni 4 Cromosoma normale 3 5 1 2 6 7 1 2 6 7 Cromosoma con delezione del segmento che contiene i siti mutabili 3, 4 e 5; per questi siti non vi può essere ricombinazione con il cromosoma normale Se si dispone di un numero adeguato di delezioni si può suddividere il gene in regioni caratterizzate dalle sovrapposizioni di diverse delezioni, cui si possono assegnare i siti mutabili sulla base delle delezioni con cui non ricombinano I II d III IV V b c VI VII VIII a Il gene è costituito da un numero molto elevato di siti mutabili; tali subunità hanno la dimensione di 1 nucleotide; la mappa dei siti mutabili entro un gene è ancora lineare;alcuni siti hanno una frequenza di mutazione molto più alta di quella attesa per caso: sono stati chiamati punti caldi e 1 2 3 4 5 6 7 8 9 10 11 12 È possibile mettere in sequenza le delezioni a seconda delle regioni delete che condividono, che ne inibiscono la ricombinazione Si può localizzare ogni nuova mutazione in una delle regioni in cui è suddiviso il gene sulla base delle delezioni con cui ricombinao meno
Scaricare